Какое значение в природе имеет озон и где он применяется кратко
Обновлено: 05.07.2024
Озон — вещество, молекула которого состоит из трех атомов кислорода. Химическая формула озона – O 3 . В нормальных условиях озон представляет собой голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде образует тёмно-синие, практически чёрные кристаллы.
Роль, которую играет озон для человека и для всего живого на Земле стала ясна с открытием озонового слоя. В 1912 году французским физикам Шарлю Фабри и Анри Буиссону с помощью спектроскопических измерений удалось доказать, что в отдалённых слоях атмосферы существует озон, предохраняющий поверхность планеты от губительного воздействия ультрафиолетового солнечного излучения.
Атмосферный озон играет важную роль, защищая растения и животных. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждать растения.



Озон - слово греческого происхождения, которое в переводе означает “пахучий”. Что такое озон? По своей сути, озон О3 - это газ голубого цвета с характерным запахом, который ассоциируется с запахом воздуха после грозового дождя. Особенно ощущается вблизи источников электрического тока.

История обнаружения озона учеными
Что такое озон? Как он был открыт? В 1785 физиком из Голландии Мартином ван Марумом было проведено несколько экспериментов, направленных на исследование воздействия электрического тока на кислород. По их результатам ученый исследовал появление специфической "электрической материи". Продолжая работать в данном направлении, в 1850 году ему удалось определить способность озона взаимодействовать с органическими соединениями и его свойство в качестве окислителя.
Впервые дезинфицирующие свойства озона были применены в 1898 году на территории Франции. В городке Бон Вояж был построен завод, который осуществлял обеззараживание и дезинфекцию воды из реки Вазюби. В России первый завод по озонированию был запущен в Санкт-Петербурге в 1911 году.
Широкое применение озон получил в годы Первой мировой войны в качестве антисептического средства. Озонокислородная смесь применялась для лечения заболеваний кишечника, пневмонии, гепатита и практиковалась при инфекционных поражениях после хирургического вмешательства. Особенно активно озонированием начали заниматься с 1980 года, толчком к этому стало появление на рынке надежных и энергосберегающих генераторов озона. В настоящее время с помощью озона очищают около 95% воды в США и по всей Европе.

Технология образования озона
Что такое озон? Как он образуется? В естественной среде озон находится в атмосфере Земли на высоте 25 км. По сути, это газ, который образуется в результате ультрафиолетового излучения Солнца. На поверхности он образует слой толщиной 19-35 км, который защищает Землю от проникновения солнечной радиации. Согласно трактовке химиков, озон - это активный кислород (соединение трех атомов кислорода). В газообразном состоянии он голубой, в жидком имеет оттенок индиго, а в твердом - это темно-синие кристаллы. О3 - это его молекулярная формула.
Каков вред озона? Он относится к самому высокому классу опасности - это очень ядовитый газ, токсичность которого приравнивается к категории боевых отравляющих веществ. Причиной его появления являются электрические разряды в атмосфере (3O2 = 2O3). В природе почувствовать его можно после сильных вспышек молний. Озон хорошо взаимодействует с другими соединениями и считается одним из самых сильных окислителей. Поэтому его используют для уничтожения бактерий, вирусов, микроорганизмов, для очистки воды и воздуха.

Негативное влияние озона
На что влияет озон? Характерной особенностью этого газа является способность быстро взаимодействовать с другими веществами. Если в природе наблюдается превышение нормативных показателей, то в результате его взаимодействия с тканями человека могут возникнуть опасные вещества и заболевания. Озон - сильнодействующий окислитель, при взаимодействии с которым быстро разрушаются:
-
;
- натуральная резина;
- металлы, за исключением золота, платины и иридия;
- бытовые приборы;
- электроника.
При больших концентрациях озона в воздухе происходит ухудшение здоровья и самочувствия человека, в частности:
- раздражается слизистая оболочка глаз;
- нарушается функционирование органов дыхания, которое приведет к параличу легких;
- наблюдается общая усталость организма;
- появляются головные боли;
- возможно появление аллергических реакций;
- жжение в горле и тошнота;
- происходит негативное влияние на нервную систему.

Полезные свойства озона
Очищает ли озон воздух? Да, несмотря на свою токсичность, этот газ является очень полезным для человека. В небольших концентрациях он отмечается отличными дезинфицирующими и дезодорирующими свойствами. В частности, он губительно действует на вредные микроорганизмы и производит к уничтожению:
- вирусов;
- различных видов микробов;
- бактерий;
- грибков;
- микроорганизмов.
Чаще всего озон используют во время эпидемии гриппа и вспышек опасных инфекционных заболеваний. С его помощью очищают воду от разного рода примесей и соединений железа, при этом обогащают ее кислородом и минералами.
Интересная информация об озоне, сфера его применения
Отличные дезинфицирующие свойства и отсутствие побочных эффектов привели к появлению спроса на озон и его широкому применению в различных отраслях экономики. В наши дни озон успешно используется для:
- удовлетворения потребностей фармацевтической отрасли;
- очистки воды в аквариумах и рыбных хозяйствах;
- дезинфекции бассейнов;
- медицинских целей;
- косметических процедур.
В медицинской отрасли озонирование практикуется при язвах, ожогах, экземах, варикозе, ранах и дерматологических заболеваниях. В косметологии озон применяют для борьбы со старением кожи, целлюлитом и лишним весом.

Влияние озона на жизнедеятельность живых существ
Что такое озон? Как он влияет на жизнь на Земле? Согласно исследованиям ученых, 10% озона находится в тропосфере. Этот озон является составным компонентом смогов и выполняет роль загрязнителя. Он негативно сказывается на дыхательных органах людей, животных и замедляет рост растений. Однако его количество очень мало, чтобы существенно вредить здоровью. Значительная часть вредного озона в составе смогов - это продукты функционирования автомобилей и электростанций.
Значительно больше озона (около 90%) находится в стратосфере. Этот озоновый слой поглощает биологически вредное ультрафиолетовое излучение Солнца, тем самым защищая людей, флору и фауну от негативных последствий.

Химия
При знакомстве с элементами таблицы Менделеева ученики изучают различные химические вещества, а также их производные и формулы. Озон имеет большое значение для природы и человека. Он образуется при разложении соединений, которые выделяют атомарный кислород. Определённая концентрация этого газа делает воздух пригодным для существования большинства живых организмов на суше.
История открытия
Об озоне учёные узнали в 1785 году. Физик Мартин Ван Марум обнаружил этот газ, когда проводил опыты. Специалист пропустил через воздух электрический ток и почувствовал неизвестный запах. Затем он увидел, что возникший газ имел голубой цвет. Позже физик начал изучать незнакомое соединение и узнал, что он сильнее кислорода. Это вещество также воздействовало на ртуть, которая теряла свойственный ей блеск и прилипала к стеклянной поверхности. Учёный думал, что газ служил своеобразной электрической материей.
Физик не знал, что сделал большое открытие. Через время он прекратил дальнейшие исследования нового газа. Об этом веществе вспомнили лишь через 50 лет.

В 1840 году немецкий химик Кристиан Фридрих Шенбейн провёл несколько опытов с озоном и дал ему современное наименование. Через 20 лет учёные Тэт и Эндрюс доказали, что объём газа, в котором кислород превращается в новое соединение, немного уменьшается. Для опыта они взяли стеклянную трубку с манометром и впаянными платиновыми проводниками, которые позволили получить электрический заряд.
В 1880 году с веществом работали французы. Учёные вывели его из кислорода путём понижения температуры до -24 o C. При сжатии газ приобрёл тёмно-синий цвет. Потом химики ещё снизили температуру и сбросили давление. На стекле появились фиолетовые капли жидкого вещества.
Пути получения
Вещество формируется при любых процессах, при которых выделяется атомарный кислород. К примеру, он может образоваться при разложении пероксидов, окислении фосфора и т. д.
В области промышленности голубой газ получают в озонаторе. Через воздух пропускают электрическую искру, в результате чего происходит реакция 3O2→cur2O3. Затем озон выделяют путём дистилляции.
В лаборатории газ получают из пероксида бария. Соединение смешивают с концентрированной серной кислотой. В результате реакции получают озон и сульфат бария.
В медицинских организациях газ часто используют для улучшения состояния больных. Его получают с помощью облучения кислорода ультрафиолетом. Тем же путём вещество образуется и в атмосфере Земли под влиянием солнечных лучей.
Нахождение в атмосфере

Объём газа в атмосфере составляет около 4 млрд тонн. Его уровень повышается с удалением от поверхности Земли. Большая часть озона обнаружена в стратосфере. Озоновый слой можно наблюдать на высоте 22−26 км от поверхности планеты. Он препятствует проникновению ультрафиолета, который опасен для жизни различных земных организмов.
На озоновый слой также воздействуют хладоны, содержащие атомы хлора. Люди создают эти вещества для холодильной техники и заполняют ими аэрозольные баллончики. Когда хладоны попадают в воздух, они медленно поднимаются к озоновому слою. Под воздействием ультрафиолета соединения распадаются и разрушают массу из озона.
Кроме того, надо учитывать то, что люди сегодня вдыхают больше голубого газа, чем в древности. Это объясняется загрязнением воздуха метаном и оксидом азота.
Физические свойства
Молекула газа состоит из трёх атомов кислорода и характеризуется уголковым строением. Химическая формула озона — O3. При нормальных условиях голубой газ имеет резкий запах металла. В жидкой форме озон отличается тёмно-фиолетовым оттенком. В твёрдом виде он представляет кристаллы тёмно-синего или чёрного цвета.
Главные физические характеристики вещества:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8 o C;
- температура плавления — 197,2 o C;
- растворимость в воде при 0 о — 0,394 кг/м 3 .

Плотность газа составляет 2,1445 г/дм 3 . В жидкой форме она равняется 1,59 г/дм 3 , а в твёрдой — 1,73 г/дм 3 . Озон растворяется в H2O быстрее, чем кислород. В газообразном состоянии вещество выступает диамагнетиком, а в жидкой форме — слабым парамагнетиком. Озон хорошо растворяется в хладонах, образуя стабильные растворы. В жидком виде вещество смешивают с азотом, аргоном, метаном и фтором.
Химические особенности
Молекулам голубого газа характерна неустойчивость. После появления они существуют примерно 20−30 минут, а потом разлагаются с образованием кислорода и тепла. Скорость реакции повышается при условиях с высокой температурой или низким атмосферным давлением.

Молекулы вещества приобретают стабильность, когда они преобразуются в отрицательные ионы О3-, которые включены в озониды. Эти соединения могут разлагаться при хранении и при большом объёме воды, а также растворяться в жидком аммиаке.
Когда озон разрушает органические вещества, он выделяет много энергии. При контакте с эфиром, метаном или спиртом происходит самовоспламенение этих веществ. Если смешать озон с этиленом, то произойдёт сильный взрыв.
Газ может уменьшить степень токсичности некоторых соединений. К примеру, озон способен окислять цианиды до цианатов. Эти вещества считаются безопаснее для живых организмов.
Сферы применения
Озон относится к группе веществ 1-го класса опасности. Поскольку он выступает сильным окислителем, он может причинить большой вред здоровью человека и животных.
Несмотря на опасность газа, его применяют в различных сферах жизни:
- стерилизация медицинских инструментов;
- очистка нефтепродуктов и масел;
- фильтрация воды;
- отбеливание бумаги;
- лабораторный и промышленный синтез.

С помощью озона дезинфицируют помещения. Это происходит при помощи бытовых озонаторов. Производители и продавцы советуют сначала прочитать инструкцию по использованию этих предметов, поскольку неправильная эксплуатация изделий может навредить здоровью людей.
В области медицины вещество используют для очистки разных растворов. Следует отметить, что фильтрация воды с помощью этого вещества имеет больше преимуществ, чем хлорирование. В фильтрованной жидкости после обработки озоном нет его остатков и болезнетворных микробов.
Озонотерапевты утверждают, что здоровье больных людей улучшается, если в лечебную программу добавить вещество для перорального или внутривенного приёма. Но не во всех странах озон считают эффективным средством. Учёные провели многочисленные опыты и обнаружили, что это вещество способно уничтожать не только больные, но и здоровые клетки кожи и лёгких. Поэтому озон применяется лишь в качестве альтернативной медицины. Лечение этим веществом возможно только с согласия самих пациентов или в тяжёлых случаях заболеваний, когда другие препараты не помогают.
Воздействие на людей
Многие люди любят гулять после дождя, когда повышен уровень озона. Поскольку этот газ избавляет кислород от вредных веществ, воздух становится свежим и приятным. В это время людям легче дышать, однако озон нельзя долго вдыхать, иначе его высокая концентрация в человеческом организме может привести к смерти.
При частом вдыхании газа могут появиться боли в голове, головокружение и понижение давления. Кроме того, снижается иммунитет, который перестаёт бороться с болезнетворными бактериями.
Специалисты утверждают, что допустимая концентрация вещества в воздухе должна быть не более 0,1 мкг/л. Если поместить человека в помещение, в котором уровень озона превышает 0,4 мкг/л, то у него будут наблюдаться сильные боли в груди, кашель, бессонница и ухудшение зрения. Концентрация газа больше 2 мкг/л приведёт к более тяжёлым последствиям.
Интересная информация
Современные учёные продолжают изучать свойства озона. Но об этом веществе уже известно немало интересных фактов:

- В малых концентрациях запах озона напоминает хлор или сернистый газ.
- Голубой газ формируется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- В стоматологии вещество используют вместо антибиотиков.
- Озон стали применять для фильтрации воды ещё в 1898 году.
- Газ соединяется с другими соединениями быстрее, чем кислород.
- Наибольшую озоновую дыру диаметром свыше 1000 км учёные обнаружили над Антарктидой в 1985 году.
- В период Первой мировой войны люди использовали вещество в качестве антисептика.
- Международный день охраны озонового слоя отмечают с 16 сентября 1987 года.
- При смешении с кислородом озон образует пероксиацетилнитрат. Это вещество затрудняет дыхание, вызывает слезотечение и может привести к параличу сердца.
Дальнейшее изучение озона необходимо по многим причинам. Озоновые дыры, которые то появляются, то исчезают, влияют на живые организмы и планету в целом. Однако с открытием полезных свойств вещества люди всё ещё пытаются найти ему применение и в других сферах жизни.
На уроках химии ученики знакомятся с таблицей Менделеева, а также изучают структурные формулы и производные разных веществ. Поскольку эта наука тесно связана со всеми сферами жизни человека, необходимо уделить ей внимание. Много интересной информации имеется об озоне. Химическим элементом, который его образует, выступает кислород. Газ делает состав воздуха пригодным для существования на суше.
- История открытия
- Способы получения
- Вещество в атмосфере
- Физические особенности
- Химическая природа
- Области использования
- Влияние на здоровье человека
- Занимательные факты
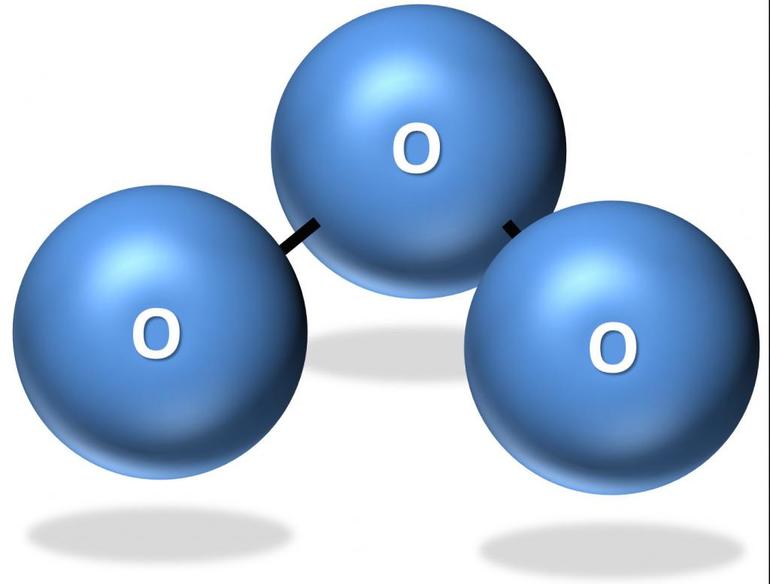
История открытия

Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
В 1860 году было доказано, что при превращении кислорода в озон объём газа уменьшался. Для опытов химики Тэт и Эндрюс использовали стеклянную трубку с манометром, наполненную O2, с впаянными в неё проводниками из платины, которые способствовали получению электрического заряда.
В 1880 году французские учёные Готфейль и Шаппюи смогли получить вещество из кислорода при температуре -23 o C. Когда газ медленно сжимался, он постепенно приобретал тёмно-синий оттенок. Затем давление резко сбросили, а температура ещё понизилась, что привело к образованию фиолетовых капель жидкого озона. Если вещество не охлаждали или быстро сжимали, тогда оно переходило в кислород с мгновенной жёлтой вспышкой.
Способы получения
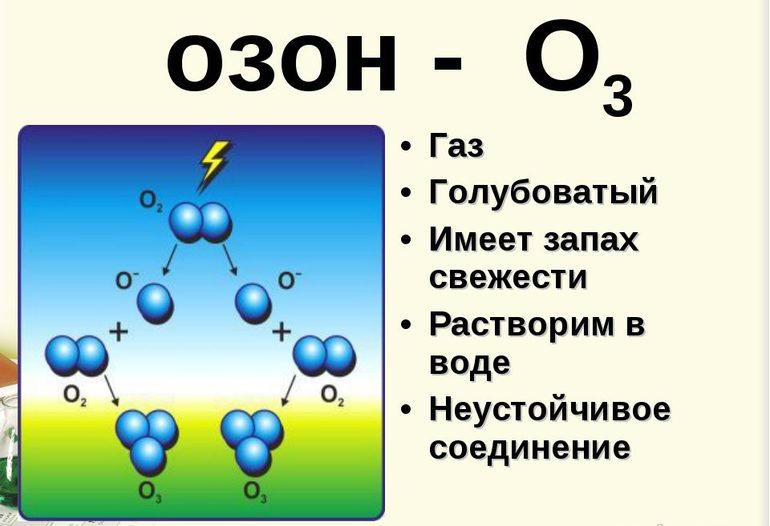
Газ образуется во многих процессах, которые сопровождаются выделением атомарного кислорода. Озон формируется при разложении пероксидов, окислении фосфора и т. д.
В промышленной сфере вещество получают в специальном оборудовании, которое называют озонатор. Через воздух проводят электрическую искру, которая даёт реакцию 3O2→cur2O3. Получившийся газ отделяют фракционной перегонкой.
В лабораторных условиях используют пероксид бария, который обрабатывают концентрированной серной кислотой. В результате реакции получаются сульфат бария и озон.
В медицинских учреждениях, где вещество применяют для оздоровления пациентов, средство получают путём облучения кислорода ультрафиолетом. Именно этим способом газ образуется и в атмосфере нашей планеты под воздействием солнца.
Вещество в атмосфере
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
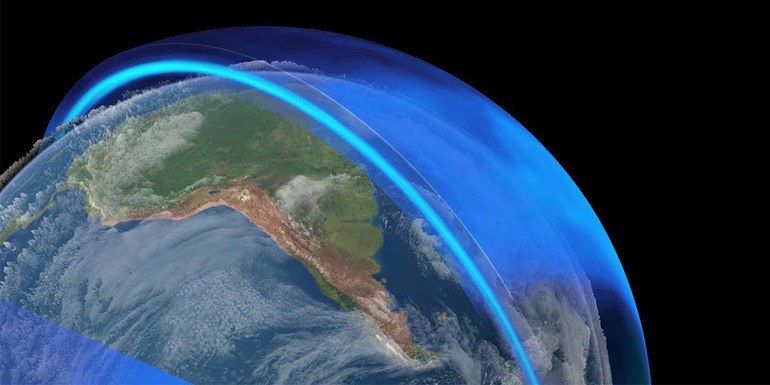
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Также следует учитывать тот факт, что сегодня люди вдыхают больше озона, чем в далёком прошлом. Это связано с загрязнением воздуха большими объёмами метана и оксидов азота.
Физические особенности

Вещество представляет аллотропную модификацию кислорода, состоящую из трёхатомных молекул. Химическая формула озона и обозначение — O 3 . При нормальных условиях вещество выглядит как голубой ядовитый газ с резким запахом, напоминающим металлический аромат. При сжижении преобразуется в жидкость оттенка индиго. В твёрдом состоянии выглядит как тёмно-синие или чёрные кристаллы. Полярная молекула отличается уголковым строением. Между атомами имеется две связи О-О.
Основные физические свойства озона:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8 o C;
- температура плавления — 197,2 o C;
- растворимость в воде при 0 о — 0,394 кг/м 3 .
Плотность озона в газообразном состоянии равна 2,1445 г/дм 3 , в жидком — 1,59 г/см 3 , в твёрдом — 1,73 г/см 3 . Ещё одна важная характеристика вещества — его молекулярная кристаллическая решётка.
O 3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Химическая природа

Молекулы озона отличаются неустойчивостью. После образования они существуют около 10−30 минут, а затем начинают разлагаться, образуя кислород и большой объём тепла. Если температура окружающей среды будет высокой, тогда процесс реакции ускорится. Тот же эффект наблюдается и при понижении атмосферного давления.
Среди химических свойств озона следует выделить его высокую реакционную способность. Он окисляет металлы (за исключением платины, золота и иридия), органические вещества, а также повышает степень окисления у оксидов. Действующим началом газа в качестве окислителя выступает атомарный кислород, который образуется при распаде молекулы озона. Однако в некоторых случаях в окислении участвуют все три атома элемента. Озон считается сильным окислителем, хотя уступает в этом плане фтору и фториду кислорода.
Молекула газа становится стабильнее, если она превращается в отрицательный ион О3-. Такие анионы содержатся в озонидах (озонокислых солях). Соединения разлагаются во время хранения или при избытке H2O. Озонокислые соли хорошо растворяются в жидком аммиаке.
Озон разрушает все органические вещества, с которыми он контактирует. При реакции выделяется большое количество энергии. К примеру, такие вещества, как эфир, спирт или метан, самовоспламеняются, когда они соприкасаются с озонированным воздухом. При смешении этилена и озона произойдёт сильный взрыв.
Газ способен уменьшать токсичность некоторых веществ. Например, он может окислить цианиды до цианатов, которые безопаснее для живых организмов.
Области использования
В Российской Федерации озон относится к группе вредных веществ первого класса опасности. Сильные окислительные свойства делают его опасным для здоровья человека. Однако вещество широко используется в разных сферах.
Основные области применения озона:
- стерилизация медицинских инструментов;
- отбеливание бумаги;
- очистка нефтепродуктов и масел;
- лабораторный и промышленный синтез.
Озон применяется для дезинфекции одежды и помещений, озонирования растворов медицинского назначения. Также вещество используется в качестве дезинфицирующего средства при очистке воздуха и воды от вредных микроорганизмов.
Озонирование воды имеет много преимуществ перед хлорированием, поскольку в обработанной жидкости отсутствуют токсины. Кроме того, озон лучше растворяется в воде.

Если верить заявлениям озонотерапевтов, здоровье пациентов значительно улучшается, когда лечение включает пероральное или внутривенное применение вещества. Однако пока нет объективных клинических подтверждений терапевтического эффекта. Сегодня озонотерапию используют только в некоторых частных клиниках развитых стран, где она не считается лечебным методом. Поскольку доказано мутагенное и токсическое действие этого вещества, пациентов лечат озоном только с их согласия и лишь в тяжёлых случаях.
С начала XXI века многие компании начали выпускать бытовые озонаторы. Такие устройства предназначены для дезинфекции помещений. Перед их использованием необходимо прочитать инструкцию по применению техники. Поскольку некоторые фирмы не пишут в аннотациях о мерах безопасности при работе с озонаторами, не рекомендуется приобретать их продукцию.
Влияние на здоровье человека

Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Опасный газ может образовывать с кислородом другое опасное вещество — пероксиацетилнитрат. Органическое соединение затрудняет дыхание и вызывает слезоточивость. Высокие концентрации этого вещества могут привести к параличу сердца.
Занимательные факты
Озон вызывает большой интерес не только у учёных, но и у обычных людей. Хотя это вещество ещё не полностью изучено, о нём уже имеется немало занимательной информации:

- Озон эффективно уничтожает бактерии и плесень.
- В малых концентрациях запах вещества может напоминать хлор, сернистый газ или даже чеснок.
- Озон образуется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- Он применяется в стоматологии вместо антибиотиков.
- Для очистки воды вещество начали использовать в 1898 году во Франции.
- Во время Первой мировой войны его применяли в качестве антисептического средства.
- Самая большая озоновая дыра была обнаружена над Антарктидой в 1985 году. Это явление отличается диаметром свыше 1000 км.
- Молнии Кататумбо считаются крупнейшим одиночным генератором озона в тропосфере нашей планеты.
Вещество продолжают изучать не только из-за озоновых дыр, которые могут повлиять на будущее людей и всех других живых организмов. Хотя озон опасен, учёные считают, что он способен заменить многие лечебные средства при борьбе с тяжёлыми заболеваниями.
Читайте также:

