Какие системы называют эмульсиями пенами кратко
Обновлено: 02.07.2024
Эмульсии - особый вид дисперсных систем, дисперсная фаза и дисперсионная среда являются взаимонерастворимыми жидкостями, это системы Ж/Ж.
Свойства эмульсий
В зависимости от состава дисперсной фазы и дисперсионной среды могут быть прямые и обратные эмульсии.
Прямые эмульсии типа М/В - дисперсия масла в воде.
Обратные эмульсии типа В/М - дисперсия воды в масле. Пример прямой эмульсии - молоко, пример обратной эмульсии - маргарин, нефть.
В зависимости от концентрации раздробленной фазы эмульсии могут быть разбавленными (0,1%), концентрированными (0,1% - 75%), высококонцентрированными (свыше 75 %).
В разбавленных эмульсиях концентрация дисперсной фазы невелика, поэтому их свойства не отличаются от свойств дисперсионной среды.
Стремление поверхностной энергии к минимуму, вследствие подвижности жидкой границы раздела, приводит к самопроизвольному снижению поверхности раздела фаз. По этой причине капли разбавленных и концентрированных эмульсий приобретают шарообразную форму.
При концентрации дисперсной фазы свыше 75% наблюдается деформация жидкости, обрамляющей капли дисперсной фазы, ее сферичность нарушается, а эмульсия приобретает новые свойства. Подобные эмульсии образуют структуру - маргарин.
Устойчивость эмульсий
Эмульсии могут быть лиофильными и лиофобные. Лиофильные - термодинамически устойчивы и образуются самопроизвольно путем диспергирования массы жидкости до капель.
Большинство эмульсий относится к лиофобным системам - они термодинамически неустойчивы, не могут образовываться самопроизвольно, существовать длительное время, нуждаются в стабилизации. Разрушение и потеря агрегативной устойчивости происходит в несколько стадий. Первая - контакт по крайней мере двух капель. Вторая - образование агрегатов.
Устойчивость эмульсий зависит от ряда причин : поверхностного натяжения, свойств и структуры граничных слоев.
Повышения устойчивости лиофобных эмульсий достигают введением веществ эмульгаторов, способных стабилизировать эмульсии.
Эмульгаторы могут быть гидрофобные и гидрофильные.
Гидрофильные эмульгаторы - ПАВ. Стабилизируют прямые эмульсии. Полярные радикалы образующегося на границе раздела фаз адсорбционного слоя ПАВ находятся на наружной стороне капель масла, препятствуя их сближению (рис. 14.1, а)
Рис.14.1. Адсорбция молекул ПАВ в прямых (а) и обратных (б) эмульсиях.
Эти же вещества в эмульсиях обратного типа адсорбируются на внутренней поверхности капель воды (14.1, б), образующийся адсорбционный слой не является препятствием для слипания капель. Поэтому стабилизацию обратных эмульсий нужно производить с помощью ПАВ, которые лучше растворяются в масле, чем в воде.
Ориентация адсорбционного слоя ПАВ происходит в соответствии с правилом уравнивания полярности Ребиндера:
полярная группа молекул ПАВ обращена к полярной жидкости, а неполярный радикал - к неполярной.
Соотношением между гидрофильными и гидрофобными частями молекул ПАВ определяется:
1.Эффективность эмульгатора. Гидрофильные свойства определяются взаимодействием полярных групп молекул ПАВ с водой. Гидрофобный радикал обуславливает взаимодействие между неполярной цепью ПАВ и маслом. Лиофильное взаимодействие ПАВ и масла будет гидрофобным по отношению к воде.
2.Поверхностная активность. Для короткоцепочечных ПАВ преобладает гидрофильное взаимодействие, в результате которого молекулы втягиваются в воду. Длинноцепочечные молекулы ПАВ - гидрофобное взаимодействие.
Уравновешивание гидрофильного и лиофильного взаимодействий называется гидрофильно-липофильным балансом (ГЛБ). То есть определенное оптимальное соотношение действия воды и масла на молекулы ПАВ определяет условия образования адсорбционного слоя на границе раздела двух жидкостей.
ГЛБ - эмпирическая безразмерная величина:
ГЛБ = ( b + y n )/а (14.1)
где n - число групп СН2 в углеводородном радикале, y - свободная энергия взаимодействия в расчете на одну СН2 группу, b - безразмерный параметр, зависящий от природы ПАВ, а - сродство полярной группы молекулы ПАВ к воде.
Действие адсорбционных слоев ПАВ, экранирующих границу раздела фаз, зависит от свойств ПАВ и жидкостей, образующих эмульсию. Прочные адсорбционные слои образуют белки, углеводы, имеющие слабую поверхностную активность.
Роль эмульгаторов могут выполнять порошки. Действие порошков эмульгаторов обеспечивается особым положением частиц порошка на границе раздела двух жидких фаз.
Получение и разрушение эмульсий
Эмульсии могут образовываться самопроизвольно или получаться искусственно в результате диспергирования или гомогенизации.
Самопроизвольное эмульгирование характерно для лиофильных систем и определяется минимальным значением межфазового поверхностного натяжения.
Механическое диспергирование жидкостей достигается перемешиванием, встряхиванием или вибрацией. Эффективность повышается в присутствии эмульгаторов.
Для получения и стабилизации эмульсий используют гомогенизацию - продавливание жидкостей через отверстия.
Разрушение эмульсий происходит самопроизвольно или под действием деэмульгаторов. Самопроизвольное разрушение характерно для лиофобных эмульсий. Деэмульгирование происходит в результате фазового перехода дисперсионной среды или дисперсной фазы. Например, при нагревании капли дисперсной фазы могут испариться и эмульсия перейдет в пену.
Способ разрушения эмульсий - обращение фаз, то есть, например, превращение прямой эмульсии в обратную. Обращение фаз осуществляется при определенных условиях: наличие высококонцентрированных эмульсий, механическое воздействие, присутствие эмульгаторов.
Применение эмульсий
1.Производство продуктов питания.
2.Производство фармацевтических препаратов.
3.Строительство (битумные эмульсии)
4.Синтез различных веществ.
5.Получение пористых органических сорбентов, мембран, покрытий.
Свойства и особенности пен
Пены - дисперсные системы типа Г/Ж, дисперсная фаза - газ или пар, дисперсионная среда - жидкость. Пены - высококонцентрированные дисперсные системы. Разбавленные системы типа Г/Ж - газовые эмульсии. В разбавленных системах происходит обратная седиментация - всплывание пузырьков газа.
В отличие от других дисперсных систем, которые характеризуются концентрацией дисперсной фазы, пены характеризуются содержанием дисперсной фазы. Так как масса и объем газовой дисперсной фазы непостоянны и быстро меняются, то общее объемное содержание дисперсной фазы характеризуется кратностью пены b , которая показывает, во сколько раз объем пены V п превышает объем жидкости V ж, необходимой для ее формирования:
где V п, V г, V ж - объемы пены, газовой дисперсной фазы, жидкой дисперсионной среды.
Относительная доля воздуха в пенах:
Классификация пен
полусухие 10 b 100.
С увеличением кратности пены растет диаметр пузырьков.
Межфазовое поверхностное натяжение пен определяется свойствами жидкости и газовой среды. Если эти свойства не изменяются, то поверхностное натяжение будет величиной постоянной. При уменьшении энергии Гиббса начинается самопроизвольное разрушение пен.
В пене происходит контакт пузырьков, разделенных слоем жидкости. При осуществлении контакта четырех пузырьков одного размера возникает неустойчивое равновесие, которое нарушается и переходит в устойчивое равновесие трех пузырьков.
Пленки жидкости между пузырьками, образуют треугольники Плато (рис.14.2)
Рис.14.2.Треугольник Плато:1 - пленки жидкости, 2 - канал.
В каждом ребре многогранника сходятся три жидкие пленки, которые являются стенками пузырьков. Эти пленки образуют между собой углы, близкие к 120 0 . В местах стыков пленок образуются утолщения - каналы. Четыре канала сходятся в одной точке, образуя узлы.
Разрушению пены способствует укрупнение пузырьков пены. Этот процесс происходит в результате диффузии газов из мелких пор в более крупные и за счет прорыва слоя жидкости между пузырьками.
Коллоидно-химические и физико-химические свойства пен
1.Электроосмос и потенциал течения.
2.Поглощение и рассеяние света.
3.Капиллярное давление внутри пузырьков.
Устойчивость и получение пен
Пены - термодинамические неустойчивые лиофобные дисперсные системы. Избыточная поверхностная энергия вызывает процессы, которые ведут к увеличению размеров пузырьков, уменьшению дисперсности пены и ее разрушению и определяют агрегативную неустойчивость пен.
Основной параметр, характеризующий агрегативную устойчивость пен, является скорость уменьшения в единице объема пены удельной поверхности или увеличение размера пузырьков.
На практике оценку агрегативной и седиментационной устойчивости пен проводят при помощи коэффициента устойчивости Ку:
V п - первоначальный объем пены, t р - время разрушения пены.
Коэффициент устойчивости определяют по времени жизни столбика пены высотой 3- 5 см .
Пенам придают устойчивость ПАВ.
Для получения пен и для придания им устойчивости применяют пенообразователи. Два типа пенообразователей:
1.Дают малоустойчивые пены - спирты, ПАВ, не обладающие моющим действием.
2.Мыла и синтетические ПАВ.
Факторы, определяющие устойчивость пен :
На практике иногда нужно исключить пенообразование. Для разрушения образующейся пены применяют механические, физические и химические способы.
Механические - струя воздуха. Физические - термическое воздействие. Химические - применение веществ-пеногасителей (жиры, масла).
АЭРОЗОЛИ
Аэрозоли - дисперсные системы, в которых частицы дисперсной фазы находятся во взвешенном состоянии. Дисперсионная среда - газ, дисперсная фазы - твердая.(Т/Г).
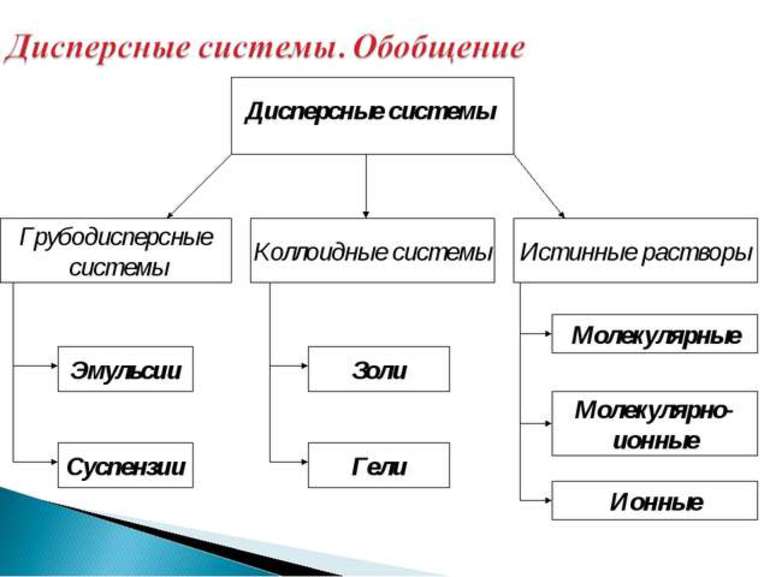
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению истинных растворов и дисперсных систем: способам выражения концентрации растворов, видам дисперсных систем, их свойствам, способам коагуляции золей, строению гелей.
Аэрозоль – грубодисперсная система, в которой твёрдые или жидкие частицы размером более 10 -3 см равномерно распределены в газообразной среде.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Грубодисперсная система – дисперсная система, в которой размер частиц дисперсной фазы более 10 -3 см.
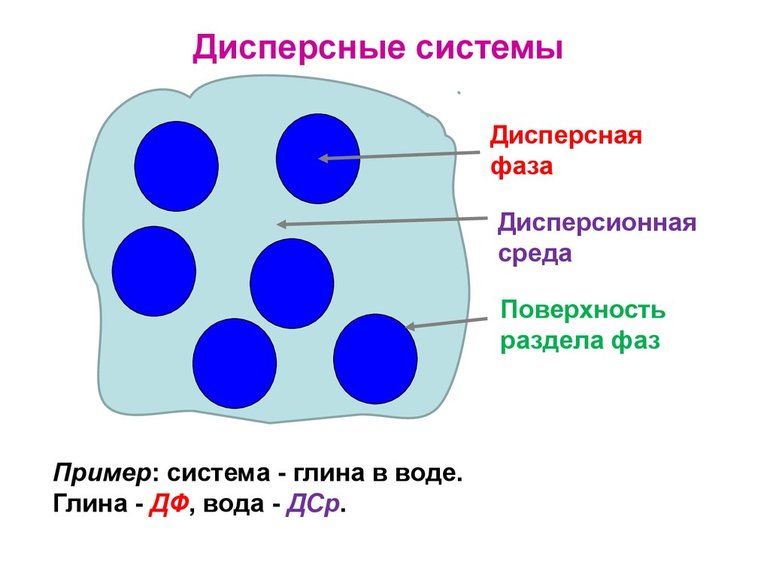
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Золь (коллоидный раствор) – тонкодисперсная система, в которой твёрдые частицы дисперсной фазы размером 10 -7 – 10 -5 см равномерно распределены в жидкой среде.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10 -3 см равномерно распределены в жидкой дисперсионной среде.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Истинные растворы
Истинным раствором называется гомогенная система, состоящая из нескольких компонентов, состав которой в определённых пределах можно менять без нарушения однородности.
Растворимостью называется такое количество вещества, которое можно при данной температуре растворить в 100 г растворителя. Абсолютно нерастворимых веществ в природе не существует.

Молярная концентрация показывает количество растворённого вещества в 1 литре раствора. Сокращенно молярная концентрация, или молярность, обозначается буквой М, например, 1 М – один моль на литр. моль/л.
Для того, чтобы найти молярную концентрацию по величине известной массовой доли, необходимо знать плотность раствора. При этом массовая доля должна быть выражена не в процентах, а в долях, а плотность – в г/л.

, моль/л.
С истинными растворами мы постоянно встречаемся в жизни. Пьём чай с сахаром, консервируем овощи. В сельском хозяйстве используют растворы минеральных удобрений и средств для борьбы с вредителями и болезнями растений. Растворы используют в промышленности, в медицине, в учебных и научно-исследовательских химических лабораториях.
Дисперсные системы
Дисперсной называется гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена во второй, сплошной фазе. В отличие от истинных растворов, дисперсная система неоднородна, а между составляющими её фазами всегда существует граница раздела. Мелкораздробленная фаза называется дисперсной фазой, а сплошная фаза – дисперсионной средой. В зависимости от размера частиц дисперсной фазы различают грубодисперсные (размер частиц больше 100 нм) и тонкодисперсные (от 1 до 100 нм), или коллоидные системы. Если размер частиц дисперсной фазы становится меньше 1 нм, система перестает быть гетерогенной, образуется истинный раствор. В истинном растворе вещество раздроблено до отдельных молекул или ионов. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды дисперсные системы разделяют на суспензии, эмульсии, пены и аэрозоли. В суспензии твёрдые частицы распределены в жидкости. Эмульсия состоит из мелких капель жидкости, равномерно распределённых в другой жидкости, причем эти жидкости взаимно нерастворимы. Пена – это мелкие пузырьки газа в жидкости. Аэрозоль представляет собой газообразную среду, в которой распылены мелкие твёрдые или жидкие частицы.
Получение и свойства коллоидных растворов
Образование заряда на поверхности коллоидных частиц
Коллоидные частицы перемещаются в постоянном электрическом поле, так как они заряжены. Заряд на поверхности коллоидных частиц образуется по двум причинам. Одна из причин – адсорбция заряженных ионов на поверхности частиц дисперсной фазы. Огромное количество мелких частиц дисперсной фазы имеют большую суммарную поверхностную энергию. За счет этой энергии ионы из раствора, одноименные с частицами дисперсной фазы, притягиваются к поверхности, в результате коллоидные частица приобретают заряд. Например, коллоидная частица хлорида серебра, полученная в избытке ионов Cl - , имеет строение (mAgCl)·nCl - .
Другая причина образования заряда на поверхности коллоидных частиц – ионизация нерастворимых молекул. По такому механизму образуется заряд на поверхности коллоидных частиц золя кремниевой кислоты. Полярные молекулы воды отрывают от поверхностных молекул кремниевой кислоты ионы водорода, в результате на поверхности коллоидной частицы остаются заряженные гидросиликат ионы, которые придают заряд коллоидной частице. Коллоидные частицы золя кремниевой кислоты имеют строение (mH2SiO3)·nHSiO3 - .
Для золей, как и для истинных растворов, характерно броуновское движение, а тяжёлые и крупные частицы грубодисперсных систем в броуновском движении не участвуют. Одноимённые заряды коллоидных частиц препятствуют их слипанию, поэтому золи длительное время остаются устойчивыми. Размеры частиц дисперсной фазы в грубодисперсных системах слишком большие, со временем они оседают – происходит седиментация.
Коагуляция коллоидных растворов
Если к золю добавить раствор электролита, произойдет нейтрализация заряда коллоидных частиц. Золь потеряет устойчивость, частицы начнут слипаться. Слипание коллоидных частиц называется коагуляцией. Коагуляцию можно вызвать длительным нагреванием золя, а также сливанием золей с противоположно заряженными частицами. Если коллоидные частицы слабо взаимодействуют с дисперсионной средой, то в результате коагуляции образуется осадок. Если коллоидные частицы хорошо взаимодействуют с растворителем, то они захватывают часть жидкости, в результате образуется гель. Гель – трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в ячейках удерживается жидкость.
Дисперсные системы в природе и на службе у человека
Коллоидные растворы широко распространены в природе. Плазма крови, яичный белок, сырая нефть, речная и озёрная вода, почвенный раствор являются золями. Дисперсными системами являются облака, туман, дым, морская пена, молоко, газированная вода. В промышленности и быту человек использует эмульсионные краски, клеи, лаки, косметические и лечебные гели и шампуни. В пищевой промышленности дисперсными системами являются тесто, желе, студни, соусы, бульоны, мармелад, суфле. Без преувеличения можно сказать, что коллоидная химия – это химия реальных систем.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Приготовление насыщенного раствора
Условие задачи: Для приготовления насыщенного раствора поваренной соли надо в 100 г воды растворить 36 г хлорида натрия. Какое количество (моль) поваренной соли будет растворено в 360 г насыщенного раствора? Ответ запишите с точностью до десятых долей.
Шаг первый: найдём массу насыщенного раствора соли, в котором растворено 36 г хлорида натрия. Для этого сложим массу растворителя и растворённого вещества:
Шаг второй: найдём массу хлорида натрия, которая содержится в 360 г насыщенного раствора. Для этого составим пропорцию:
В 136 г насыщенного раствора содержится 36 г хлорида натрия;
в 360 г такого же раствора содержится т г хлорида натрия.
т = (360·36) : 136 = 95,3 (г).
Шаг третий: вычислим молярную массу хлорида натрия:
М = 23 + 35 = 58 (г/моль).
Шаг четвертый: найдём, сколько моль хлорида натрия содержится в 95,3 г.
Для этого массу хлорида натрия разделим на его молярную массу:
95,3 : 58 = 1,6 (моль).
2. Расчёт объёма раствора, который можно приготовить из раствора известной концентрации
Условие задачи: Какой объём 0,25 М раствора NaOH можно приготовить из 200 мл раствора гидроксида натрия с массовой долей 12% и плотностью 1,13 г/см 3 ? Ответ запишите в мл в виде целого числа.
Шаг первый: найдём массу 200 мл 12%-ного раствора.
Для этого умножим объём раствора на его плотность:
Шаг второй: найдём массу гидроксида натрия, которая содержится в 226 г 12%-ного раствора.
Для этого составим пропорцию:
В 100 г раствора содержится 12 г гидроксида натрия;
в 226 г раствора содержится т г гидроксида натрия.
т = (226·12) : 100 = 27,12 (г)
Шаг третий: найдём количество моль гидроксида натрия, которое содержится в 27,12 г.
Для этого вычислим молярную массу гидроксида натрия:
М = 23 + 16 + 1 = 40 (г/моль).
Теперь разделим массу гидроксида натрия на его молярную массу:
27,12 : 40 = 0,68 (моль).
Шаг четвёртый: Найдём объём раствора, в котором это количество гидроксида натрия составит концентрацию 0,5 М.
По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10 - 5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10 - 5 до 10 - 7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10 - 7 до 10 - 9 м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать роль дисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.
Эта классификация была предложена Оствальдом и широко используется до настоящего времени. Недостатком классификации следует считать невозможность отнесения дисперсных систем, приготовленных с твердой или жидкой дисперсной фазой, к какому-либо классу, если размер частиц составляет несколько нанометров. Пример такой классификации приведен в табл. 1.
Академик П.А. Ребиндер предложил более совершенную классификацию дисперсных систем по агрегатным состояниям фаз. Он разделил все дисперсные системы на два класса: свободнодисперсные системы и сплошные (или связнодисперсные) системы (табл. 2 и 3). В свободнодисперсных системах дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов). Эти системы называют золями. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры (сетки, каркасы, фермы). Такие системы оказывают сопротивление деформации сдвига. Их называют гелями.
Дисперсная система по классификации Ребиндера обозначается дробью, в которой дисперсная фаза ставится в числителе, а дисперсионная среда – в знаменателе. Например: Т1/Ж2. Индекс 1 обозначает дисперсную фазу, а индекс 2 – дисперсионную среду.
Коллоидная химия изучает свойства как тонко-, так и грубодисперсных систем; как свободно-, так и связнодисперсных систем.
Включение в одну науку столь большого количества разнообразных систем, различных как по природе фаз, так и по размерам частиц и агрегатному состоянию фаз, основано на том, что все они обладают общими свойствами - гетерогенностью и принципиальной термодинамической неустойчивостью. Центральное место в коллоидной химии занимают ультрамикрогетерогенные системы со свободными частицами. Это - так называемые, коллоидные системы.
Рубиновое стекло; пигментированные волокна; сплавы; рисунок на ткани, нанесенный методом пигментной печати
Жемчуг, вода в граните, вода в бетоне, остаточный мономер в полимерно-мономерных частицах
Газовые включения в различных твердых телах: пенобетоны, замороженные пены, пемза, вулканическая лава, полимерные пены, пенополиуретан
Пены, в том числе для пожаротушения и пенных технологий замасливания волокон, беления и колорирования текстильных материалов
Туманы, газы в момент сжижения
Коллоидные системы необычайно лабильны, т.е. неустойчивы. Для многих из них достаточно прибавления ничтожного количества электролита, чтобы вызвать выпадение осадка. Причина столь легкого изменения состояния коллоидных систем связана с непостоянством степени их дисперсности. Различают два вида устойчивости любой раздробленной системы - кинетическую и агрегативную.
Примеры свободнодисперсных систем
Понятие агрегативной устойчивости, которое впервые ввел Н.П. Песков, подразумевает отсутствие агрегирования, т.е. снижения степени дисперсности коллоидной системы при хранении. Для определения кинетической устойчивости необходимо изучать условия выделения диспергированных частиц в гравитационном или центробежном поле. Скорость подобного выделения зависит от интенсивности броуновского движения частиц, т.е. от степени дисперсности системы и разности плотности дисперсионной среды и дисперсной фазы, а также от вязкости среды.
Связнодисперсные системы
1. Системы с жидкой поверхностью раздела фаз
2. Системы с твердой поверхностью раздела фаз
Если хотят определить агрегативную устойчивость системы, то исследуют условия постоянства (или напротив - непостоянства) степени дисперсности системы. Одно из самых резких и характерных отличий коллоидной системы как от истинного раствора, так и от грубодисперсных систем состоит в том, что их степень дисперсности является чрезвычайно непостоянной величиной и может изменяться в зависимости от самых разнообразных причин.
В основе этой классификации лежит агрегатное состояние поверхности раздела фаз.
На основании изложенного выше дадим определение коллоидным системам.
Коллоидными системами называют двух-или многофазные системы, в которых одна фаза находится в виде отдельных мелких частиц, распределенных в другой фазе. Такие ультрамикрогетерогенные системы с определенной (коллоидной) дисперсностью проявляют способность к интенсивному броуновскому движению и обладают высокой кинетической устойчивостью.
Имея высокоразвитую поверхность раздела фаз и, следовательно, громадный избыток свободной поверхностной энергии, эти системы являются принципиально термодинамически неустойчивыми, что выражается в агрегации частиц, т.е. в отсутствии агрегативной устойчивости. Однако этими свойствами не исчерпываются все особенности, которыми коллоидные системы отличаются от других систем. Так, например, на первый взгляд кажется непонятным, почему коллоидные частицы, совершая энергичные движения и сталкиваясь между собой, не всегда слипаются в более крупные агрегаты и не выпадают в осадок, как этого следовало бы ожидать на основании второго закона термодинамики, так как при этом уменьшалась бы общая поверхность, а с ней и свободная энергия.
Оказывается, во многих случаях устойчивость таких систем связана с наличием слоя стабилизатора на поверхности коллоидных частиц. Таким образом, необходимым условием создания устойчивых коллоидных систем является присутствие третьего компонента - стабилизатора. Стабилизаторами коллоидных систем могут быть электролиты или некоторые другие вещества, не имеющие электролитной природы, например высокомолекулярные соединения (ВМС) или поверхностно-активные вещества (ПАВ). Механизм стабилизации электролитами и неэлектролитами существенно различен.
Влияние электролитов на устойчивость коллоидных систем носит сложный характер. В одних случаях ничтожные добавки электролита способны привести к нарушению устойчивости системы. В других - введение электролита способствует увеличению стабильности.
Образование адсорбционных слоев таких стабилизаторов, как ПАВ, приобретает особенно большое значение при наличии двухмерных структур, обладающих повышенными структурно-механическими свойствами. Во многих случаях стабилизация достигается при покрытии монослоем всего 40-60 % поверхности коллоидных частиц, когда защитный слой имеет прерывистый характер (в форме островков). Максимальная устойчивость достигается, естественно, при образовании полностью насыщенного мономолекулярного слоя. Структурно-механические свойства адсорбционных слоев в значительной мере определяют поведение коллоидных систем. Эти слои могут быть образованы или изменены небольшими количествами каких-либо растворенных веществ, поэтому создается возможность регулирования ряда свойств коллоидных систем, что широко используется в различных практических приложениях.
Коллоидные системы, состоящие из частиц диспергированного вещества, способных свободно перемещаться в жидкой дисперсионной среде совместно с адсорбированными на их поверхности молекулами или ионами третьего компонента (стабилизатора), называют лиозолями, а сами частицы, обладающие сложным строением - мицеллами.
По характеру взаимодействия коллоидных частиц с дисперсионной средой лиозоли могут быть разделены на лиофильные и лиофобные. Впервые эта классификация была предложена немецким ученым-коллоидником Фрейндлихом. Он разделил все системы на два класса – лиофильные и лиофобные. В соответствии с представлениями, развитыми Фрейндлихом, лиофобными называют системы, частицы дисперсной фазы которых не взаимодействуют с дисперсионной средой, не сольватируются и не растворяются в ней. Лиофильные- это системы, частицы дисперсной фазы которых интенсивно взаимодействуют с дисперсионной средой.
К лиофобным системам относятся золи драгоценных металлов, золи металлоидов (серы, селена, теллура), дисперсии полимеров в воде (например, полистирола, фторолона), золи сульфидов мышьяка, сурьмы, кадмия, ртути, золи гидроксидов железа, алюминия и т.д. Эти системы характеризуются, так называемой, кинетической устойчивостью и агрегативной неустойчивостью и требуют стабилизации. К лиофильным коллоидным системам Фрейндлих отнес растворы, образующиеся при растворении природных или синтетических ВМС. Таковы растворы белков, крахмала, пектинов, камедей, эфиров целлюлозы и разнообразных смол, как природных так и синтетических.
Таким образом, растворы ВМС рассматривались ранее как лиофильные коллоидные системы. Они считались двухфазными дисперсными системами и таким образом сущность классификации Фрейндлиха сводилась к молекулярным взаимодействиям между дисперсной фазой и дисперсионной средой. Именно на этом основании проводилось разделение на лиофильные и лиофобные системы. Лиофильные системы считались двух- или многофазными, термодинамически неустойчивыми, неподчиняющимися правилу фаз Гиббса. Но такое представление оказалось неправильным. На самом деле в настоящее время достоверно установлено, что растворы ВМС - это истинные растворы, т.е. однофазные системы, гомогенные, термодинамически устойчивые и подчиняющиеся правилу фаз Гиббса. Считалось, что обратимость - это характерное свойство лиофильных коллоидных систем, но это не так, потому что в данном случае растворы ВМС не являются дисперсными системами.
В связи с этим академик В.А. Каргин еще в 1948 г. обратил внимание на то, что классификация Фрейндлиха совершенно неверна и даже более того - вредна.
Чтобы не менять смысла этих терминов, П.А. Ребиндер предложил оформить понятия лиофильные и лиофобные коллоидные системы. Дисперсные много-или двухфазные системы он разделил на два класса, исходя из величины удельной межфазовой энергии (поверхностного натяжения).
К лиофобным системам были отнесены дисперсные системы с достаточно высоким межфазовым натяжением (s12), большим некоторого граничного значения sm:
Эти системы характеризуются большой межфазовой свободной энергией, поэтому граница раздела фаз выражена резко: система является агрегативно неустойчивой и требует введения стабилизатора. Дисперсность таких систем является произвольной.
Лиофильные системы – это двухфазные коллоидные системы с низкой, хотя и положительной межфазовой свободной энергией, меньшей или равной граничному значению,
Это системы с очень малой межфазовой энергией, они термодинамически устойчивы и образуются самопроизвольно. Дисперсность их вполне определенна и находится в коллоидной области.
Тот факт, что дисперсные системы классифицируются по величине свободной поверхностной энергии показывает, что коллоидные явления тесно связаны со свойствами поверхности раздела фаз.
К лиофильным системам относят:
1) так называемые критические эмульсии, образующиеся в результате снижения поверхностного натяжения при нагревании до температуры, близкой к температуре неограниченного смешения, или в результате прибавления очень больших количеств ПАВ;
2) ассоциативные коллоидные системы, образуемые в водной среде веществами типа мыл, некоторых красителей и дубителей, а в неводной среде некоторыми ПАВ. Такие вещества в разбавленных растворах находятся в молекулярном состоянии, при увеличении концентрации происходит агрегация молекул с образованием частиц коллоидного размера, т.е. образуются мицеллы. Концентрацию вещества в растворе, при которой происходит переход от истинного раствора к коллоидному, принято называть критической концентрацией мицеллообразования (ККМ).
В тех процессах, в которых участвуют две соприкасающиеся фазы, большое значение имеют свойства поверхности раздела, или пограничного слоя, отделяющего одну фазу от другой. Молекулы, составляющие такие слои, обладают особыми свойствами. Если рассматривать монолитную фазу, то числом молекул, образующих поверхностный слой, можно пренебречь по сравнению с огромным количеством молекул в объеме тела. Можно считать, что запас энергии системы пропорционален массе, содержащейся в объеме тела.
При измельчении сплошного тела число молекул в поверхностном слое возрастает и достигает максимального значения в коллоидно-дисперсных системах. Поэтому процессы, протекающие в дисперсных системах, обусловлены свойствами поверхностных слоев на границе раздела. Образование пен, эмульсий, туманов, процессы флотации, смачивания и диспергирования, сорбционная техника и многие-многие другие основаны на свойствах межфазовых поверхностей в дисперсных системах.
Удельной поверхностью называют отношение поверхности тела к его объему или массе:
где Ауд, А – удельная и суммарная поверхность, соответственно; r – плотность вещества, V – объем тела.
Для кубических частиц
Ауд = 6а 2 /а 3 = 6а - 1
Ауд = 6a 2 /а 3 r = 6/ar (м 2 /кг). (4)
Для сферических частиц
Ауд = 4 r 2 /(4/3 r 3 ) (м -1 ),
Если взять кубик вещества, три его стороны разделить на 10 частей и провести плоскости в трех направлениях, то получим более мелкие кубики. Такой процесс можно рассматривать как моделирование процесса диспергирования. Изменение удельной поверхности в процессе диспергирования показано в табл. 4.
Крайне редко в природе встречаются вещества в идеально чистом виде и состоянии. Обычно это разбавленная гомогенная субстанция, состоящая из различных атомов и молекул. Причем это необязательно 2 элемента, встречаются соединения с тремя и более. Когда одна структура находится в другой, равномерно распределяется, но не растворяется в ней, — это дисперсные системы.
- Понятие и определение
- Классификация по агрегатному состоянию
- Существующие виды
- Взвеси и их особенности
- Коллоидные системы
- Высокомолекулярные вещества
- Ключевые свойства
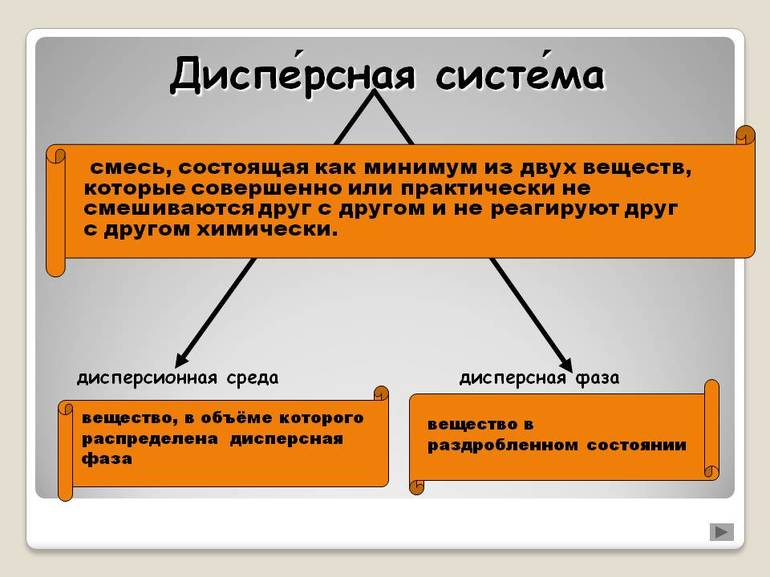
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
- Свободнодисперсные. Основное и главное свойство такой системы — текучесть. Поэтому сюда относят любые аэрозоли и растворы.
- Связнодисперсные. Это твердые или полутвердые системы. К ним относятся все концентрированные пасы или аморфные вещества.
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
- Эмульсии. В жидком агрегатном состоянии находится фаза и среда, они не взаимодействуют друг с другом и не растворяются. Многие получаются посредством гомогенизации. К ним относят большинство лекарственных препаратов или молоко.
- Суспензии. Здесь средой является жидкость, а фазой — твердая структура. Получают посредством пересыпания в жидкость порошка. Структура получается текучая, т. к. фаза крайне мелкая. Если оставлять структуру в неподвижном состоянии, выпадает осадок. Почти все строительные растворы относятся к категории.
- Аэрозоли. Взвесь в этом случае располагается в газе. Примеров множество, встречаются как в природе, так и в быту. Например, грозовые или обычные облака, туманы и некоторые виды осадков. Большинство химикатов, производимых для обработки сельскохозяйственных структур, тоже являются аэрозолями.
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:

Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
- Процессы смешения происходят естественно и крайне медленно.
- Сначала происходит набухание, а затем смешивание.
- Полимерные и истинные растворы отличаются существенно. Те законы, которые характерны для одних (Рауля, Вант-Гоффа), несвойственны другим.
- По всей полученной субстанции свойства могут различаться из-за разного направления и/или размеров молекул.
- Повышенная вязкость.
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства

Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
- Степень (количество фаз).
- Молекулярный вес.
- Размеры частиц.
- Агрегатное состояние.
- Лиофобная/лиофильная группа.
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Читайте также:
- Почему менеджер должен быть лидером и неформальным по должности а авторитетом для подчиненных кратко
- Что такое многочлен кратко
- Можно ли считать россию начала 19 века мононациональной страной кратко
- Как правильно называется учитель обж в школе
- Почему начиная с 18 века в философии обозначился глубинный и обостренный интерес к человеку кратко

