Какие растворы солей используются в электрохимической технологии кратко
Обновлено: 28.06.2024
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Сильнейшим окислительно - восстановительным действием обладает электрический ток. С помощью воздействия электрического тока на вещество можно получить чистый металл. Этот метод называется электролизом.
Электролиз – процесс, при котором происходит разложение вещества электрическим током.
Процесс электролиза может протекать только в веществах, проводящих электрический ток, то есть электролитах. К электролитам относят представителей основных классов неорганических соединений – кислоты, соли, щелочи.
Для протекания процесса требуется устройство, называемое электролизером.

Данное устройство работает от внешнего источника питания, который подает электрический ток. Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Катод (-) – является отрицательно заряженным электродом, катионы ( + ) перемещаются к нему и происходит процесс восстановления.
Анод (+) – положительно заряженный электрод, к нему перемещаются анионы (-) и происходит процесс окисления.
Можно выделить два типа электролиза для расплавов и растворов. Ход этих двух процессов происходит по-разному. Зависит по большей части это от содержания воды в растворе, которая тоже принимает участие в процессе. В расплаве происходит разложение только вещества.
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)

Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.

Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
Катионы K + перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
Анионы Cl - движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.

2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Me n+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S - , J - , Br - , Cl - , OH - и молекулы H2O:
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
В результате можно создать общее уравнение электролиза:
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na + + Cl -
- Катод: Cu 2+ + 2e - → Cu 0
- Анод: Cu 0 — 2e - → Cu 2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
Молекулы воды окисляются на аноде и выделяется кислород.
В результате получаем общее уравнение электролиза:
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
На аноде откладываются молекулы кислорода.
Получаем суммарное уравнение электролиза:
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
Размерная электрохимическая обработка.
Размерная электрохимическая обработка – это процесс получения из заготовки какой-либо детали требуемой формы и размера с использованием явления анодного растворения металла.
Технологические схемы
Обработка с неподвижными электродами. Схема технологического представлена на рис.
1 – электрод – инструмент неподвижный;
2 – заготовка (обрабатываемое изделие);
3 – диэлектрик с открытыми участками.
- направление и скорость движения электролита.
При такой обработке на месте открытого участка появляется отверстие или углубление. Рабочий зазор – изменяется в процессе обработки (увеличивается) и процесс получается нестационарным. Это является недостатком.
Такая схема применяется для получения отверстий, удаления заусенцев, нанесения надписей.
Схема для прошивания отверстий, углублений, полостей сложной конфигурации (рис. ).
1 - электрод – инструмент; 2 - обрабатываемое изделие.
Электрод – инструмент имеет поступательное перемещение со скоростью в указанном направлении, причем таким образам, что . Электрод – инструмент иногда выполняется полым, в нем делаются мелкие отверстия для подачи и отвода электролита.
Точение наружных и внутренних поверхностей (аналогия токарной обработки рис. ).
Электрод – инструмент может иметь перемещение как поперек, так и вдоль, соответственно и .
Производительность не очень высокая. Применяется, когда нельзя использовать механическое воздействие, например, когда материал вязкий или хрупкий (крошится).
Шлифование поверхности (рис. ).
Во всех схемах “+” всегда подается на обрабатываемую поверхность.
Размерная электрохимическая обработка обязательно применяется тогда, когда недопустимы механические усилия.
Механизм размерной электрохимической обработки.
Удаление металла происходит в среде электролита под действием электрического тока без непосредственного контакта между инструментом и заготовкой. В этом случае удаляемый металл претерпевает химическую реакцию соединения с продуктами разложения воды. При этом образуются нерастворимые в воде соединения – гидрооксиды металлов в виде мелких твёрдых частичек. Эти соединения уносятся потоками электролита. Попутно, в результате разложения молекул воды, на аноде появляется кислород, на катоде водород. На катоде наблюдается только разложение воды, и он не изнашивается. В качестве электролита наиболее часто используются раствор поваренной соли (NaCl) и раствор нитрата натрия. Электрод – инструмент изготавливают из меди, бронзы или графита.
По первому закону Фарадея:
- масса растворенного металла,
A – атомная масса,
n – валентность,
I – величина электрического тока,
τ – время обработки.
Значения электрохимического эквивалента
| Материал | |
| Сталь 4,5 Титан Алюминий Медь Никель Цинк | 0,223 ~0,16 ~0,091 0,329 0,304 0,34 |
На практике чаще пользуются скоростью линейного растворения – это фактически скорость перемещения электрода – инструмента в процессе обработки. Эта скорость дает значение о производительности процесса.
- площадь обрабатываемой поверхности,
- смещение электрода – инструмента,
- плотность обрабатываемого материала,
- напряженность электрического поля,
- удельная проводимость электролита.
Тогда скорость линейного растворения определится по формуле
Параметр - называется коэффициент выхода по току и учитывает отклонения от закона Фарадея, которые имеют место на практике. Численное значение этого коэффициента колеблется в пределах и зависит от вида электролита, формы и размеров электродов, величины напряжения. Если , это означает, происходит дополнительное удаление металла вследствие побочных химических реакций.
Для большинства расчетных схем напряжение берется в пределах . Для титанового сплава напряжение может достигать . Такое же напряжение используется при резке металлов. При шлифовке . Скорость электролита составляет .
Электролизные установки
Сущность электролизного технологического процесса (рис. ), заключается в том, что при протекании электрического постоянного тока через электролитическую ванну может иметь место одно из явлений:
· Либо происходит осаждение частиц вещества из электролита на электродах ванны (электроэкстракция)
· Либо имеет место перенос вещества с одного электрода на другой через электролит (электролитическое рафинирование)
В качестве электролита используется растворы солей, кислот и оснований как правило в воде.
В электролите имеет место ионная проводимость. При подаче напряжения на электроды ионы движутся к электродам, нейтрализуются и оседают на них. При этом имеет место либо электроэкстракция либо электролитическое рафинирование.
Основное значение имеет при выборе понятие нормального потенциала.
Если электрод изготовлен из такого же металла как электролит, то при некотором потенциале между электродом и электролитом нет ни первого, ни второго процесса. Такой потенциал называется нормальный.
| Металл, электролит | Нормальный потенциал,В |
| Al N2 H Cu Ag Zn | -1.67 -2.71 0.34 0.8 -0.76 |
Если на электроды подать более отрицательный потенциал, то начинается электроэкстракция.
Если более положительный, то электролитическое рафинирование.
Электролиз применяют для получения или очистки металлов.
В количественном отношении электролизный процесс описывается тем же самым законом Фарадея.
Eр - напряжение разложения
Eп – сумма анодного и катодного ПН
Uэ – падение напряжения на электролите
Uс – падение напряжения на шинах контактов электродов
τ – время технологического процесса
Ep – полезная работа
Эффективность электролизного процесса описывается массой вещества.
Сырьем для получения Znслужит цинковая обманка ZnS. Этот минерал сначала подвергают окислению, обжигу, а затем подвергают выщелачиванию.
ZnSO4 + H2O (5÷6%) Проводимость у такого раствора невысока, поэтому добавляют к этому раствору 10÷12% H2SO4
Электролитическая ванна выполнена из дерева или бетона и изолирована от земли.
Электролизный процесс проводится при t = 35÷40 0 C
На катоде появляется ПН – 1,1 В (нормальный потенциал -0,76 В)
Возникает электроэкстракция – осаждение Zn на катоде.
После этого Zn сдирают с катода и переплавляют.
Получение Al
В качестве электролита используются не раствор, а расплав. В качестве сырья используется глинозем Al2O3
Расплав этого материала имеет низкую проводимость. Поэтому в качестве электролита используют глинозем и криолит Na3AlF6
Ванны и электроды изготавливают из угля или графита.
1/gэ = 14000÷16000 кВт∙ч/т
Гальванотехника
Это электротехнологический процесс осаждения металла на поверхность как металла, так и не металлических изделий с помощью электролиза.
Толщина покрытия не превышает десятков мкм.
Различают 2 разновидности:
Гальваностедия – омеднение, золочение, золочение, хромирование, никелирование…
Перед обработкой поверхность тщательно очищают, затем осуществляют травление кислотой H2SO4 , HCl. В качестве электролита используется раствор соли наносимого металла. Иногда добавляют кислоты и щелочи для повышения проводимости. Анод изготавливается из наносимого металла, изделие является катодом.
Происходит перенос металла с анода на катод, обработка происходит при небольших плотностях тока , не больше десятков А/м 2 .
Гальванопластика – получение точных копий с изделий.
Размерная электрохимическая обработка.
Размерная электрохимическая обработка – это процесс получения из заготовки какой-либо детали требуемой формы и размера с использованием явления анодного растворения металла.
Технологические схемы
Обработка с неподвижными электродами. Схема технологического представлена на рис.
1 – электрод – инструмент неподвижный;
2 – заготовка (обрабатываемое изделие);
3 – диэлектрик с открытыми участками.
- направление и скорость движения электролита.
При такой обработке на месте открытого участка появляется отверстие или углубление. Рабочий зазор – изменяется в процессе обработки (увеличивается) и процесс получается нестационарным. Это является недостатком.
Такая схема применяется для получения отверстий, удаления заусенцев, нанесения надписей.
Схема для прошивания отверстий, углублений, полостей сложной конфигурации (рис. ).
1 - электрод – инструмент; 2 - обрабатываемое изделие.
Электрод – инструмент имеет поступательное перемещение со скоростью в указанном направлении, причем таким образам, что . Электрод – инструмент иногда выполняется полым, в нем делаются мелкие отверстия для подачи и отвода электролита.
Точение наружных и внутренних поверхностей (аналогия токарной обработки рис. ).
Электрод – инструмент может иметь перемещение как поперек, так и вдоль, соответственно и .
Производительность не очень высокая. Применяется, когда нельзя использовать механическое воздействие, например, когда материал вязкий или хрупкий (крошится).
Шлифование поверхности (рис. ).
Во всех схемах “+” всегда подается на обрабатываемую поверхность.
Размерная электрохимическая обработка обязательно применяется тогда, когда недопустимы механические усилия.
Механизм размерной электрохимической обработки.
Удаление металла происходит в среде электролита под действием электрического тока без непосредственного контакта между инструментом и заготовкой. В этом случае удаляемый металл претерпевает химическую реакцию соединения с продуктами разложения воды. При этом образуются нерастворимые в воде соединения – гидрооксиды металлов в виде мелких твёрдых частичек. Эти соединения уносятся потоками электролита. Попутно, в результате разложения молекул воды, на аноде появляется кислород, на катоде водород. На катоде наблюдается только разложение воды, и он не изнашивается. В качестве электролита наиболее часто используются раствор поваренной соли (NaCl) и раствор нитрата натрия. Электрод – инструмент изготавливают из меди, бронзы или графита.
По первому закону Фарадея:
- масса растворенного металла,
A – атомная масса,
n – валентность,
I – величина электрического тока,
τ – время обработки.
Значения электрохимического эквивалента
| Материал | |
| Сталь 4,5 Титан Алюминий Медь Никель Цинк | 0,223 ~0,16 ~0,091 0,329 0,304 0,34 |
На практике чаще пользуются скоростью линейного растворения – это фактически скорость перемещения электрода – инструмента в процессе обработки. Эта скорость дает значение о производительности процесса.
- площадь обрабатываемой поверхности,
- смещение электрода – инструмента,
- плотность обрабатываемого материала,
- напряженность электрического поля,
- удельная проводимость электролита.
Тогда скорость линейного растворения определится по формуле
Параметр - называется коэффициент выхода по току и учитывает отклонения от закона Фарадея, которые имеют место на практике. Численное значение этого коэффициента колеблется в пределах и зависит от вида электролита, формы и размеров электродов, величины напряжения. Если , это означает, происходит дополнительное удаление металла вследствие побочных химических реакций.
Для большинства расчетных схем напряжение берется в пределах . Для титанового сплава напряжение может достигать . Такое же напряжение используется при резке металлов. При шлифовке . Скорость электролита составляет .
Электролизные установки
Сущность электролизного технологического процесса (рис. ), заключается в том, что при протекании электрического постоянного тока через электролитическую ванну может иметь место одно из явлений:
· Либо происходит осаждение частиц вещества из электролита на электродах ванны (электроэкстракция)
· Либо имеет место перенос вещества с одного электрода на другой через электролит (электролитическое рафинирование)
В качестве электролита используется растворы солей, кислот и оснований как правило в воде.
В электролите имеет место ионная проводимость. При подаче напряжения на электроды ионы движутся к электродам, нейтрализуются и оседают на них. При этом имеет место либо электроэкстракция либо электролитическое рафинирование.
Основное значение имеет при выборе понятие нормального потенциала.
Если электрод изготовлен из такого же металла как электролит, то при некотором потенциале между электродом и электролитом нет ни первого, ни второго процесса. Такой потенциал называется нормальный.
| Металл, электролит | Нормальный потенциал,В |
| Al N2 H Cu Ag Zn | -1.67 -2.71 0.34 0.8 -0.76 |
Если на электроды подать более отрицательный потенциал, то начинается электроэкстракция.
Если более положительный, то электролитическое рафинирование.
Электролиз применяют для получения или очистки металлов.
В количественном отношении электролизный процесс описывается тем же самым законом Фарадея.
Eр - напряжение разложения
Eп – сумма анодного и катодного ПН
Uэ – падение напряжения на электролите
Uс – падение напряжения на шинах контактов электродов
τ – время технологического процесса
Ep – полезная работа
Эффективность электролизного процесса описывается массой вещества.
Сырьем для получения Znслужит цинковая обманка ZnS. Этот минерал сначала подвергают окислению, обжигу, а затем подвергают выщелачиванию.
ZnSO4 + H2O (5÷6%) Проводимость у такого раствора невысока, поэтому добавляют к этому раствору 10÷12% H2SO4
Электролитическая ванна выполнена из дерева или бетона и изолирована от земли.
Электролизный процесс проводится при t = 35÷40 0 C
На катоде появляется ПН – 1,1 В (нормальный потенциал -0,76 В)
Возникает электроэкстракция – осаждение Zn на катоде.
После этого Zn сдирают с катода и переплавляют.
Получение Al
В качестве электролита используются не раствор, а расплав. В качестве сырья используется глинозем Al2O3
Расплав этого материала имеет низкую проводимость. Поэтому в качестве электролита используют глинозем и криолит Na3AlF6
Ванны и электроды изготавливают из угля или графита.
1/gэ = 14000÷16000 кВт∙ч/т
Гальванотехника
Это электротехнологический процесс осаждения металла на поверхность как металла, так и не металлических изделий с помощью электролиза.
Толщина покрытия не превышает десятков мкм.
Различают 2 разновидности:
Гальваностедия – омеднение, золочение, золочение, хромирование, никелирование…
Перед обработкой поверхность тщательно очищают, затем осуществляют травление кислотой H2SO4 , HCl. В качестве электролита используется раствор соли наносимого металла. Иногда добавляют кислоты и щелочи для повышения проводимости. Анод изготавливается из наносимого металла, изделие является катодом.
Происходит перенос металла с анода на катод, обработка происходит при небольших плотностях тока , не больше десятков А/м 2 .
Гальванопластика – получение точных копий с изделий.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.


Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.

На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH - как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
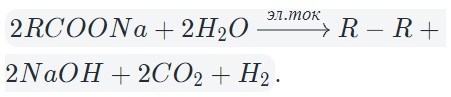
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Читайте также:

