Какие особенности атомов углерода обусловливают многообразие органических веществ в природе кратко
Обновлено: 05.07.2024
сочетаться друг с другом в цепи различного строения. Соединения могут иметь линейную (нормальную), разветвленную и циклическую строение карбонового цепи, называют также скелетом молекулы.
Одинарные связи между атомами углерода очень прочные и трудно разрываются. Двойные и тройные связи слабее, легко разрываются и переходят в одинарные. Соединения с одинарными связями вступают в реакции замещения, а с двойным и тройным – в реакции присоединения.
выявлять достаточно высокую валентность в соединениях – равную четырем;
способностью органических соединений образовывать гомологи и изомеры;
существование различных функциональных групп атомов.
Функциональными группами являются:
гидроксильная группа ОН;
карбонильная группа = СО;
альдегидная группа -СНО;
карбоксильная группа -СООН;
аминогруппа -NH2 и другие.
Именно от функциональных групп в первую очередь зависят химические свойства органических веществ. Наличие той или иной функциональной группы определяет к какому классу соединений его относят.
Функциональных групп в одном веществе может быть несколько, причем как одинаковых так и разных.
Другая характерная черта органических соединений заключается в их склонности подвергаться при нагревании без доступа воздуха глубоким изменениям, в результате которых образуются новые вещества, которые имеют совершенно другие свойства.
Классификация органических соединений
Особенностью органических соединений является их численность и разнообразие. Несмотря на это, ориентироваться в них легко потому, что в органической химии принята четкая классификация основана на теории химического строения. Основу любого углеводорода и любой органического соединения составляет карбоновый скелет – последовательность атомов углерода, соединенных между собой химическими связями.
В зависимости от вида карбонового скелета органические вещества разделяют на три большие группы:
ациклические соединения – скелет молекулы состоит из соединенных между собой атомов углерода в виде незамкнутого, прямого или разветвленной цепи (нормальные и изосполукы, их еще называют алифатическими соединениями или соединениями жирного ряда);
карбоциклические соединения – в молекулах которых существуют карбоновые цепи циклического строения (циклические и изоциклические соединения. Среди этих соединений большую группу составляют ароматические соединения);
гетероциклические соединения в их состав входят циклические соединения в молекулах которых кроме атомов углерода содержатся атомы других элементов, как: S, O, N. Например:
От ациклических, циклических и гетероциклических групп углеводородов происходят различные производные.
Производными являются вещества, добытые путем замещения одного или нескольких атомов углерода другими атомами или группами атомов
В основу классификации взято класс углеводородов, то есть соединений, которые состоят только из атомов углерода и водорода.
Насыщенные углеводороды – это соединения, в которых валентности атомов углерода полностью насыщены атомами водорода. Общая формула насыщенных углеводородов – СnН2n + 2, окончание -ан.
В гомологическом ряду каждый последующий углеводород отличается от предыдущего группой атомов – СН2, которую называют гомологичной разницей. Например, если в молекулы метана СН4 добавить гомологическую разницу СН2, то получим следующий углеводород ряда метана – этан С2Н6. Гомологи расположены в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд.
Этиленовыми называют ненасыщенные углеводороды, в молекулах которых атомы углерода соединены между собой двойной связью. Углеводороды соответствуют общей формуле CnH2n и имеют окончание: -ен (-илен, -илен). Представителем этиленовых углеводородов является этилен, молекулярная формула которого – С2Н4.
Ацетиленовыми называют ненасыщенные углеводороды, в молекулах которых атомы углерода, соединенные между собой тройной связью. Общая формула – CnH2n-2, окончание -ин, -ин. Ацетилен, молекулярная формула которого – С2Н2 имеет наибольшее значение среди углеводородов с другом тройной связью.
Ароматическими называют соединения, в молекулах которых содержится группировки из шести атомов углерода, с особым характером связи – ядро бензола. Общая формула СnH2n-6. Наиболее типичным представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6, в молекуле которого имеется шесть атомов углерода.
Другие классы соединений рассматривают как производные насыщенных углеводородов.
Галогенопроизводные, то есть вещества образованные замещением одного или нескольких атомов водорода в карбоновом цепи углеводорода одним или несколькими атомами галогенов.
Спирты или алкоголе – вещества, добытые замещением одного или нескольких атомов водорода в карбоновом цепи углеводорода гидроксильной группой ОН.
Карбоновые кислоты – вещества, которые содержат в своем составе карбоксильную группу -COOH.
Альдегиды – вещества, которые содержат в своем составе альдегидную группу альдегидная группа.
Спирты, альдегиды, карбоновые кислоты содержат в своем составе атомы кислорода. Такие соединения называют оксигеновмиснимы. Оксигеновмисних органических соединений существует огромное количество, значительно больше, чем углеводородов.
Классификация оксигеновмисних соединений
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильной группой ОН. Представителем является фенол (карболовая кислота) С6Н5ОН.
Кетоны, содержащие карбонильную группу> С = О.
Эфирами называют органические вещества, молекулы которых состоят из двух углеводородных радикалов, соединенных атомом кислорода.
Общая формула эфиров ROR
Название эфиров состоит из названий тех радикалов, которые входят в их состав:
Эфиры – производные оксигеновмисних кислот, в которых гидроксигруппа кислоты замещена остатками спирта или фенола. Эфиры образуются в результате реакций кислот со спиртами с отщеплением воды. Общая формула эфиров: R-COO-R1.
Углеводы делятся на:
моносахариды С6Н12О6 (глюкоза, фруктоза, галактоза, рибоза);
дисахариды С12Н22О11 (сахароза, мальтоза, лактоза);
полисахариды (С6Н10О5) n (крахмал, целлюлоза, гликоген).
Соединения, которые в своем составе содержат атомы азота относят к азотсодержащих.
Классификация азотсодержащих соединений
Аминами называют производные аммиака, в молекулах которых один или несколько атомов водорода замещены углеводородными радикалами.
Общая формулы аминов: R – NH2, где NH2 – функциональная аминогруппа.
Название аминов: к названиям соответствующих радикалов добавляют суффикс – амин.
Аминокислоты – это амфотерные органические соединения, в молекулах которых содержится одновременно аминогруппа NH2 и карбоксильная группа – COOH.
Общая формула аминокислот: Общая формула аминокислот
Белки – это азотсодержащих органические соединения, состоящие из остатков α-аминокислот соединенных пептидными связями.
Углерод — особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения: открытые (неразветвленные, разветвленные), замкнутые:
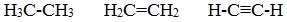
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
— наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
— малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Многообразие углеводородов
В силу особенностей строения и свойств углерода его соединения с водородом очень многочисленны и разнообразны:
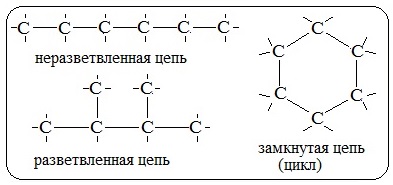
1. Атомы углерода способны соединяться между собой в цепи различного строения:
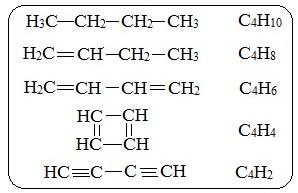
2. При одинаковом количестве атомов углерода в молекулах углеводороды могут отличаться числом атомов водорода.
Например, соединения с 4-мя атомами углерода могут содержать от 10-ти до 2-х атомов водорода:
3. Одному и тому же элементному составу молекул (одной молекулярной формуле) может соответствовать несколько различных веществ – изомеров. Например, молекулярную формулу С4Н8 имеют 6 изомерных соединений:
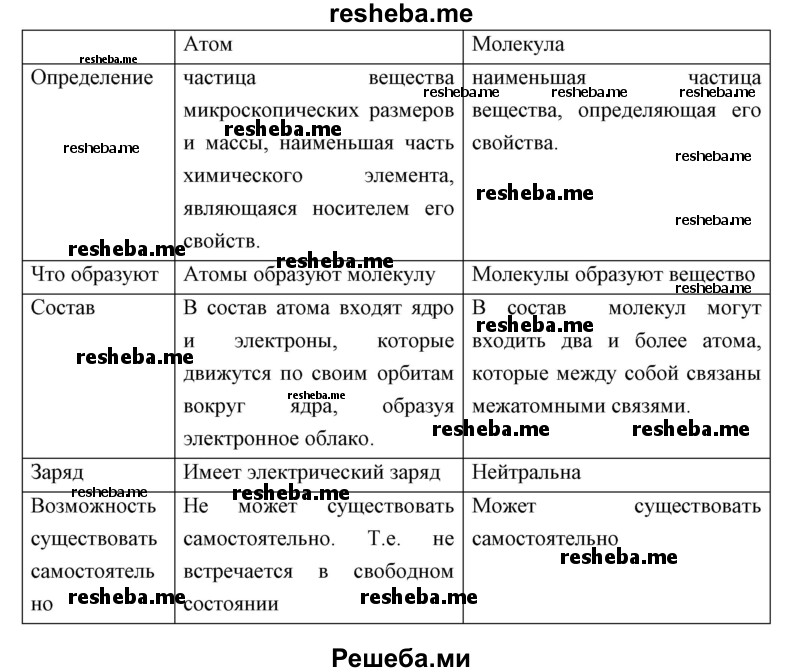
2) Молекулы состоят из атомов. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида.
3) Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4) При взаимодействии атомов образуются молекулы: гомоядерные — при соединении атомов одного вида (например, H2, O2), образующиеся при этом вещества называются простыми; гетероядерные — при взаимодействии атомов разного вида (например, H2O, H2SO4), образующиеся при этом вещества называются сложными.
5) При физических явлениях молекулы сохраняются, при химических — разрушаются (или образуются новые). Атомы же и при физических, и при химических реакциях остаются неизменными.
6) Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Вопрос 2. Что такое химические элементы? Как устроены атомы разных химических элементов?
Химический элемент — совокупность атомных частиц (электронейтральных атомов и одноатомных ионов) с одинаково положительным зарядом ядра.
Атомы чрезвычайно малы, их диаметр колеблется в пределах 0,2 — 0,5 нм (1 нм = 10 — 9 м). Массы атомов составляют порядка 10 — 24 — 10 — 22 г. Атомы имеют сложное строение и состоят из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Вопрос 3. Что такое валентные электроны?
Валентные электроны — это такие электроны, которые участвуют в образовании химических связей.
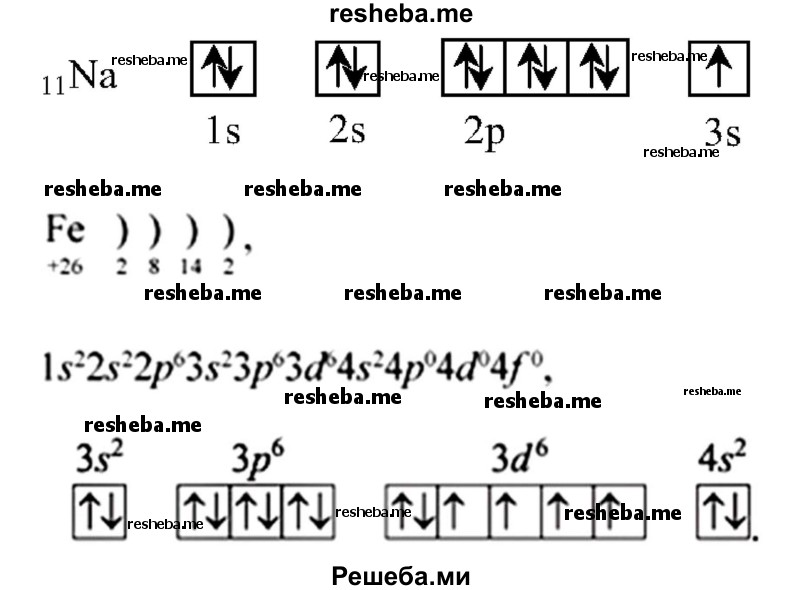
Вопрос 4. Чем различаются свойства химических элементов главных и побочных подгрупп из левой и правой частей таблицы Менделеева?
Главное отличие в особенности заполнения электронами орбиталей и, соответственно, различие химических свойств.
Химические свойства, например, у s — элементов 1 группы — валентность 1, степень окисления — +1. А у d — элементов — переменная валентность и степень окисления, т.к у них есть свободные орбитали для заполнения электронами. К примеру, представлены электронно — графические схемы Na и Fe.
Вопрос 5. Какие химические элементы относят к группе макроэлементов и почему?
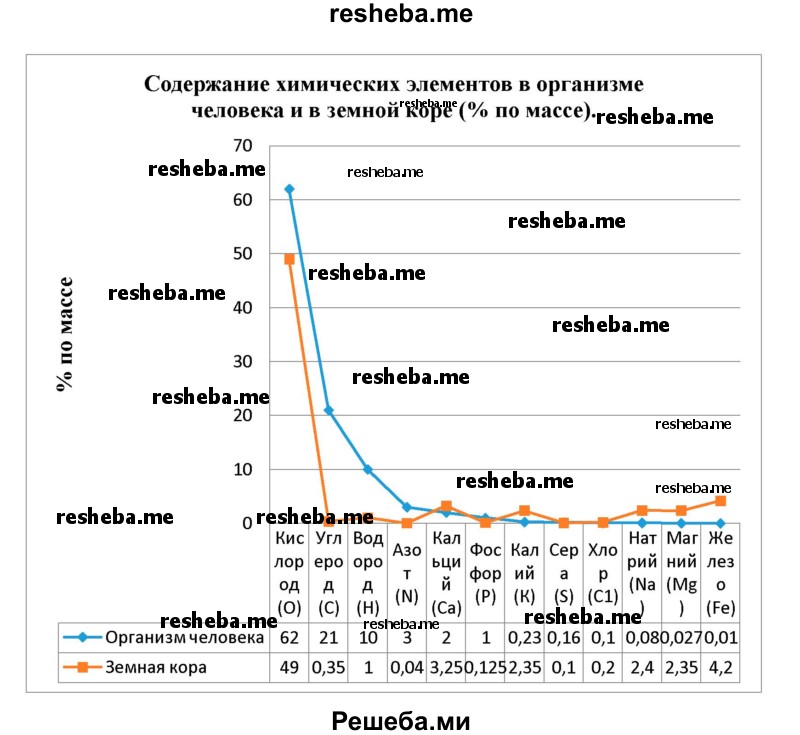
К группе макроэлементов относят химические элементы, содержание которых в живых организмах превышает 0,01 %. В значительных количествах встречаются 4 хим. элемента (кислород, углерод, водород и азот) (в сумме около 96 %) и ещё 8: кальций, фосфор, калий, сера, хлор, натрий, магний и железо.
Вопрос 6. Из чего состоят молекулы различных веществ? Что лежит в основе образования их структуры?
Молекулы состоят из атомов различных химических элементов. в основе образования их структуры обеспечивается возникновением химической связи между входящими в их состав атомами. Эти связи возникают вследствие объединения электронных оболочек атомов, которые образуют молекулу.
Вопрос 7. Что лежит в основе разделения веществ на органические и неорганические?
В основе разделения веществ на органические и неорганические лежит происхождение и наличие углерода в составе этих веществ (СО, СО2, Н2СО3 и карбонаты — это неорганические вещества).
Вопрос 8. Какие особенности атомов углерода обусловливают многообразие органических веществ в природе?
Очень важной особенностью атома углерода является его способность образовывать связи сразу с четырьмя другими такими же атомами. Благодаря этой способности атомы углерода могут образовывать каркасы огромного количества разнообразных биологических молекул, что способствует появлению многообразных органических веществ в природе.
Вопрос 9. Какие органические вещества являются биополимерами? Приведите примеры известных вам регулярных и нерегулярных полимеров, гомо — и гетерополимеров.
Биополимеры — высокомолекулярные органические соединения, входящие в состав живых организмов (белки, полисахариды, нуклеиновые кислоты).
Пример регулярных полимеров: крахмал, полисахариды, целлюлоза, гликоген.
Пример нерегулярных полимеров: белки, нуклеиновые кислоты.
Пример гомополимеров: крахмал, полисахариды, целлюлоза, гликоген.
Пример гетерополимеров: белки, нуклеиновые кислоты.
Вопрос 10. Используя данные таблицы 1, постройте диаграмму, отражающую содержание указанных в ней химических элементов в организме человека и в земной коре (% по массе).
В молекуле воды между атомами водорода и кислорода — ковалентная полярная связь. А водородная связь возникает МЕЖДУ МОЛЕКУЛАМИ ВОДЫ (а не В МОЛЕКУЛЕ воды).
Вопрос 13. Используя доступные информационные источники, найдите и рассмотрите периодическую таблицу химических элементов Д. И. Менделеева. Найдите в ней элементы, относящиеся к микро — и макроэлементам. Атомы нескольких химических элементов обладают строением, сходным со строением атомов углерода. Назовите эти элементы. Могли бы они заменить углерод в структуре органических веществ? Ответ обоснуйте и подкрепите известными вам примерами.
К макроэлементам относятся 12 химических элементов: кислород, углерод, водород и азот, кальций, фосфор, калий, сера, хлор, натрий, магний и железо. Всего в живых организмах найдено более 80 химических элементов, однако содержание большинства из них крайне мало — это микроэлементы (медь, йод, цинк, кобальт, кремний, марганец, литий и др.).
Макроэлементы обозначены красным, а микроэлементы — синим.
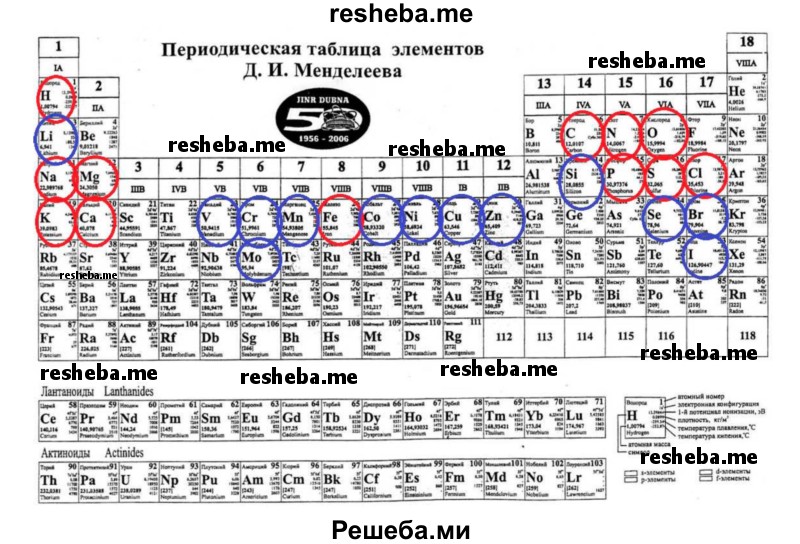
Кремний, бор и азот обладают строением, сходным со строением атомов углерода. Но они не могут заменить углерод в структуре органических веществ, потому что:
1. Заполненный внешний электрический слой.
2. Обладает низкой окислительной способностью.
3. Строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем — два.
4. Возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами.
5. Полимерные молекулы способны образовывать в большей степени углерод, сера, фосфор, селен и теллур, а в меньшей — кремний, германий, бор, мышьяк (As), олово (Sn) и сурьма (Sb). Способность образовывать достаточно прочные гомоцепные полимеры зависит от прочности связей атомов данного элемента друг с другом (у углерода этот показатель самый высокий — 80 ккал/моль, смотрите табл.)
Табл. Энергия некоторых связей в гомоцепных полимерах.
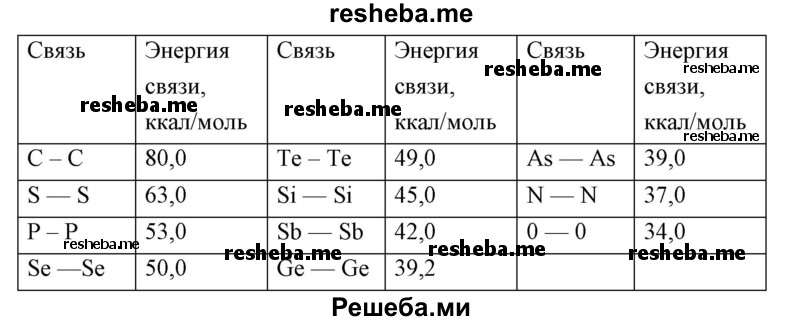
Среди всех элементов периодической системы углерод выделяется своей уникальной способностью образовывать необычайно длинные цепи полимеров.
6. Атомы бора, кремния, фосфора и др., также образуют прочные цепи из атомов этих элементов (в элементарном состоянии). Но уникальность углерода обусловлена в значительной степени тем обстоятельством, что образуемые им углерод — углеродные связи прочны и в тех случаях, когда атомы углерода одновременно связаны с другими элементами. Например, углерод — водородные и углерод — фторные соединения высоко стабильны и в химическом отношении относительно мало реакционноснособны, а соответствующие производные бора, кремния, фосфора и т. д. либо не могут быть получены, либо являются крайне реакционноснособными веществами.
7. Атомы углерода могут связываться по — разному, называясь при этом аллотропами углерода.
Вопрос 14. Основные макроэлементы, в первую очередь углерод, водород и азот, присутствуют в живых организмах в больших количествах, чем в неживой природе. Почему? Что из этого следует?
Потому что все органические соединения получены соединением этих элементов. Это связано в основном с их валентностью, равной соответственно 1, 4 и 3, а также с их способностью образовывать более прочные ковалентные связи, нежели связи, образуемые другими элементами той же валентности. Атомы углерода способны образовывать цепочки и кольца, создавая гигантское разнообразие органических молекул. Вода — вещество с уникальными свойствами, способное растворять огромное разнообразие веществ, а также стабилизировать температуру за счет высокой теплоемкости, теплоты замерзания и теплоты испарения. Азот входит в состав аминокислот. Все эти элементы входят в обменные процессы клеток и являются жизненно необходимыми химическими компонентами живых организмов.
Присутствие в живых организмах этих химических элементов в больших количествах, чем в неживой природе, наталкивает на мысль: химические соединения, содержащие углерод, водород, кислород и азот (наиболее распространенные в живой природе элементы) были отобраны из неживой природы в ходе эволюции благодаря их особой приспособленности для участия в процессах жизнедеятельности.
Вопрос 15. Какую проблему необходимо учитывать учёным в связи с разработкой и внедрением в производство новых искусственно созданных органических веществ? Обсудите это с учителем и одноклассниками.
Здесь можно выделить не одну, а несколько проблем.
1. Уменьшение количества отходов с целью уменьшения вредного воздействия на окружающую природу.
В экологическом отношении коксохимическое производство является одним из наиболее опасных. На всех его стадиях выделяется значительная масса загрязнителей. На долю коксохимического производства приходится более 70% канцерогенов от их общего количества, образующегося в металлургии (бензол, каменноугольная смола и др.).
Добыча, переработка и транспортировка нефти сопряжены с загрязнением окружающей среды (в первую очередь загрязнение Мирового океана).
2. Сохранение невозобновляемых источников сырья.
3. Увеличение эффективности переработки сырья.
Например, при переработке нефти выход наиболее ценных продуктов (бензина) недостаточен и обычно не превышает 15%, что не может покрыть все возрастающий спрос народного хозяйства на этот и другие виды моторного топлива. Увеличения их выхода достигают применением химических процессов переработки, резко увеличивающих выход бензина (до 70% массы сырья).

В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
О чем эта статья:
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s 2 2s 2 2р 2 .

Возможные валентности: II, IV.
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода

Нахождение углерода в природе
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Читайте также:

