Какие модели сложного строения атома вы знаете в чем их достоинства и недостатки кратко
Обновлено: 01.06.2024
2. Какие модели строения атома вы знаете?
3. Из курса физики вспомните, как физические явления интерференции и дифракции (что это такое?) доказывают двойственную природу частиц микромира.
4. Из каких частиц состоит атомное ядро? Что такое изотопы? Запишите символы изотопов хлора, калия и аргона. Почему свойства различных изотопов одного и того же элемента идентичны, хотя их относительная атомная масса различна?
5. Как устроена электронная оболочка атома? Что такое энергетический уровень (электронный слой) атома? Что представляет собой электронная орбиталь? Какие орбитали вам известны?
7. Как заполняются энергетические уровни и электронные орбитали у атомов химических элементов главных и побочных подгрупп таблицы Д. И. Менделеева? В чем сходство и различие в строении атомов элементов главных и побочных подгрупп одной группы?
8. Запишите электронные конфигурации атомов элементов, имеющих порядковые номера б, 15, 20, 25 в Периодической системе Д. И. Менделеева. К каким электронным семействам относят эти элементы?
Классическая теория строения атома развивалась следующим образом:
Эта модель не подтверждалась экспериментальными данными.
2. Модель Э. Резерфорда. Модель атома — планетарная, т.е. атом состоит из положительно заряженного ядра и электронов, которые вращаются вокруг ядра по замкнутым орбитам.
Эта модель не объясняла излучение и поглощение энергии атомом.
3. Теория Н. Бора. Н. Бор внес в планетарную модель атома квантовые представления.
Теория была построена на противоречиях.
4. Протонно-нейтронная теория ядра. Ядро состоит из протонов и нейтронов.
| атом | ||
| ядро | электроны | |
| протоны | нейтроны | |
| p + | n o | e - |
| Масса протона | Масса нейтрона | Масса электрона |
| 1,0073 а.е.м. | 1,0087 а.е.м. | 0,0005 а.е.м. |
| Заряд протона | Заряд нейтрона | Заряд электрона |
| +1 | -1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами ( nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12 Сили С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35 Cl и 37 Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
Аr(Cl)=0,75 . 35+0,25 . 37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
3. Основные модели строения атома
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
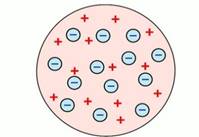
Рис. 1. Модель строения атома Дж. Томсона
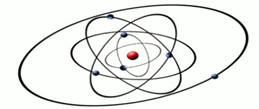
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.

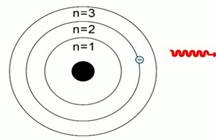
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
4. Формы атомных орбиталей
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью.Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода, в котором находится данный элемент в таблице Д.И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.
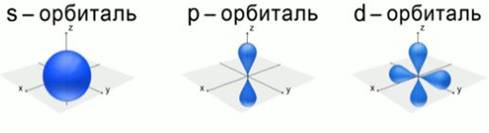
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей.
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1s). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали:2s2ppp. На третьем уровне: 3s3ppp3ddddd.
Максимальное число электронов на энергетическом уровне определяется по формуле N=2n 2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
| Энергетический уровень | N | Электронная конфигурация |
| 1-ый | 1s 2 | |
| 2-ой | 2s 2 2p 6 | |
| 3-ий | 3s 2 3p 6 3d 10 | |
| 4-ый | 4s 2 4p 6 4d 10 4f 14 |
В зависимости от того, на какой орбитали находится последний электрон, различают s, p-, d-элементы.Элементы главных подгрупп относятся к s, p-элементам. В побочных подгруппах находятсяd-элементы
5. Примеры написания электронно-графических формул атомов
Тема: Строение атома. Периодический закон Д.И. Менделеева
Урок: Строение атома
1. Строение атома
| атом | ||
| ядро | электроны | |
| протоны | нейтроны | |
| p + | n o | e - |
| Масса протона | Масса нейтрона | Масса электрона |
| 1,0073 а.е.м. | 1,0087 а.е.м. | 0,0005 а.е.м. |
| Заряд протона | Заряд нейтрона | Заряд электрона |
| +1 | -1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами ( nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12 Сили С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35 Cl и 37 Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
Аr(Cl)=0,75 . 35+0,25 . 37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
3. Основные модели строения атома
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.

Рис. 1. Модель строения атома Дж. Томсона

Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.

Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
4. Формы атомных орбиталей
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью.Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода, в котором находится данный элемент в таблице Д.И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.

Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей.
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1s). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали:2s2ppp. На третьем уровне: 3s3ppp3ddddd.
Максимальное число электронов на энергетическом уровне определяется по формуле N=2n 2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
| Энергетический уровень | N | Электронная конфигурация |
| 1-ый | 1s 2 | |
| 2-ой | 2s 2 2p 6 | |
| 3-ий | 3s 2 3p 6 3d 10 | |
| 4-ый | 4s 2 4p 6 4d 10 4f 14 |
В зависимости от того, на какой орбитали находится последний электрон, различают s, p-, d-элементы.Элементы главных подгрупп относятся к s, p-элементам. В побочных подгруппах находятсяd-элементы
Модель атома Резерфорда-Резерфорд предложил планетарную модель строения атома. Согласно этой модели строение атома подобно строению солнечной системы. В центре каждого атома имеется положительно заряженное ядро радиусом ≈ 10-10м подобно планетам обращаются отрицательно заряженные электроны.
Квантовая модель строения атома-Основой современной теории строения атома является планетарная модель, дополненная и усовершенствованная. Согласно данной теории, ядро атома состоит из протонов (положительно заряженных частиц) и нейронов (не имеющих заряда частиц). А вокруг ядра по неопределённым траекториям движутся электроны (отрицательно заряженные частицы).
неправильно. каждая планета солнечной системы, как и каждый спутник планет, это атомы определённой стадии сотворения
Читайте также:
- В чем своеобразие образовательной ситуации как формы организации образовательного процесса в доу
- Особенности школьного жаргона проект
- Как производят бумагу из дерева кратко
- Древнеиндийская философия как спастись от страданий мира кратко
- Заслужила ли героиня баллады в а жуковского светлана свое счастье кратко

