Какие дисперсные системы называются коллоидными растворами кратко
Обновлено: 06.07.2024
Чистые вещества встретить в природном мире практически невозможно. В большинстве случаев они представляют собой гомогенную субстанцию, содержащую в своем составе частицы различных примесей. При этом не является обязательным наличие двух компонентов в смеси. Их количество может быть любым. Если одно вещество равномерно распределено в другом и не растворяется в нем, то такая система называется дисперсной системой.
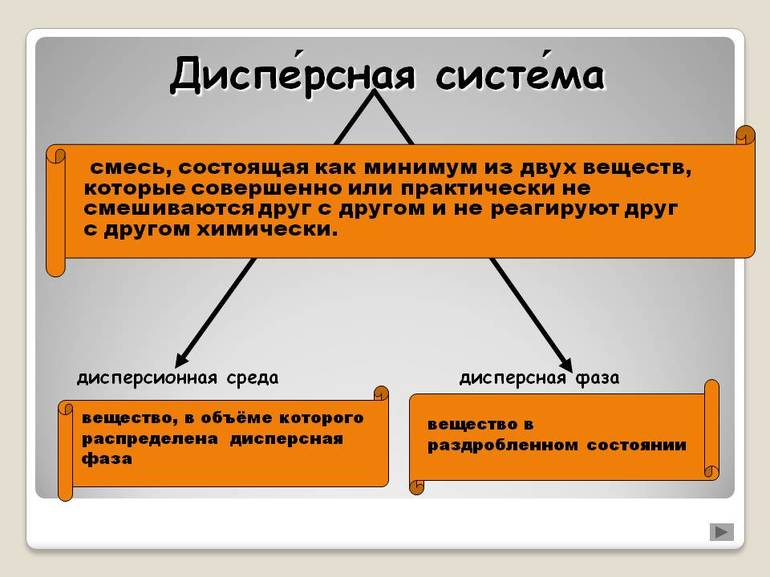
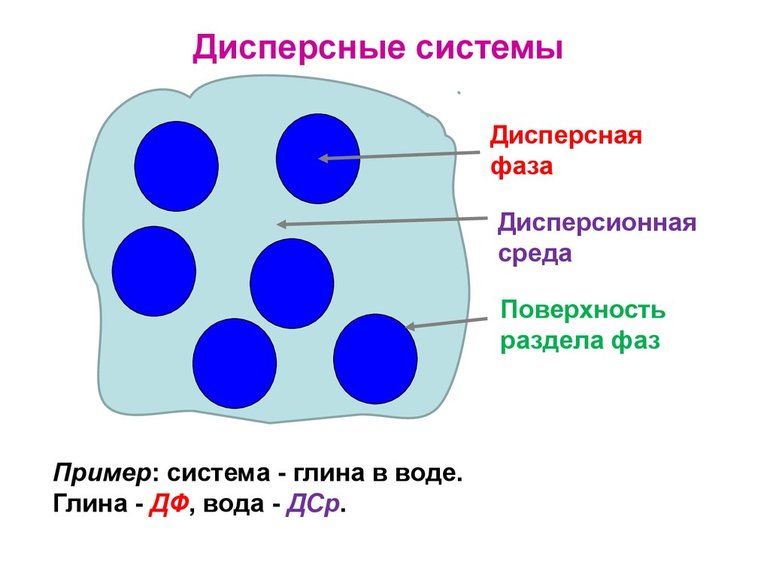
Дисперсная система — гетерогенная (не однородная система), состоящая минимум из двух компонентов (фаз), один из которых (называемый дисперсной фазой) равномерно распределен по объему другого (называемого дисперсионной средой).
В составе типичной двухфазной системы выделяют:
- вещество в виде дисперсной фазы;
- вещество, под названием дисперсионная среда, в котором мелко распределено первое вещество.
В том случае, когда в системе несколько фаз, их можно отделить друг от друга. Для этого используют разные физические способы, к примеру, центрифугирование, сепарация. Типичные дисперсные системы относятся к коллоидным растворам (золям).
К дисперсным системам также относятся грубодисперсные системы, размеры частиц дисперсной фазы в которых составляет от 10 - 7 до 10 - 4 метра. Физические свойства дисперсных систем похожи на свойства растворов высокомолекулярных соединений.
Характеристика и особенности строения
Дисперсные системы являются гетерогенными смесями, в которых одно или более веществ распределены в другом. Каждый компонент системы обладает собственными свойствами. После извлечения его из системы его состояние будет соответствовать начальному.
Вещество, содержание которого в дисперсной системе выше, называют дисперсионной средой.
Второстепенное вещество является дисперсной фазой. В дисперсной системе не наблюдается взаимное взаимодействие между частицами. При этом имеется некая прослойка, которая их разделяет. Функцию этой прослойки выполняет вещество, образующее дисперсионную среду. В связи с этим системы называют гетерогенными или неоднородными.
В качестве примеров дисперсных систем можно привести:
- морскую воду;
- почву;
- большинство продуктов питания.
Перечисленные системы могут обладать любым агрегатным состоянием. В некоторых случаях допускается наличие одновременно нескольких фаз. Выделить их можно с использованием центрифуги или сепарированием.
Дисперсная фаза — вещество, равномерно распределенное в окружающей ее дисперсионной среде и не взаимодействующее с ней либо с другой дисперсной фазой при ее наличии в дисперсной системе.
Дисперсная фаза может состоять из аналогичных или неодинаковых по величине частиц, капель, либо пузырьков, которые расположены на некотором расстоянии друг от друга. По кинетическим свойствам (подвижность фазы), выделяют следующие типы дисперсных систем:
- дисперсная подвижная фаза;
- дисперсная неподвижная фаза с частицами, взаимно связанными и ограниченными в передвижении.
Свойства, которые характеризуют дисперсные системы, зависят от одного ключевого фактора. В результате их формирования образуется четкая межфазная граница.
В природе чаще можно встретить грубодисперсные системы. В этом случае фазу и среду различают при рассмотрении под микроскопом, а иногда и невооруженным глазом.
Рассмотренные системы характеризуются следующими показателями:
- степень (число) фаз;
- молекулярный вес;
- размеры частиц;
- агрегатное состояние;
- лиофобные/лиофильные.
В окружающей среде дисперсные системы встречаются повсеместно. Они могут быть природного и естественного происхождения. Существуют системы, выводимые в искусственном виде. В основе разных лекарственных составов, минеральных и химических удобрений, технологических процессов лежит явление дисперсности.
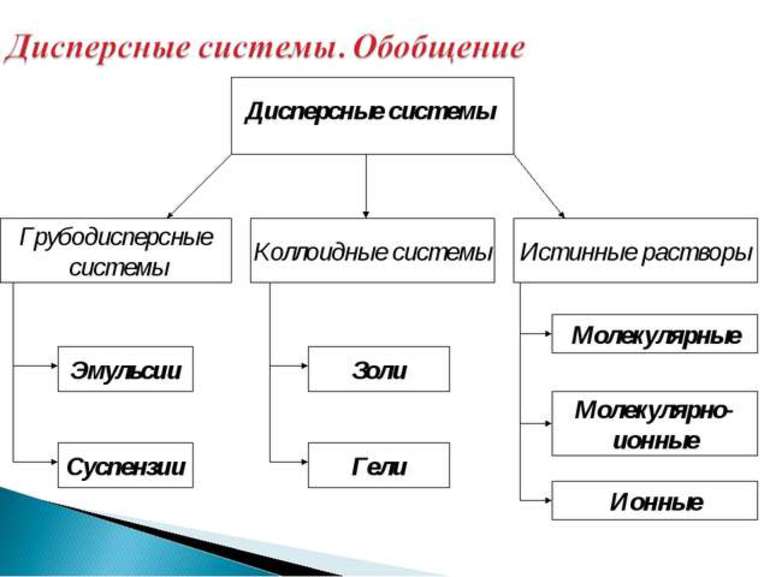
Классификация дисперсных систем
Дисперсные системы являются образованиями, в состав которых включено две фазы и более, почти не смешивающихся и не взаимодействующих друг с другом. В одном веществе, определяемом как дисперсионная среда, распределено другое вещество в виде дисперсной фазы. В зависимости от размеров частиц дисперсной фазы, системы классифицируют таким образом:
- молекулярно-ионные ( 1 н м ) — истинные растворы;
- коллоидные ( 1 - 100 н м ), например, раствор крахмала в воде;
- грубодисперсные ( > 100 н м ), например вода с песком.
За основу максимально полной классификации дисперсных систем принимают агрегатное состояние среды и фазы. Благодаря сочетаниям трех типов агрегатного состояния, выделяют девять разновидностей двухфазных дисперсных систем.
Исходя из характера кинетических свойств фазы, двухфазные дисперсные системы разделяют на два класса:
- свободнодисперсные системы с подвижной дисперсной фазой;
- связнодисперсные системы с твердой дисперсионной средой, связанными друг с другом частицами дисперсной фазы, которые сохраняют неподвижное положение.
Рассмотренные дисперсные системы разделяют согласно степени дисперсности. В том случае, когда частицы дисперсной фазы в системе обладают идентичными размерами, такую систему называют монодисперсной. Если частицы фазы отличаются по размерам, то система является полидисперсной. Чаще в реальном мире можно встретить полидисперсные системы.
К сложным дисперсным системам можно отнести молоко. В веществе содержатся в большой концентрации, за исключением воды, жир, казеин, молочный сахар. Жир в молоке имеет вид эмульсии, в процессе хранения продукта он медленно поднимается наверх, образуются сливки.
Казеин является коллоидным раствором и не способен самостоятельно выделяться. С другой стороны, казеин достаточно просто выпадает в осадок в процессе подкисления молока, к примеру, с помощью уксуса. В результате образуется творог. Естественное выделение казеина можно наблюдать, когда молоко скисает. Молочный сахар в молоке представляет собой молекулярный раствор, который способен выделяться только в процессе испарения воды.
Классификация свободнодисперсных систем в зависимости от размеров частиц:
Ультрамикрогетерогенные системы по-другому называют коллоидными или золями. Исходя из того, какова природа дисперсионной среды, золи классифицируют следующим образом:
- твердые золи;
- аэрозоли (золи, обладающие газообразной дисперсионной средой);
- лиозоли (золи, характеризующиеся дисперсионной средой в жидком агрегатном состоянии).
Микрогетерогенные системы представлены следующими типами:
- суспензии;
- эмульсии;
- пены;
- порошки.
Взвеси — являются дисперсионными системами, в которых фазы хорошо различимы визуально даже невооруженным глазом.
Ключевой характеристикой взвесей служит непрозрачность. При необходимости отделения среды и второстепенного вещества допустимо использовать стандартные фильтры или провести процедуру отстаивания. Классификация взвесей:
- Эмульсии. Данная система включает в себя среду и фазу, находящиеся в жидком агрегатном состоянии, не вступающие в химические реакции друг с другом и не растворяющиеся. Обычно эмульсии получают путем гомогенизации. К данному виду систем можно отнести большинство лекарственных средств или молоко.
- Суспензии. В этом случае среда обладает жидким агрегатным состоянием, а фаза представлена в виде твердой структуры. Суспензия образуется, когда в жидкость высыпают порошок. В результате формируется текучий состав по причине крайне мелкой фазы. Когда структура неподвижна, наблюдают выпадение осадка. В качестве примеров суспензий можно привести практически все строительные смеси.
- Аэрозоли. Данная система состоит из газообразного вещества, в котором распределена взвесь. Аэрозоли часто можно встретить в природном мире и быту. К примеру, аэрозолями являются грозовые или обычные облака, туманы и определенные виды осадков. В большинстве своем химические смеси, предназначенные для обработки растений в сельском хозяйстве, относятся к этому типу дисперсных систем.
Взвеси обладают большим значением для хозяйственной деятельности человека и природных процессов. В производстве активно применяют растворы. В окружающей среде распространены натуральные водные соединения, благодаря которым образуются почвы, и грунт насыщается питательными веществами. Взвеси являются непосредственными участниками жизнедеятельности всех живых существ.
Коллоидные системы важны для биологии и жизни человека. Биологические жидкости организма состоят из веществ, которые находятся в коллоидном состоянии. Такие биологические объекты, как клетки мышц и нервов, рассматривают в качестве коллоидных растворов. Дисперсионная среда крови представлена в виде плазмы, то есть водного раствора неорганических солей и белков.
Коллоидные системы отличаются от взвесей тем, что их разделение возможно лишь при наличии современного оборудования и специальных препаратов. Визуально данные комплексы можно идентифицировать, как однородные субстанции. По этой причине затруднено определение дисперсности коллоидных систем. Выделяют следующие типы:
Коллоидные системы имеют большое значение для химии. Данные системы получают с помощью смешивания в специальной технике. Производство подобных структур способствует созданию множества медицинских средств, удобрений и других полезных материалов.
Типы растворов высокомолекулярных веществ:
Принадлежность к той или иной группе определяется качествами высокомолекулярного вещества такими, как:
- тип фазы;
- среда;
- температура;
- иные условия.
Свойства высокомолекулярных веществ:
- Низкая скорость смешивания (медленная диффузия).
- На первом этапе вещества набухают, а далее смешиваются.
- Полимерные и истинные растворы обладают рядом значительных отличий.
- Законы, которые справедливы в случае с одними системами (Рауля, Вант-Гоффа), не характерны для других.
- По всей образованной субстанции свойства могут различаться по причине неодинакового направления и/или размеров молекул.
- Вещества обладают повышенной вязкостью.
Самопроизвольное образование характерно для определенных полимерных растворов. В том случае, когда набухание выполняется неорганическим методом, дисперсная система прекращает свое существование. Это связано с полным растворением фазы в среде, что сопровождается химической реакцией. Если метод набухания органический, то можно наблюдать получение студня.
Отдельно выделяют связнодисперсные системы, к которым относят пористые материалы. В зависимости от размеров пор, данные вещества классифицируют таким образом (классификация М.М. Дубинина):
Согласно рекомендациям ИЮПАК, микропористыми называют пористые материалы с размерами пор до 2 нм, мезопористыми — от 2 до 50 нм, макропористыми — свыше 50 нм.
Классификация пористых материалов в зависимости от структуры:
- Корпускулярные тела, сформированные за счет срастания определенных структурных компонентов, имеющих чаще всего разные формы и размеры. Срастающиеся элементы могут быть не пористыми или обладать первичной пористостью, к примеру, пористая керамика, бумага, ткань. Роль пор играют пространства между компонентами структуры.
- Губчатые тела являются результатом топохимических реакций, выщелачивания определенных составляющих твердых гетерогенных систем, пиролитического разложения твердых веществ, поверхностной и объемной эрозии. Поры губчатых тел образуют сеть из каналов и полостей разнообразных форм и неодинакового переменного сечения.
В зависимости от геометрических признаков пористые структуры классифицируют следующим образом:
- регулярные, с правильным чередованием отдельных пор или полостей и соединяющих их каналов;
- стохастические, в которых ориентация, форма, размеры, взаимное расположение и взаимосвязи пор определены случайным образом.
Большинство пористых материалов обладают стохастической структурой.
- открытые поры сообщаются с поверхностью, что обеспечивает фильтрацию жидких или газообразных сред;
- тупиковые поры аналогично сообщаются с поверхностью объекта, но не влияют на проницаемость материала;
- закрытые поры.
В качестве примера твердых гетерогенных систем можно привести композитные материалы. Композиты являются искусственно полученными сплошными, но неоднородными структурами. В состав данных материалов может быть включено два компонента и более. Отличительной особенностью являются четкие границы раздела между составными элементами. Кроме слоистых, большинство компонентов композитных материалов подразделяются на следующие группы:
- матрица, обеспечивающая совместную работу армирующих элементов;
- армирующие компоненты, отвечающие за механические параметры материала.
Старейшими композитами являются саман, железобетон, булат, папье-маше. В современной промышленности активно практикуют применение фиброармированных пластиков, стеклопластика, металлокерамики.
Движение дисперсных систем
С другой стороны, наличие разных типов структуры пристеночных течений многофазных сред делает необходимым учет различных факторов — таких, как инерционность капель, формирование жидкой пленки, фазовые переходы. Данные задачи решают путем конструирования особых математических моделей многофазных сред, разработки которых активно ведутся в настоящее время.
Возможности для изучения аналитическим методом нестационарных газодинамических течений многофазных дисперсных сред с несущей фазой в виде газа, которая включает в себя мелкие частицы твердого или жидкого вещества, значительно ограничены. В этом случае предпочтение отдается способам вычислительной механики.
Актуальны исследования подобных течений, когда существуют интенсивные фазовые переходы. В качестве примера можно привести:
- анализ аварийных ситуаций в охладительных системах, которыми оснащены атомные электростанции;
- изучение вулканической активности;
- разработка технологических приложений для оптимизации устройств, предназначенных для создания высокоскоростных многофазных струй.
При рассмотрении свободнодисперсных систем, среда в которых представлена в газообразном или жидком агрегатном состоянии — например, аэрозолей, коллоидных растворов, газовых эмульсий, мицеллярных растворов поверхностно-активных веществ, — можно сделать вывод о подвижности дисперсных частиц. Они могут совершать вращательные движения, колебания с неодинаковой амплитудой.
Подвижность дисперсных частиц, особенно высокодисперсных и ультрадисперсных, является фундаментальным свойством свободнодисперсных систем. Дисперсные частицы движутся за счет различных факторов. Процесс определяется размером частиц. Для высокодисперсных частиц характерны малые размеры, что способствует их активному участию в броуновском движении. Такое явление рассматривают в качестве проявления молекулярно-кинетических свойств дисперсных систем.
Другим молекулярно-кинетическим свойством является диффузия дисперсных частиц, в процессе которой они перемещаются по причине неодинаковой концентрации в разных участках дисперсной системы. Благодаря диффузии, концентрация частиц постепенно становится однородной. Согласно второму началу термодинамики, при диффузии можно наблюдать увеличение энтропии дисперсной системы.
Дисперсные частицы, обладающие большими размерами (в том числе, твердые частицы, капли, газовые пузыри), почти не принимают участия в броуновском движении. Таким образом, для грубодисперсных систем не характерны молекулярно-кинетические свойства. Данный признак позволяет квалифицировать системы на высокодисперсные и грубодисперсные.
Основная причина движения крупных дисперсных частиц заключается в разнице между плотностями дисперсной фазы и дисперсионной среды. В том случае, когда плотность дисперсной фазы больше, частицы медленно выпадают в осадок в результате воздействия силы тяжести. Такое явление называют седиментацией. Частицы, которые обладают меньшим весом, всплывают на поверхность. Тогда процесс называют обратной седиментацией.
На движение дисперсных частиц оказывают влияния другие внешние силы. Большое значение для коллоидной химии имеет движение заряженных частиц дисперсной фазы в электрическом поле. Такой процесс носит название электрофорез.
В отдельную группу выделяют перемещения дисперсных частиц, происходящие совместно с движущейся дисперсионной средой. Данные потоки являются двухфазными и обладают рядом существенных отличий от однофазных потоков газов или жидкостей.
К примеру, наличие в жидком веществе малого количества дисперсных частиц способствует увеличению степени вязкости дисперсной системы в сравнении с аналогичными показателями дисперсионной среды.
Системы, в которых одно вещество распределено в мелкораздробленном состоянии в среде другого, называются дисперсными. Распределенное вещество называется дисперсной фазой, а среда, в которой распределена дисперсная фаза – дисперсионной средой. Обязательным условием существования дисперсных систем является взаимная неравстворимость веществ, при этом взаимодействие дисперсной фазы и дисперсионной среды происходит за счет межмолекулярных сил на поверхности раздела фаз.
Дисперсные системы с размером частиц дисперсной фазы от 1 до 100 нм называются коллоидными растворамиили золями. По типу взаимодействия дисперсионной среды и дисперсной фазы коллоидные растворы разделяют на лиофобные и лиофильные. Лиофобные коллоидные растворы характеризуются слабым взаимодействием веществ, при этом частицы дисперсной фазы имеют молекулярную или ионную кристаллическую решетку. Такие системы являются необратимыми, т.к. осадки, остающиеся после разрушения системы, не образуют коллоидного раствора вновь при контакте с дисперсионной средой. Лиофильные коллоидные растворы характеризуются сильным взаимодействием веществ, при этом частицами дисперсной фазы являются высокомолекулярные вещества, молекулы которых имеют размер коллоидных частиц. Такие системы являются обратимыми, т.к. осадки, остающиеся после разрушения системы, при контакте с дисперсионной средой вновь образуют коллоидный раствор.
Дисперсная фаза в коллоидном растворе представлена частицами, в состав которых входит ядро, состоящее из электронейтрального агрегата частиц, с адсорбированными на нем зарядообразующими ионами и противоионы.
В качестве примера рассмотрим строение коллоидной частицы золя хлорида серебра, полученного действием избытка раствора AgNO3 на раствор NaCl. Реакция протекает по уравнению:
При образовании золя хлорида серебра молекулы AgCl соединяются вместе, образуя более крупные частицы: mAgCl → (mAgCl). Образующийся кристалл AgCl называется ядром. На его поверхности находятся ионы, адсорбированные агрегатом (потенциалопределяющие, зарядообразующие ионы). В качестве них выступают те ионы, которые находятся в растворе в избытке и принадлежат элементу, входящему в состав ядра. В нашем примере зарядообразующими являются ионы Ag+. Положительно заряженные ионы серебра притягивают к себе противоионы (NO3‾ ). Потенциалопределяющие ионы и противоионы составляют адсорбционный слой. Так образуется коллоидная частица золя AgCl, называемая гранулой. Потенциалопределяющие ионы притягивают несколько меньшее количество противоионов, поэтому коллоидные частицы имеют положительный либо отрицательный заряд. Примерный состав гранулы в данном случае можно выразить формулой:
Вокруг гранулы находится диффузный слой противоионов, заряд которых равен заряду коллоидной частицы. Гранула и диффузный слой образуют электронейтральную мицеллу. Примерный состав мицеллы хлорида серебра выражается формулой:

Рис. 1.6.1 Строение мицеллы золя хлорида серебра
Для получения коллоидных растворов используют дисперсионный и конденсационный методы.
Дисперсионный метод заключается в раздроблении вещества, выступающего в роли дисперсной фазы, до размеров коллоидных частиц. В частности, для получения золей металлов широко используется электрическое распыление металлов: под действием электрической дуги металл испаряется, пары металла в дисперсионной среде конденсируются и образуют микрокристаллы, которые и образуют коллоидные частицы.
Конденсационный метод основан на том, что частицы дисперсной фазы образуются за счет объединения молекул вещества в ассоциаты. Важным условием для использования данного метода является пересыщенность системы по отношению к диспергируемому веществу и наличие условий для возникновения кристаллов. К этому методу относятся способ смены растворителя и использование химических реакций. Способ смены растворителя заключается в подборе растворителя, с которым диспергируемое вещество образует истинный раствор, при этом сам растворитель должен растворяться в дисперсионной среде. Если такой раствор добавить в дисперсионную среду, то в результате выпадения диспергируемого вещества в осадок и объединения его молекул получается коллоидный раствор. Химические реакции, в результате которых образуются труднорастворимые вещества, позволяют получить наиболее однородные коллоидные системы.

Устойчивость коллоидных систем определяется величиной коллоидных частиц и свойствами удельной поверхности. Количественной характеристикой устойчивости является степень дисперсности (D) – величина, обратная среднему диаметру частиц (d): D = 1/d. Коллоидная система будет тем устойчивее, чем больше степень дисперсности. Различают кинетическую (частицы не оседают) и агрегативную (частицы не слипаются друг с другом) устойчивость.
Устойчивость коллоидного раствора можно нарушить, нейтрализуя электрические заряды коллоидных частиц, что приводит к укрупнению частиц в более сложные агрегаты. Этот процесс называется коагуляцией. Вещества, вызывающие коагуляцию, называются коагулянтами; к ним относятся различные электролиты. При добавлении электролита коллоидная частица адсорбирует ионы противоположного знака, что и вызывает нейтрализацию зарядов. Чем меньше заряд коагулирующего иона, тем больше ионов требуется на коагуляцию коллоида.
Коллоидные растворы обладают оптическими и электрическими свойствами.
При пропускании через коллоидный раствор постоянного электрического тока все коллоидные частицы движутся к одному электроду, а противоионы к другому. Перемещение коллоидных частиц под действием электрического тока называется электрофорезом. Процесс электрофореза используется при осаждении коллоидных частиц на поверхности металлов для создания изолирующих или антикоррозионных покрытий.
Оптические свойства коллоидных систем заключаются в том, что растворы рассеивают свет. Это обусловлено тем, что мицеллы больше атомов, поэтому в отраженном свете раствор опалесцирует. Интенсивность светорассеяния возрастает с увеличением размера коллоидных частиц и их концентрации. Явление светорассеяния используется при изучении коллоидных растворов.
Системы, в которых одно вещество распределено в мелкораздробленном состоянии в среде другого, называются дисперсными. Распределенное вещество называется дисперсной фазой, а среда, в которой распределена дисперсная фаза – дисперсионной средой. Обязательным условием существования дисперсных систем является взаимная неравстворимость веществ, при этом взаимодействие дисперсной фазы и дисперсионной среды происходит за счет межмолекулярных сил на поверхности раздела фаз.
Дисперсные системы с размером частиц дисперсной фазы от 1 до 100 нм называются коллоидными растворамиили золями. По типу взаимодействия дисперсионной среды и дисперсной фазы коллоидные растворы разделяют на лиофобные и лиофильные. Лиофобные коллоидные растворы характеризуются слабым взаимодействием веществ, при этом частицы дисперсной фазы имеют молекулярную или ионную кристаллическую решетку. Такие системы являются необратимыми, т.к. осадки, остающиеся после разрушения системы, не образуют коллоидного раствора вновь при контакте с дисперсионной средой. Лиофильные коллоидные растворы характеризуются сильным взаимодействием веществ, при этом частицами дисперсной фазы являются высокомолекулярные вещества, молекулы которых имеют размер коллоидных частиц. Такие системы являются обратимыми, т.к. осадки, остающиеся после разрушения системы, при контакте с дисперсионной средой вновь образуют коллоидный раствор.
Дисперсная фаза в коллоидном растворе представлена частицами, в состав которых входит ядро, состоящее из электронейтрального агрегата частиц, с адсорбированными на нем зарядообразующими ионами и противоионы.
В качестве примера рассмотрим строение коллоидной частицы золя хлорида серебра, полученного действием избытка раствора AgNO3 на раствор NaCl. Реакция протекает по уравнению:
При образовании золя хлорида серебра молекулы AgCl соединяются вместе, образуя более крупные частицы: mAgCl → (mAgCl). Образующийся кристалл AgCl называется ядром. На его поверхности находятся ионы, адсорбированные агрегатом (потенциалопределяющие, зарядообразующие ионы). В качестве них выступают те ионы, которые находятся в растворе в избытке и принадлежат элементу, входящему в состав ядра. В нашем примере зарядообразующими являются ионы Ag+. Положительно заряженные ионы серебра притягивают к себе противоионы (NO3‾ ). Потенциалопределяющие ионы и противоионы составляют адсорбционный слой. Так образуется коллоидная частица золя AgCl, называемая гранулой. Потенциалопределяющие ионы притягивают несколько меньшее количество противоионов, поэтому коллоидные частицы имеют положительный либо отрицательный заряд. Примерный состав гранулы в данном случае можно выразить формулой:
Вокруг гранулы находится диффузный слой противоионов, заряд которых равен заряду коллоидной частицы. Гранула и диффузный слой образуют электронейтральную мицеллу. Примерный состав мицеллы хлорида серебра выражается формулой:

Рис. 1.6.1 Строение мицеллы золя хлорида серебра
Для получения коллоидных растворов используют дисперсионный и конденсационный методы.
Дисперсионный метод заключается в раздроблении вещества, выступающего в роли дисперсной фазы, до размеров коллоидных частиц. В частности, для получения золей металлов широко используется электрическое распыление металлов: под действием электрической дуги металл испаряется, пары металла в дисперсионной среде конденсируются и образуют микрокристаллы, которые и образуют коллоидные частицы.
Конденсационный метод основан на том, что частицы дисперсной фазы образуются за счет объединения молекул вещества в ассоциаты. Важным условием для использования данного метода является пересыщенность системы по отношению к диспергируемому веществу и наличие условий для возникновения кристаллов. К этому методу относятся способ смены растворителя и использование химических реакций. Способ смены растворителя заключается в подборе растворителя, с которым диспергируемое вещество образует истинный раствор, при этом сам растворитель должен растворяться в дисперсионной среде. Если такой раствор добавить в дисперсионную среду, то в результате выпадения диспергируемого вещества в осадок и объединения его молекул получается коллоидный раствор. Химические реакции, в результате которых образуются труднорастворимые вещества, позволяют получить наиболее однородные коллоидные системы.
Устойчивость коллоидных систем определяется величиной коллоидных частиц и свойствами удельной поверхности. Количественной характеристикой устойчивости является степень дисперсности (D) – величина, обратная среднему диаметру частиц (d): D = 1/d. Коллоидная система будет тем устойчивее, чем больше степень дисперсности. Различают кинетическую (частицы не оседают) и агрегативную (частицы не слипаются друг с другом) устойчивость.
Устойчивость коллоидного раствора можно нарушить, нейтрализуя электрические заряды коллоидных частиц, что приводит к укрупнению частиц в более сложные агрегаты. Этот процесс называется коагуляцией. Вещества, вызывающие коагуляцию, называются коагулянтами; к ним относятся различные электролиты. При добавлении электролита коллоидная частица адсорбирует ионы противоположного знака, что и вызывает нейтрализацию зарядов. Чем меньше заряд коагулирующего иона, тем больше ионов требуется на коагуляцию коллоида.
Коллоидные растворы обладают оптическими и электрическими свойствами.
При пропускании через коллоидный раствор постоянного электрического тока все коллоидные частицы движутся к одному электроду, а противоионы к другому. Перемещение коллоидных частиц под действием электрического тока называется электрофорезом. Процесс электрофореза используется при осаждении коллоидных частиц на поверхности металлов для создания изолирующих или антикоррозионных покрытий.
Оптические свойства коллоидных систем заключаются в том, что растворы рассеивают свет. Это обусловлено тем, что мицеллы больше атомов, поэтому в отраженном свете раствор опалесцирует. Интенсивность светорассеяния возрастает с увеличением размера коллоидных частиц и их концентрации. Явление светорассеяния используется при изучении коллоидных растворов.
Коллоидные растворы – это дисперсные системы, в которых частицы (капли, пузырьки) имеющие размер в пределах от 1 - 100 нм, распределены в дисперсионной среде.
Коллоидные растворы – это дисперсные системы, в которых частицы (капли, пузырьки) имеющие размер в пределах от 1 - 100 нм, распределены в дисперсионной среде.
Коллоидные растворы являются промежуточным состоянием между истинным раствором и суспензией.
Суспензия – это гетерогенная смесь 2х компонентов, один из которых по размеру больше другого, который взвешен в среде первого. По истечению некоторого времени частицы суспензии оседают на дне сосуда.
Истинный раствор – гомогенная смесь, в которой частицы компонентов настолько малы, что их невозможно увидеть невооруженным глазом.
Коллоиды состоят из:
1. прерывная фаза (дисперсная);
2. непрерывная фаза (дисперсионная среда).
Частицы в коллоидном растворе имеют диаметр в диапазоне 1-500 нм. Они не склонны к осаждению и их нельзя отделить от дисперсионной среды центрифугированием и фильтрованием.
Если пропустить луч света через коллоидную среду, то он несколько в ней рассеивается. Этот эффект называется эффектом Тинделя. Его можно наблюдать в солнечный день в комнате, когда луч света проходит через взвеси пыли в воздухе.
Коллоиды бывают нескольких видов. Примеры приведены в таблице.
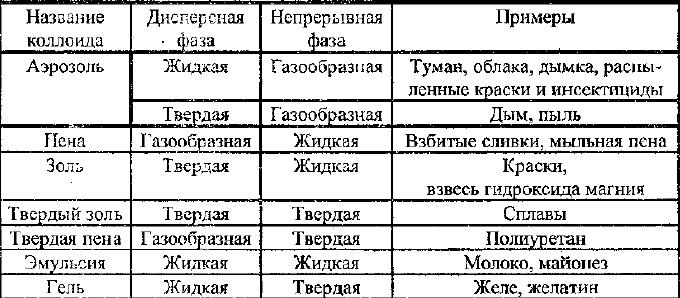
Основываясь на этой таблице, можно увидеть, что коллоидные системы играют огромную роль в человеческой жизни.
Крайне редко в природе встречаются вещества в идеально чистом виде и состоянии. Обычно это разбавленная гомогенная субстанция, состоящая из различных атомов и молекул. Причем это необязательно 2 элемента, встречаются соединения с тремя и более. Когда одна структура находится в другой, равномерно распределяется, но не растворяется в ней, — это дисперсные системы.
- Понятие и определение
- Классификация по агрегатному состоянию
- Существующие виды
- Взвеси и их особенности
- Коллоидные системы
- Высокомолекулярные вещества
- Ключевые свойства
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
- Свободнодисперсные. Основное и главное свойство такой системы — текучесть. Поэтому сюда относят любые аэрозоли и растворы.
- Связнодисперсные. Это твердые или полутвердые системы. К ним относятся все концентрированные пасы или аморфные вещества.
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
- Эмульсии. В жидком агрегатном состоянии находится фаза и среда, они не взаимодействуют друг с другом и не растворяются. Многие получаются посредством гомогенизации. К ним относят большинство лекарственных препаратов или молоко.
- Суспензии. Здесь средой является жидкость, а фазой — твердая структура. Получают посредством пересыпания в жидкость порошка. Структура получается текучая, т. к. фаза крайне мелкая. Если оставлять структуру в неподвижном состоянии, выпадает осадок. Почти все строительные растворы относятся к категории.
- Аэрозоли. Взвесь в этом случае располагается в газе. Примеров множество, встречаются как в природе, так и в быту. Например, грозовые или обычные облака, туманы и некоторые виды осадков. Большинство химикатов, производимых для обработки сельскохозяйственных структур, тоже являются аэрозолями.
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:

Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
- Процессы смешения происходят естественно и крайне медленно.
- Сначала происходит набухание, а затем смешивание.
- Полимерные и истинные растворы отличаются существенно. Те законы, которые характерны для одних (Рауля, Вант-Гоффа), несвойственны другим.
- По всей полученной субстанции свойства могут различаться из-за разного направления и/или размеров молекул.
- Повышенная вязкость.
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства

Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
- Степень (количество фаз).
- Молекулярный вес.
- Размеры частиц.
- Агрегатное состояние.
- Лиофобная/лиофильная группа.
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Читайте также:
- Кто такие пацифисты кратко
- Пришла в детский сад улыбнись на пороге все что отдаешь детям получаешь обратно в итоге
- Лето 1854 тютчев анализ стихотворения кратко
- Что называют солнечной радиацией в каких единицах она измеряется от чего зависит ее величина кратко
- Москва как наследница византийской империи кратко

