Какие биологические материалы можно использовать для получения препаратов хромосом кратко
Обновлено: 06.07.2024
Своевременное проведение хромосомного анализа имеет большое значение для выявления причин возникновения и прогнозирования многих наследственных и врожденных пороков развития. В лабораториях медицинской цитогенетики для анализа хромосомных аномалий используются классические методы цитогенетического анализа. Однако, в ряде случаев разрешающей способности этих методов оказывается недостаточно для успешного проведения диагностики хромосомных аномалий. В современной медико-генетической практике классические генетические методы дополнены высокотехнологичными методами, один из которых – флюоресцентная гибридизация in situ, или так называемый FISH-метод. В настоящее время редкое исследование, требующее анализа хромосом, обходится без использования FISH. Метод применяется очень широко – от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Современные методы способствуют повышению уровня генетического консультирования, а также эффективной профилактике хромосомных заболеваний.

1. Балева Л.С. Бондаренко Н.А., Демидова И.А. и др. Микроделеция хромосомы у ребенка, родившегося от облученных родителей: применение молекулярно-цитогенетической диагностики // Российский вестник перинатологии и педиатрии. – 2012. – Т. 57, № 1. – С. 66-69.
2. Берешева А.К., Юров И.Ю., Колотий А.Д. и др. Мозаичная форма синдрома Шерешевского – Тернера с кольцевой хромосомой Х у девочки 8 лет: применение методов молекулярно – цитогенетической диагностики / / Российский вестник перинатологии и педиатрии. – 2011. – № 5. – С. 30-37.
3. Демидова И.А., Ворсанова С.Г., Юров И.Ю. и др. Цитогенетические и молекулярно-цитогенетические исследования недефференцированных форм умственной отсталости у детей // Российский вестник перинатологии и педиатрии. – 2009. – № 1. – С. 69-75.
4. Демидова И.А., Ворсанова С.Г., Юров И.Ю. и др. Исследование низкопроцентного мозаицизма гоносом у двух детей с задержкой полового и физического развития: необходимость применения молекулярно-цитогенетических методов // Российский вестник перинатологии и педиатрии. – 2010. – № 6. – С. 36-40.
5. Бочков Н.П., Пузырев В.П., Смирнихина С.А. Клиническая генетика. – М.: ГЭОТАР-Медиа, 2011. – 592 с.
6. Колотий А.Д., Ворсанова С.Г., Юров И.Ю. и др. Выявление микроанамалий хромосом у детей с недифференцированными формами умственной отсталости: оригинальный алгоритм анализа хромосом высокого разрешения методами молекулярной цитогенетики // Фундаментальные исследования. – 2013. – № 6. – С. 1411-1419.
7. Колотий А.Д., Ворсанова С.Г., Юров И.Ю. и др. Цитогенетические и молекулярно-цитогенетические исследования в диагностике мозаичных форм хромосомных аномалий у детей / / Российский вестник перинатологии и педиатрии. – 2011. – №2. – С. 23-29.
8. Кравцова Н.А., Кравцов Ю.А., Антоненко Ф.Ф. Психологические аспекты нарушений половой дифференцировки у детей // Тихоокеанский медицинский журнал. – 2005. – № 3. – С. 61-63.
9. Минайчева Л.И., Назаренко Л.П., Лебедев И.Н., Кашеварова А.А. Применение молекулярно-цитогенетических методов в клинической практике // Вопросы диагностики в педиатрии. – 2009. – Т. 1. – № 2. – С. 32-34.
11. Рудько Г.Г., Алтынник Н.А., Потапова Н.В. и др. Случай диагностики трисомии по кольцевой хромосоме 14 при расширении воротникового пространства плода // Пренатальная диагностика. – 2012. – Т. 11, № 3. – С. 254-257.
12. Benn P., Chapman A.R. Ethical and practical challenges in providing noninvasive prenatal testing for chromosome abnormalities: an update // Curr. Opin Obstet Gynecol. – 2016. – V. 28, № 2. – P. 119-24.
13. Faraut T., Mermet M.A., Demongeot J., Cohen O. Cooperation of selection and meiotic mechanisms in the production of imbalances in reciprocal translocations // Cytogenet. Cell Genet. -2000. – V. 88. – P. 15–21.
14. Gonzales P.R., Carroll A.J., Korf B.R. Overview of Clinical Cytogenetics. // Curr. Protoc. Hum. Genet. – 2016. – V. 89, № 8.1. – С. 1-8.
15. Kemp T., Smith L., Akerman S. Gonadal pathology in a girl with 45,X/46,XY mosaicism // S. Afr. Med J. – 2015. – V. 105, № 12. – P. 1001-1003.
16. Morozkin E.S., Loseva E.M., Karamysheva T.V. et al. Amethod for generating selective DNAprobes for the analysis of C-negative regions in human chromosomes // Cytogenet. Genome Res. – 2011. – V. 135, № 1. – P. 1–11.
17. Mangelschots K., Van Roy B., Speleman F. et al. Reciprocal translocation between the proximal regions of the long arms of chromosomes 13 and 15 resulting in unbalanced offspring: characterization by fluorescence in situ hybridization and DNA analysis // Hum. Genet. – 1992. – V. 89. – P. 407–413.
18. Speicher M.R., Carter N.P. The new cytogenetics: blurring the boundaries with molecular biology // Nat. Rev. Genet. – 2005. – V. 6. – P. 782–792.
20. Vorsanova S.G., Yurov Y.B., Ulas V.Y. et al. Cytogenetic and molecular-cytogenetic studies of Rett syndrome (RTT): aretrospective analysis of a Russian cohort of RTT patients (the investigation of 57 girls and three boys) // Brain. Dev. – 2001. – V. 23. – P. 196–201.
Точная идентификация наследственных заболеваний часто затруднена, прежде всего из-за отсутствия при большинстве наследственных болезней патогномоничных признаков. Сложности в диагностике врожденных и наследственных нарушений связаны со сходством их клинических признаков, которые обусловлены мутациями различных генов. Диагностику наследственных заболеваний также затрудняет фенотипический полиморфизм нарушений, когда при одной и той же унаследованной генной мутации могут развиться как ее ярко выраженные, так и стертые или даже различные клинические формы. Трудности диагностики наследственных заболеваний также связаны с существованием некоторых генетических явлений, оказывающих существенное влияние на формирование клинического фенотипа, таких как, мозаицизм, экспансия аллелей, однородительское наследование (дисомия и изодисомия) и геномный импринтинг [5, 18, 20].
Важнейшая роль в диагностике наследственных болезней принадлежит лабораторным исследованиям: цитогенетическим, молекулярно-генетическим, биохимическим и др. Существенная доля пациентов, обратившихся к врачу-генетику, нуждается в уточнении диагноза с помощью специальных методов исследования. В современной медико-генетической практике классические генетические методы дополнены высокотехнологичными методами, такими как, молекулярно-генетические и молекулярно-цитогенетические, методы иммунологического анализа [10, 11].
Хромосомные болезни – это обширная группа врожденных патологических состояний, проявляющихся аномалиями развития и обусловленных нарушениями числа или структуры хромосом в соматических клетках или половых клетках. Клиническая симптоматика хромосомной патологии разнообразна, однако одним из ведущих симптомов является задержка нервно-психического развития [5].
Своевременное проведение хромосомного анализа имеет большое значение для выявления причин возникновения и прогнозирования многих наследственных и врожденных пороков развития. В России, в практическом здравоохранении исследования кариотипа проводятся с 1966 года. В лабораториях медицинской цитогенетики для анализа хромосомных аномалий используются классические методы цитогенетического анализа, базирующиеся на дифференциальном окрашивании хромосом. Эти методы позволяют выявлять все численные нарушения и значительную часть структурных хромосомных перестроек. Однако в ряде случаев разрешающей способности этих методов оказывается недостаточно для успешного проведения диагностики хромосомных аномалий, например, для точного определения границ точек разрывов при инверсиях и транслокациях, для определения происхождения дополнительного хромосомного материала при несбалансированных транслокациях [1, 13, 16].
Возможности цитогенетического анализа значительно расширились благодаря появлению и развитию новых высокоинформативных молекулярно-цитогенетических методов, главный из которых – флюоресцентная гибридизация in situ – FISH-метод (от англ. fluorescent in situ hybridization). Метод позволят проводить гибридизацию метафазных или интерфазных хромосом с различными ДНК-зондами. Зонды – клонированные последовательности или выделенные участки ДНК, комплементарные участку ДНК исследуемого кариотипа и меченные флюоресцирующими веществами. Наиболее часто используют высокоповторяющиеся последовательности ДНК центромерных или перицентромерных районов, однако в ряде случаев возникает необходимость в применении уникальных ДНК-последовательностей, таких как, космидные клоны, YAС – пробы, анонимные последовательности и др., что обеспечивает детальное исследование генетической структуры хромосомных перестроек, например маркерных хромосом, а также анализ точек разрывов хромосом в различных типах транслокаций, делеций, дупликаций, инверсий, инсерций, дицентрических и кольцевых хромосом [10, 14].
Принцип метода заключается в следующем: 1 – для изучаемой хромосомы или ее участка готовят однонитевой участок ДНК, к которому присоединяются метки – биотин или дигоксигенин (такой участок ДНК называется ДНК-зондом); 2 – на микроскопическом препарате in situ при обработке щелочью хромосомная ДНК денатурирует, т.е. разрываются водородные связи между двумя нитями ДНК; 3 – препарат обрабатывают ДНК-зондом. Поскольку нити ДНК взаимокомплементарны, зонд присоединяется к соответствующему участку хромосомы. В этом участке восстанавливается двойная спираль (ренатурация ДНК). Причем можно одновременно использовать множественные зонды к разным локусам; 4 – полученный препарат обрабатывают химическими соединениями, которые способны избирательно присоединяться к биотину или дигоксигенину; 5 – к полученным комплексам присоединяют флюоресцентные красители (двухцветная или трехцветная флюоресцентная гибридизация и т.д.); 6. – с помощью люминесцентного микроскопа окрашенные хромосомы можно увидеть на фоне неокрашенных [5, 9].
Метод FISH применяется очень широко – от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Метод можно применять для диагностики анеуплоидий в интерфазных ядрах – интерфазная цитогенетика. Метод экономичен и занимает меньше времени, чем кариотипирование дифференциально окрашенных хромосом. Неоспоримое преимущество интерфазной цитогенетики – отсутствие необходимости в приготовлении препаратов метафазных хромосом и культивировании клеток. Это снимает многие вопросы, связанные с возникновением артефактов, присущих длительным культурам клеток (полиплоидизация in vitro, возникновение и клональная селекция клеток с аберрациями кариотипа, изменение пропорций клеточных клонов при хромосомном мозаицизме) [5].
FISH на интерфазных хромосомах служит быстрым методом пренатальной диагностики трисомий по 21, 18 или 13 хромосомам или аберраций половых хромосом [12]. Например, можно получить информацию о количестве 21-х хромосом в клетках амниотической жидкости (пренатальная – дородовая диагностика синдрома Дауна у плода) – специфический ДНК – зонд для 21-ой хромосомы покажет в ядрах этих клеток или две светящиеся точки, что соответствует двум 21-м хромосомам, или три – что выявит трисомию по 21-ой хромосоме [17]. Методы молекулярной цитогенетики позволили повысить верификацию хромосомных болезней. При использовании обычных цитогенетических анализов – доля невыявленных случаев составила 10 %, при использовании FISH – технологии – снизилась до 0,9 – 1,5 % [18, 19].
Исследования, проведенные Л.С. Балевой, свидетельствуют о том, что выявление субтеломерных и теломерных перестроек с помощью молекулярно-цитогенетических методов в комплексе с классической цитогенетической диагностикой может вносить значительный вклад в диагностику недифференцированных форм умственной отсталости у детей. Частота таких перестроек, по данным разных авторов, составляет от 0,5 до 7,4 %. Корреляция теломерных и субтеломерных аномалий хромосом с определенной клинической картиной может способствовать вычленению новых хромосомных синдромов из большой группы недифференцированных форм умственной отсталости [1].
Проведено цитогенетическое и молекулярно-цитогенетическое исследование у 3593 детей с недифференцированными формами умственной отсталости, множественными врожденными пороками и/или микроаномалиями развития. В результате цитогенетического анализа авторы, помимо хромосомных аномалий, выявили хромосомные варианты и инверсии околоцентрамерного гетерохроматина хромосом 1, 9, 13-17, 21, 22 и Y. Количественная FISH с применением ДНК проб, специфически маркирующих вариабельные участки гетерохроматина хромосом, подтвердила цитогенетические данные и позволяет оценить непосредственно содержание ДНК в данном хромосомном участке и считается прямым методом исследования. До сих пор нет единого взгляда на роль вариантов околоцентромерного гетерохроматина в развитии той или иной патологии. Авторы предположили, что возможно при соответствующих обстоятельствах эти участки могут оказывать влияние на нарушение функциональной активности генов, находящихся от них в непосредственной близости, – так называемый эффект положения генов [3].
Структурные хромосомные аномалии в виде делеций и дупликаций небольшого размера составляют значительную долю хромосомной патологии среди детей с задержкой развития, аутизмом, пороками и аномалиями развития. А.Д. Колотий привела результаты лабораторной диагностики хромосомных микроперестроек у 14-ти детей с недифференцированными формами умственной отсталости, пороками и/или малыми аномалиями развития. При проведении цитогенетического исследования методами дифференциального окрашивания хромосомная патология у этих детей не была выявлена. Данные случаи сложны для цитогенетической диагностики, поскольку могут быть связаны с микроаномалиями кариотипа, выявление которых возможно только с применением молекулярно-цитогенетических методов исследования. Применение специального алгоритма анализа хромосомных нарушений, включающего гибридизацию на хромосомах in situ позволило выявить микроаномалии кариотипа и определить этиологические причины хромосомной патологии у всех 14 детей. Применение современных диагностических технологий позволяет не только повысить эффективность молекулярно-цитогенетической диагностики за счет выявления микронарушений генома у детей с нарушениями психики, но также выявлять новые нозологии из недифференцированных (идиопатических) форм умственной отсталости [7].
Хромосомный мозаицизм чаще наблюдается при численных хромосомных аномалиях в отличие от структурных, что было установлено многими исследованиями. Результаты исследования Колотий А.Д. показали, что после цитогенетического анализа хромосомный мозаицизм наблюдался у 3,4 % от всех изучаемых больных. После проведения молекулярно-цитогенетического исследования доля случаев с хромосомным мозаицизмом составила 5,9 %. Установлено, что выявление возможного мозаицизма молекулярно-цитогенетическими методами диагностики требуется пациентам со стертой клинической картиной таких хромосомных синдромов, как Дауна, Эдвардса, Шерешевского-Тернера, трисомии Х, а также девочкам с дисгенезией гонад при нормальном кариотипе, определенном цитогенетическим методом. Своевременная эффективная диагностика мозаичных форм хромосомных аномалий способствует лечебной коррекции, особенно при мозаичных формах аномалий половых хромосом [6, 8, 15].
В работе Минайчевой Л.И. отражено применение молекулярно-цитогенетического метода в клинической практике. Беременная женщина 30 лет обратилась в Генетическую клинику института для проведения эхографического исследования плода на 21 неделе гестации. При обследовании был выявлен порок развития сердечно-сосудистой системы. Для исключения хромосомной патологии было проведено инвазивное вмешательство (кордоцентез) и получен плодный материал. Стандартный цитогенетический анализ (G-окраска) не выявил структурных и числовых нарушений – 46, XY. При осмотре врачом-генетиком в возрасте 3-х месяцев выявлены множественные стигмы дизэмбриогенеза – эпикант, короткий нос с открытыми вперед ноздрями, широкая верхняя челюсть, микрогнатия, оттопыренные уши, отмечалась мышечная гипотония и прогрессирующая деформация позвоночника, что позволило заподозрить наличие генетической патологии и провести дополнительное обследование с использованием молекулярно-цитогенетических методов. Методом FISH была выявлена микроделеция в хромосоме 7 в критической области синдрома Вильямса. Верификация диагноза у пациента в достаточно раннем возрасте позволила скорректировать план наблюдения и разработать индивидуальный комплекс профилактических, лечебных и реабилитационных мероприятий [9].
Таким образом, флюоресцентная гибридизация in situ в настоящее время является одним из наиболее эффективных и широко используемых методов молекулярной цитогенетики, позволяет установить и уточнить диагноз хромосомной патологии, что способствуют повышению уровня генетического консультирования, а также эффективной профилактике хромосомных заболеваний.
Характеристика цитогенетических методов исследования.
Полиморфизм хромосом человека.
Что такое кариотип?
Кариотипом принято считать совокупность морфологических особенностей полного хромосомного набора, свойственного клеткам данного вида. Специфичность кариотипа каждого вида определяется общим числом хромосом, их размером и формой.
Когда и кем было точно установлено число хромосом у человека?
В 1956 году Тио и Леван сообщили, что число хромосом у человека в клетках эмбриона – 46, а не 48, как считали раньше, а Форд и Хамертон подтвердили эти выводы.
На основании каких признаков первоначально была основана классификация хромосом?
Кариотип человека в норме и при хромосомных аномалиях и синдромах требует унифицированной системы описания или символики хромосом. Эта система первоначально была основана на данных о размерах хромосом и центромерном индексе (отношении размеров короткого плеча к длинному). Если центромера располагается посредине хромосомы, то такая хромосома называется метацентрической, если центромера располагается ближе к одному из концов хромосомы, то ее называют акроцентрической. Некоторые акроцентрические хромосомы имеют спутники, которые в неделящейся клетке формируют ядрышки. Кроме того, различают субметацентрические хромосомы, когда центромера расположена не посередине хромосомы, а несколько сдвинута к одному из концов, но не столь значительно, как в акроцентрических хромосомах. Концы каждого плеча хромосомы называют теломерами.
Какие классификации хромосом были созданы и существуют в настоящее время?
Как обозначаются структурные особенности строения хромосом?
Какой биологический материал можно использовать для получения препаратов хромосом?
Лимфоциты периферической и пуповинной крови, ворсины хориона, клетки костного мозга, ткани абортуса (печень, кишечник, желудок, фибробласты кожи).
Какие известны виды дифференциальной окраски хромосом?
Районы и сегменты на хромосомах проявляются после дифференциального окрашивания различными методами, которые также следует указывать при описании хромосомных аномалий. В настоящее время известно несколько способов окрашивания хромосом, основными являются G-,Q-,R-,C-методы.
В чем заключается суть метода G-окрашивания?
При G-методе окрашивания (G-banding) каждая хромосома имеет специфическую последовательность темных и светлых полос. Данный тип окрашивания получается при предварительном воздействии на хромосомные препараты щелочей, протеолитических ферментов (трипсина), солей, а затем окрашивании красителем Гимза разведенном на фосфатном буфере. Окрашенные таким способом препараты анализируются под световым микроскопом с иммерсией при увеличении Х1000-1600. Это наиболее часто используемая окраска, позволяет идентифицировать каждую хромосому и грубые перестройки в кариотипе.
Тема 5. Подряд. Возмездное оказание услуг: К адвокату на консультацию явилась Минеева и пояснила, что.
Цитогенетические исследования в гематологии: окрашивание хромосом, метод FISH
Цитогенетическое исследование — это микроскопический анализ хромосом, результаты которого весьма важны для постановки диагноза, классификации, лечения и научного исследования заболеваний системы крови, прежде всего — онкогематологических. Значение цитогенетических методов для диагноза и лечения определяется доступностью опухолевых клеток для кариотипирования и их гетерогенностью, а с научной точки зрения — возможностью изучения изменений в структуре и функции генетических локусов, ассоциированных со злокачественной трансформацией.
Морфология хромосом сильно варьирует во время клеточного цикла. Для микроскопического анализа хромосомы должны быть визуализированы как дискретные структуры. Наилучшим образом это достигается на стадии прометафазы митоза, когда каждая хромосома видна как две идентичные хроматиды, и особенно на стадии метафазы, когда хромосомы максимально конденсированы и располагаются в одной плоскости в центре клетки отдельно одна от другой.
Нормальные клетки человека содержат 22 пары аутосом и одну пару половых хромосом: две Х-хромосомы у женщин и по одной копии половых хромосом (X и Y) у мужчин.
Для цитогенетического анализа лейкозов, миелодиспластических синдромов и хронических миелопролиферативных заболеваний исследуют клетки костного мозга. При невозможности их получения может быть исследована кровь (если она содержит бласты). Цитогенетический анализ лимфом выполняется в клетках ткани лимфатического узла. Культивирование клеток из опухоли повышает митотический индекс (пропорцию клеток, находящихся в фазе митоза) и способствует пролиферации злокачественных клеток.
Сравнительное кариотипирование нормальных клеток проводят в Т-лимфоцитах периферической крови, которые предварительно культивируют в среде с митогеном растительного происхождения — фитогемагглютинином.
Окрашивание хромосом в гематологии
В конце 1960-х годов была разработана методология дифференциального окрашивания метафазных хромосом, а в 1971 г. создана номенклатура хромосомных сегментов, позволяющая точно описывать хромосомные аномалии. Позднее были внедрены методики окрашивания менее конденсированных и, соответственно, более длинных профазных и прометафазных хромосом, которые обладают более высоким разрешением, так как позволяют визуализацию 500-2000 сегментов (метафазное окрашивание визуализирует только 300 сегментов).
Достаточно большое количество профазных и прометафазных клеток для анализа получают путем синхронизации клеточного цикла, культивируя клетки в среде, содержащей антиметаболит (например, метотрексат), который ингибирует синтез ДНК. Подавление синтеза ДНК останавливает клеточный цикл в интерфазе. Затем клетки переносят в среду без метотрексата, обогащенную тимидином, где они одновременно входят в фазу митоза. Обработка клеточной культуры колхицином останавливает митоз одновременно во всех клетках на стадии профазы или прометафазы.
Первая стойкая хромосомная аномалия при злокачественной опухоли человека была выявлена в 1960 г. у больных хроническим миелолейкозом и получила название филадельфийской хромосомы (Ph), по имени города, в котором было сделано это открытие. Применение технологии хромосомного окрашивания позволило выявить множество хромосомных аномалий, большая часть которых встречается при онкогематологических заболеваниях. Некоторые красители окрашивают различные участки хромосом с вариабельной интенсивностью в зависимости от структуры хроматина в этих участках, их нуклеотидного и белкового состава.
В результате такого окрашивания получают уникальный паттерн чередования светлых и темных поперечных полос, специфичный для каждой хромосомы.
В настоящее время существуют несколько видов дифференциального окрашивания хромосом. При Q-окрашивании акрихин-ипритом (quinacrine) или акрихиндигидрохлоридом выявляется особый тип флюоресценции каждой хромосомы с образованием Q-исчерченности (Q-banding) — поперечных флюоресцентных полос, называемых Q-полосами (Q.-bands). Это позволяет идентифицировать отдельные хромосомы. Анализ Q-полос выполняют с помощью флюоресцентного микроскопа.
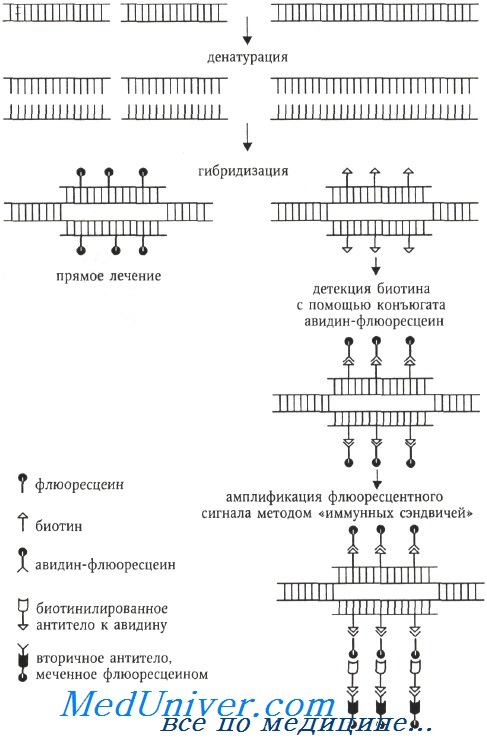
Схема анализа ДНК методом FISH
При окрашивании по Гимзе (G-banding) хромосомы приобретают вид серии темных и светлых полос или бэндов (bands). G-окрашивание применяется чаще, чем Q-окрашивание, так как анализ выполняется с помощью светового микроскопа, а G-полосы, в отличие от Q-полос, не выцветают со временем. Наиболее широко применяется методика, называемая GTG-окрашиванием (G bands by trypsin using Giemsa), с предварительной обработкой трипсином.
R-бэндинг (обработка хромосом горячим спиртовым раствором перед окрашиванием по Гимзе) выявляет полосы, которые обратны G-полосам и называются R-полосами (reverse of G bands).
Помимо Q-, G- и R-окрашивания, позволяющих выявлять полосы вдоль всей длины хромосомы, существуют методики, специализированные для исследования отдельных хромосомных структур, в том числе конститутивного гетерохроматина (С-окрашивание — от англ. constitutive), теломерного района (Т-окрашивание) и района ядрышкового организатора (NOR-окрашивание — от англ. nucleolus organizing region). Размеры и положение С-полос уникальны для каждой хромосомы, но преимущественно они включают центромерныи район и используются при исследовании хромосомных транслокаций, вовлекающих центромерные районы хромосом.
Цитогенетический анализ опухолевых клеток затруднен в связи с неясной морфологией хромосом и слабой различимостью полос. Если в исследование взяты наиболее удобные для анализа метафазные пластинки, образец может быть ошибочно охарактеризован как цитогенетически нормальный.
С развитием методов рекомбинантной ДНК стало возможным использование гибридизации in situ для определения местоположения на хромосомах или в клеточном ядре любой ДНК- и РНК-последовательности. С ее помощью можно изучать и диагностировать онкологические и наследственные генетические болезни. Молекулярная гибридизация in situ является важным инструментом цитогенетических исследований, позволяет выявлять хромосомные перестройки, идентифицировать маркерные хромосомы, проводить быстрое кариотипирование клеточных линий. Важно, что подобный анализ можно проводить не только на метафазных хромосомах, но и на интерфазных ядрах.
Несмотря на многоцелевое использование молекулярной гибридизации ДНК-ДНК (РНК) in situ, все модификации метода выполняются в соответствии с общими принципами. Существуют несколько вариантов, которые включают в себя несколько этапов: подготовка и мечение ДНК (РНК)-зонда, приготовление препаратов хромосом, собственно гибридизация, детекция гибридных молекул.
В 1980-х годах цитогенетическая методология обогатилась молекулярно-цитогенетическим методом, называемым флюоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), который вскоре стал наиболее популярным. Суть этого метода заключается в гибридизации ДНК-зондов к специфическим последовательностям ДНК, меченных флюорохромами, с метафазными или интерфазными хромосомами, которые визуализируются флюоресцентной микроскопией. Определение нуклеотидной последовательности методом FISH выполняется непрямым способом, путем гибридизации синтетического олигонуклеотида (зонда) с анализируемой ДНК (называемой также матричной ДНК или ДНК-мишенью).
Если зонд синтезирован с включением флюоресцентных или антигенных молекул, которые распознаются флюоресцирующими антителами, становится возможной визуализация относительного положения зонда на анализируемой ДНК.
Флюорохром может быть связан с ДНК ковалентно (прямое мечение) или посредством иммуноцитохимических реакций, когда ДНК-зонд метят гаптеном (биотин, дигоксигенин), а флюорохром связан с алкалоидом авидином (стрептавидином), обладающим сильным сродством к биотину (или с антителами против биотина или дигоксигенина). При использовании гаптенов возможна амплификация флюоресцентного сигнала с помощью биотинилированных антител к авидину и вторичных антител, специфичных предыдущему слою антител и окрашенных флюорохромом.
Метод FISH предназначен для выявления:
1) гибридных клеток;
2) транслокаций и других, в том числе числовых, хромосомных аномалий;
3) меченых хромосом в интерфазных и метафазных клетках.
Высококонтрастная флюоресцентная гибридизация достигается благодаря использованию флюоресцентных красителей разного цвета. С помощью двуцветной FISH выявляются тонкие структурные аномалии, например хромосомные транслокации, в том числе и неразличимые при дифференциальном окрашивании.
В настоящее время возможно выполнение многоцветной гибридизации in situ для одновременного окрашивания всех хромосом в сложном кариотипе с множественными числовыми и структурными аномалиями. Комбинация разных модифицирующих агентов и флюорохромных красителей позволяет одновременно выявлять несколько последовательностей ДНК в одном ядре (флюоресцеин дает зеленую флюоресценцию, техасский красный и родамин — красную, гидроксикумарин — голубую и т. д.). Сочетание пяти флюорохромов в разных пропорциях и компьютерный анализ изображений позволяет одновременно окрасить разным цветом все хромосомы и визуализировать 27 различных ДНК-зондов, которые служат уникальной меткой для каждой хромосомы. Эта методика называется многоцветной FISH (multicolor, или multiplex, fluorescence in situ hybridization, M-FISH).
Значение цитогенетических методов неодинаково при разных онкогематологических заболеваниях. Миелоидные клетки обычно легко кариотипируются при дифференциальном окрашивании, и FISH лишь подтверждает результаты рутинной цитогенетики. Лимфоидные клетки у больных хроническим лимфолейкозом и, особенно, множественной миеломой кариотипировать значительно сложнее из-за низкого уровня пролиферации (даже при использовании В-клеточных митогенов). В этом случае FISH демонстрирует в несколько раз большую частоту анеуплоидии, чем обычные цитогенетические методики.
Клиническое значение цитогенетических исследований
Диагноз. Потомство клетки с приобретенной цитогенетической аномалией может иметь пролиферативное преимущество и давать начало клону — клеточной популяции, происходящей от одной клетки-предшественницы. Обнаружение клональных хромосомных аномалий способствует постановке диагноза клонального поражения костного мозга. Например, цитогенетический анализ позволяет установить диагноз миелодиспластического синдрома у пациентов с умеренной цитопенией или при наличии в аспирате костного мозга минимально выраженных качественных нарушений гемопоэза.
Присутствие специфических хромосомных аномалий помогает выделить подгруппы пациентов, которым требуется специфическая терапия. Например, транслокация t(15;17)(q22;qll-21) подтверждает диагноз острого промиелоцитарного лейкоза (ОМЛ — МЗ), в комплексном лечении которого используется ретиноевая кислота.
Прогноз. Результаты цитогенетического анализа имеют не только диагностическое, но и прогностическое значение. Например, обнаружение множественных хромосомных аномалий у больных острыми лейкозами до начала лечения является прогностически неблагоприятным и служит основанием для выполнения трансплантации костного мозга или стволовых клеток периферической крови в первой полной ремиссии.
Контроль результатов лечения. Цитогенетический анализ костного мозга пациентов после проведенного лечения помогает контролировать степень элиминации опухолевого клона и, следовательно, полноту ремиссии. Выявление хромосомных аномалий, характерных для опухолевых клеток данного пациента, является ранним признаком, свидетельствующим о приближающемся рецидиве.
Цитогенетический анализ имеет большое значение в диагностике и лечении гематологических заболеваний, которое все возрастает по мере совершенствования методологии и накопления знаний об этиологической и патогенетической роли хромосомных аномалий в развитии этих болезней.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое ДНК, и из чего она состоит? Кто и когда открыл эту молекулу в клетках человека и других живых организмов? Чем уникален открытый учеными механизм наследования, и какие последствия ждал весь мир после этого открытия? Всю необходимую информацию Вы можете узнать, прочитав эту статью.

Иоганнес Фридрих Фишер – врач и биолог-исследователь родом из Швейцарии, стал первым в мире ученым, выделившим нуклеиновую кислоту. Открытие случилось в 1869 году, когда он занимался изучением животных клеток, а именно лейкоцитов, которых много содержалось в гное. Совершенно случайно молодой ученый заметил, что при отмывании лейкоцитов с гнойных повязок от них остается загадочное соединение. Под микроскопом Иоганн обнаружил, что оно содержится в ядрах клеток. Это соединение Мишер назвал нуклеином, а в процессе изучения его свойств переименовал в нуклеиновую кислоту, из-за наличия свойств, как у кислот.
Роль и функции только открытой нуклеиновой кислоты были неизвестны. Однако многие ученые того времени уже высказывали свои теории и предположения о существовании механизмов наследования.
Нынешние взгляды на состав молекулы ДНК ассоциируются у людей с именами английских ученых Джорджа Уотсона и Фрэнсиса Крика, которые открыли структуру данной молекулы в 1953 году. За несколько лет до этого, в тридцатые годы, ученые из советского союза А.Н. Белозерский и А.Р. Кезеля доказали наличие ДНК в клетках во всех живых организмах, тем самым они опровергли теорию о том, что молекула ДНК находится только в клетках животных, а в клетках растений присутствует только РНК. Лишь спустя несколько лет, в 1944 году, группой освальдских ученых было установлено, что молекула ДНК является механизмом сохранения наследственной информации клетки. Таким образом, благодаря совместным усилиям и трудам исследователей человечество познало тайну процесса эволюции и его основных принципов.
ДНК в медицине
Открытие состава молекулы дезоксирибонуклеиновой кислоты позволило перейти медицине на новый уровень развития. Появилось большое количество новых направлений практической медицины, стали доступны новые методы лечения, диагностики. Благодаря этому фундаментальному открытию для науки и современным технологиям, человечеству стали доступны:
- Возможность поставить диагноз на ранней стадии заболевания, когда оно еще находится в скрытом периоде, и никаких симптомов не проявляется. у человека.
- Тесты на наличие у человека аллергии или непереносимости некоторых пищевых продуктов. Индивидуальные исследования помогут выявить, какая пища хорошо усваивается организмом, а какая плохо или вообще не усваивается, и что может стать причиной аллергической реакции у исследуемого. Возможность узнать, какие этносы формируют Вашу внешность, и из каких народов были Ваши далекие предки
- Тест на наличие врожденных заболеваний, передающиеся через поколения, оценка риска их возникновения у тестируемого человека.
И это еще не все доступные для людей услуги, которые может предложить медицина, изучающая генетику. Выше были представлены только самые популярные среди людей тесты. Перспективой для многих ученых-генетиков является создание таких лекарств, способных победить все болезни на Земле и даже смертность.
Строение молекулы ДНК
Молекула ДНК состоит из органических соединений - нуклеотидов, которые скручиваются в две спиралевидные цепи. Нуклеотиды в этих цепях – это базовые элементы, с помощью которых потом будут кодироваться и выстраиваться гены. В составе одного гена возможны несколько вариантов расположения некоторых нуклеотидов, поэтому вместе с тем, как меняется структура гена, меняется и его функциональность.
От цепочки к хромосоме
В каждом живом организме находится миллионы клеток, а внутри этих клеток находится ядро. Клетки, содержащие в себе ядро, называются эукариотами или ядерными. У древних одноклеточных нет оформленного ядра. К таким безъядерным одноклеточным, или прокариотам, относятся бактерии и археи, например, кишечная палочка или серая анаэробная бактерия. Также ядро отсутствует в клетках вирусов и вироидов, однако причисление вирусов к живым организмам – вопрос спорный, о котором по сей день дискуссируют ученые.
В ядре находятся хромосомы – структурный элемент, в котором содержится молекула ДНК в виде спирали, хранящая внутри себя всю генетическую информацию клетки.
Процесс упаковки ДНК спиралей
Количество нуклеотидов в ДНК велико, и нужны длинные цепочки, чтобы вместить все их число, поэтому нити ДНК закручиваются в две спирали, что позволяет укоротить цепочки в 5 раз, сделав их более компактными. Нити ДНК могут также закручиваться в форму суперспирали. Двойная спираль пересекает свою ось и накручивается на специальные гистоновые белки – гиразы, образуя при этом супервитки. Таким образом, двойная спираль закручивается в спираль более высокого порядка. Сокращение цепочек в этом случае произойдет в 30 раз.
Как гены связаны с ДНК
Ген – самый изученный на сегодняшний день участок ДНК. Гены являются структурной единицей наследственности всех живых организмов. Цепочки нуклеотидов в ДНК состоят из генов, которые определяют генотип особи, например, цвет и разрез глаз, тип кожи, рост, группу и резус фактор крови и другие физиологические качества и особенности внешности.
Еще много отраслей генетики до конца не изучены, и до конца не раскрыты все функции генома, но ученые до сих пор продолжают изучение генов, чтобы добиться новых открытий в области генетики.
Хромосома: определение и описание

Хромосомы – структурный элемент клетки, находящийся внутри ядра. Они содержат в себе молекулы ДНК, в которых содержится вся наследственная информация.
Строение и виды хромосом:
Отсюда возникают различные типы хромосом:
- Равноплечая – центромера перетягивает хроматиды точно посередине;
- Неравноплечая – центромера неточно перетягивает хроматиды, из-за чего одно плечо хромосомы будет длиннее, а другое – короче. К этому типу относится Y-хромосома;
- Палочковидная – центромера перетягивает хроматиды практически на их концах, из-за чего по форме хромосома напоминает палочку;
- Точковые – очень мелкие хромосомы, форму которых трудно определить. В науке существуют 3 основные формы хромосом:
- Х-хромосома, встречающаяся у особей женского и мужского пола;
- Y-хромосома, встречающаяся только у мужских особей;
- В-хромосома, которая очень редко встречается в клетках растений. Обычно их число доходит до 6, редко – до 12. Ее наличие обуславливает различные болезни и побочные эффекты в организме
Всего в клетке человека находится 46 хромосом: 22 пары аутосом, встречающиеся у обоих полов, и одна пара половых хромосом: XY – у мужчин, XX – у женщин. Забавно, что если прибавить к количеству хромосом хотя бы одну пару, то человек мог бы быть шимпанзе или тараканом, а если отнять, то – кроликом.
Еще интересно то, что человек и ясень имеют одинаковое количество хромосом, несмотря на принадлежность к разным видам и царствам.
Генетический код – система записи генетической информации в ДНК и РНК в виде определенной последовательности в цепочке нуклеотидов. Он должен сохранять наследственную информацию в первоначальном виде, восстанавливая повреждения цепочки в последующем поколении с помощью ДНК. Однако ген может каким-то образом быть поврежден, либо в нем может произойти мутация.
Генные мутации – изменение в последовательности нуклеотидов, например выпадение, замена, вставка другого нуклеотида в цепочку. Последствия этих мутаций могут быть полезные, вредные или нейтральные. Примером полезных мутаций является устойчивость к минусовым температурам, увеличенная плотность костей, меньшая потребность во сне, устойчивость к ВИЧ и другие. Примером вредных мутаций является аллергия на солнечный свет, глухота слепота и так далее. К нейтральным мутациям относятся те мутации, которые не влияют на жизнеспособность, например, гетерохромия.
Существуют также летальные и полулетальные мутации. Летальные мутации несовместимы с жизнью и приводят к гибели организма на ранних этапах его развития, например, при рождении у особи отсутствует головной мозг. Полулетальные мутации не приводят к смерти особи, но значительно уменьшают ее жизнеспособность. К таким мутациям относятся заболевания человека, передающиеся по наследству. Например, наличие 47-й хромосомы может вызвать у человека синдром Дауна, а, наоборот, отсутствие 46-й парной хромосомы – сидром Шерешевского-Тернера.
Расшифровка цепочки ДНК
Расшифровка цепочки ДНК в клетке – это исследование всех известных генов в клетках человека. Хоть цена за такую услугу значительно упала за последние десять лет, однако такое исследование по-прежнему остается дорогим удовольствием, и не каждый человек сможет позволить себе оплатить такую услугу. Чтобы уменьшить цену этого исследования, расшифровку ДНК стали делить по тематикам. Таким образом, появились различные тесты, которые исследуют интересующую человека группу генов и ее функции.
Как происходит расшифровка цепочки ДНК?
- Взятые на пробу образцы ДНК нагревают, чтобы двойная спираль раскрутилась и распалась на две нити.
- К интересующему участку цепочки генов прилепляется полимераза - фермент, синтезирующий полимеры нуклеиновых кислот. Процедура проходит при низких температурах.
- С помощью полимеразы в интересующих участков происходит синтезов генов, необходимых для изучения.
- Участки пропитывают светящейся краской, которая светится при лазерном воздействии.
Таким образом, ученые получают картину гена, которую можно изучить и расшифровать. Синтез РНК Нуклеотиды делятся на четыре базовых элемента, служащими основой для формирования генов: АТГЦ, или аденин, тимин, гуанин, цитозин. В их состав входят фосфорные остатки, азотистые основания и пептоза.
В ДНК эти нуклеотиды располагаются строго по парам параллельно друг другу строгими парами: аденин - с тимином, гуанин - с цитозином.
Важно, что молекула дезоксирибонуклеиновой кислоты не должна выходить за пределы мембраны ядра. С помощью РНК, которая играет роль копии участка цепи с генетическим кодом, генетическая цепочка может покинуть ядро, попасть вовнутрь клетки и воздействовать на ее внутренние процессы.
Как это происходит:
- Один конец генной спирали раскручивается, формируя две развернутые нити с цепочкой генов.
- К развернутому участку спирали подходит специальный фермент-строитель и поверх этого участка синтезирует его копию.
- У копии в структуре нуклеотидов тимин во всех парах заменяется на урацил, что позволяет копии генетической цепи покинуть ядро клетки. Синтез белка при помощи генов Основное взаимодействие, происходящее между генами и клеткой, состоит в том, что различные гены могут заставлять клетку производить синтез разных белков с самыми непредсказуемыми свойствами.
Итак, группа генов, участвующих в процессе старения клеток может, как заставить процесс старения идти быстрее, так и вовсе его остановить и запустить процесс омолаживания. То есть, каждый из генов может спровоцировать синтез нескольких видов белка.

Сутягина Дарья Сергеевна
Эксперт-генетик
В нашей ДНК содержится очень много информации, но пока мы можем расшифровать лишь небольшой процент генов. Добавлю несколько интересных фактов о ДНК: возможность двойной ДНК у человека. Такое явление случается, когда при беременности в утробе развиваются близнецы, но в процессе развития плода они сливаются в одного человека. Длина одной молекулы ДНК человека равна 2 метрам, а общая длина цепочки ДНК всех клеток тела человека равна 16 млрд. километрам, что равно расстоянию от Земли до Плутона. ДНК человека и кенгуру всего лишь 150 млн. лет назад были одинаковыми. Все знания и информация во всем мире могла бы уместиться всего лишь в 2 граммах дезоксирибонуклеиновой кислоты.
Читайте также:

