Как приготовить бактериальную петлю кратко
Обновлено: 02.07.2024
Микроорганизмы в лабораторных условиях выращивают обычно в пробирках, чашках Петри, на жидких или плотных питательных средах.
При пересеве микроорганизмов с одной среды на другую или при извлечении части клеток для приготовления микропрепарата необходимо строго соблюдать условия, которые позволили бы предохранить культуру от загрязнения другими микроорганизмами, а также персонал от инфицирования микроорганизмами, находящимися в исследуемом материале.
Для приготовления препарата микроорганизмов, выращенных на поверхности плотной питательной среды, или для пересева культуры с одной среды на другую пользуются бактериологической петлей.
Петля представляет собой тонкую проволоку из платины или нихрома, прикрепленную к держателю из металла. Конец проволоки загибают в виде кольца диаметром около 2 мм, которым и захватывают небольшое количество микробной массы.
Но прежде, чем такая петля будет введена в пробирку, колбу или чашку Петри с культурой, ее необходимо простерилизовать, т.е уничтожить имеющиеся на ней микроорганизмы. Стерилизацию бактериологической петли проводят в пламени горелки так, чтобы проволока была равномерно раскалена на всем протяжении. Лишь после такой стерилизиции петлю можно вводить в пробирку с культурой микроорганизмов.
Прикосновение к культуре слишком горячей петли может повредить клетки, поэтому петлю следует предварительно остудить, прикоснувшись ею к внутренней поверхности пробирки или к питательной среде, свободной от микробных клеток.
Извлечение микроорганизмов из пробирки для приготовления препарата или для пересева в иную среду производится следующим образом.
Пробирку с культурой берут в левую руку так, чтобы была хорошо видна вся поверхность питательной среды с выросшими на ней микроорганизмами. Пробирка должна находиться в слегка наклонном положении. Петлю для пересева берут в правую руку и держат ее так, как держат ложку во время еды (для тех, у кого рабочей рукой является левая, работа проводится в зеркальном отражении к правой руке). Не выпуская петли, открывают пробирку, из которой берется культура. Делают это так: мизинцем и безымянным пальцами правой руки прижимают пробку к ладони и вынимают ее из пробирки. Пробку, прижатую к ладони пальцами, держат на протяжении всей последующей манипуляции. Класть ее на стол ни в коем случае нельзя, чтобы не загрязнить микрофлорой окружающей среды, через нее и культуру в пробирке, а также с целью, чтобы микробы, находящиеся в пробирке, не заразили окружающую среду и тех, кто с ними работает.
После того как пробка вынута из пробирки, края открытой пробирки с культурой обжигаются в пламени горелки и только после этого стерильную петлю вводят в пробирку.
Взяв небольшое количество микробной массы с поверхности субстрата, петлю вынимают из пробирки, следя за тем, чтобы переносимый материал не касался стенок или краев пробирки. Края пробирки снова обжигают в пламени горелки, затем обжигают пробку и закрывают нею пробирку. Если конец пробки загорится, ее нужно быстро внести в пробирку, где пробка потухнет из – за недостачи кислорода.
Закрытую пробкой пробирку с культурой ставят в штатив, а извлеченный материал используют для приготовления микропрепарата или для пересева культуры в свежую среду.
Если пересевают на скошенную агаризованную среду, то петлю вводят в пробирку до нижней части питательной среды в капельку конденсационной воды и, слегка касаясь петлей поверхности среды, штрихообразными движениями поднимают петлю вверх. Посев следует делать так, чтобы не повредить поверхности питательной среды. При пересеве на жидкие среды (в колбу или пробирку) петлю с микробной массой погружают непосредственно в среду.
Оставшиеся на петле после пересева или приготовления микропрепарата клетки микроорганизмов тщательно сжигают в пламени горелки. Прокаливание петли начинают с участка проволоки, примыкающего к кольцу, для того, чтобы микробная масса, оставшаяся на петле, подсохла. Затем петлю переводят в вертикальное положение и прокаливают докрасна. Только после этого петлю можно положить на место.
Когда нужно приготовить препарат или произвести пересев культуры микроорганизмов, выросших в жидкой питательной среде, лучше пользоваться не петлей, а применять стерильную пипетку.
Пипетку за верхний конец вынимают из бумаги или пенала, в которых она стерилизовалась, и вводят в пробирку или в колбу с культурой, соблюдая все предосторожности, описанные выше. Отбор жидкой культуры пипеткой можно производить с помощью резиновой груши. Использованную пипетку следует немедленной поставить в сосуд с дезинфицирующим раствором, не касаясь ею окружающих предметов.
При посеве материала в чашку Петри крышку ее следует только приоткрывать для того, чтобы не загрязнить культуру микробами из воздуха, которые вместе с пылинками, витающими в воздухе, могут осесть на питательную среду в чашке.
Все описанные манипуляции следует проводить около пламени горелки быстро, аккуратно, внимательно, чтобы не загрязнить культуру посторонними микроорганизмами и не распространить исследуемую культуру в окружающей среде.
Во время работы нельзя производить резких движений, разговаривать и передвигаться по лаборатории.
Культуры микроорганизмов, не нужных для дальнейшей работы, следует убить. Для этого сосуды с отработанными культурами микроорганизмов (колбы, пробирки, матрацы, Чашки Петри и пр.) автоклавируют и только после этого моют.
В бактериологическая петля Это рабочий инструмент, используемый микробиологами для посева микробных культур (бактерий или грибов). Пожалуй, это инструмент, наиболее используемый профессионалами.
Его использование кажется простым, но на самом деле требует большого обучения.Перед началом посева петлю необходимо простерилизовать в горелке Бунзена, затем отбирают микробный посевной материал, который может быть получен из жидкой или твердой культуры.
После взятия посевного материала его можно поместить в жидкую среду или засеять в твердой среде. После каждой процедуры петлю снова стерилизуют. Ручка также подходит для нанесения микробных мазков на предметное стекло.
Бактериологическая петля имеет много названий, в том числе: платиновая петля или петля, посевная петля или посевная петля, однако ее настоящее название - петля Кохе.
Материал, из которого сделана ручка, - это обычно никель-хромовый сплав (нихром) или платина. Еще одна разновидность, доступная на рынке, - пластиковые одноразовые бактериологические петли.
С другой стороны, существует несколько типов бактериологических петель, каждая из которых выполняет определенную функцию в рамках задач, выполняемых микробиологом. Выбор ручки будет зависеть от того, что нужно сделать.
Например, для выполнения полосатого тела по истощению с целью выделения микроорганизма используется платиновая петля, которая заканчивается замкнутым кольцом, независимо от того, откалибрована она или нет.
Принимая во внимание, что если необходимо посеять образец мочи, где важно количественно определить КОЕ, необходимо использовать калиброванную петлю. Аналогичным образом, для инокуляции биохимических тестов, которые необходимо высеивать путем пункции, необходима петля иглы. Важно, чтобы с ручкой работал обученный персонал.
характеристики
Бактериологические петли делятся на две крайности. Один конец соответствует ручке или основанию, а другой - самой ручке.
Основание ручки или ручка
Основание служит для захвата ручки во время переноски. Обычно он металлический, но имеет теплоизолятор, чтобы предотвратить ожог оператора при стерилизации кончика ручки на зажигалке. Его размер составляет примерно 20 см, хотя он может быть длиннее. Имеет резьбу для регулировки ручки.
Ручка
Это функциональная часть, то есть часть, которая контактирует с микроорганизмами и питательными средами. Он состоит из тонкой проволоки, которая вставляется в основание.
Ручка может быть сделана из нихрома или платины, поэтому ее иногда называют платиновой ручкой. Его длина составляет примерно 6,5 см, а толщина - примерно 0,20 мм. Длина ручки с ручкой может составлять 26,5 см. Размеры могут отличаться от одного производителя к другому.
Типы
Существует несколько типов бактериологических петель, и каждый из них имеет определенное применение. Типы ручек следующие: калиброванная кольцевая ручка, не калиброванная кольцевая ручка, прямая или игольчатая ручка, лопатчатая ручка, L-образная ручка и ручка с острым концом.
С другой стороны, ручки могут быть постоянными или одноразовыми. Те, которые предназначены для постоянного использования, стерилизуются в зажигалке, они многоразовые и очень прочные. Хотя одноразовые изделия стерильны с завода, они используются только один раз и выбрасываются.
Приложения
Кольцевая ручка, не калиброванная
Это наиболее часто используемая ручка в микробиологической лаборатории. Он используется для взятия посевного материала из микробной суспензии (жидкая среда) или части колонии (твердая среда) для посева в другую культуральную среду, либо в биохимическом тесте, либо в более обогащенной или селективной среде, в зависимости от обстоятельств. Это также полезно для нанесения микробных мазков на предметное стекло.
С помощью этого типа петли можно выполнить штриховку исходного посевного материала. Он также разработан таким образом, чтобы плавно скользить по агару, не повреждая его. Конечно, для этого требуется обученный персонал, который будет владеть техникой посева, применяя правильную силу и движения для получения хорошей штриховки.
С помощью этой ручки можно выполнять различные техники посева. Например, твердые среды в чашках Петри обычно засеваются по истощению (существует несколько методов, см. Видео 1).
Этот метод предназначен для получения изолированных колоний с целью их изучения и идентификации, особенно если образец является полимикробным, то есть культура не является чистой (она содержит более одного типа микроорганизмов).
Вместо этого клинья высаживают простым зигзагом для получения бактериальной массы, в этом случае нет необходимости изолировать колонии.
Иногда их также используют для взятия определенных проб. Например, Рохас и др. Использовали бактериологическую петлю для сбора образцов вагинальной ткани соскобов у крыс.
Ручка кольцевая, калиброванная
Эта ручка, как следует из ее названия, откалибрована для приема определенного количества микробной суспензии. Его используют, когда необходимо, чтобы посевной материал соответствовал стандартам в данной области.
Например, очень распространен посев мочи. В этом случае можно использовать калиброванную петлю 0,01 мл и петлю 0,001 мл.
Следует отметить, что калиброванные ручки имеют предел погрешности, который варьируется в зависимости от угла, под которым отбирается проба, и размера горловины контейнера.
Если петлю на 0,001 мл поместить в вертикальное положение в контейнер с маленькой горловиной (≤ 7 мм), взятое количество будет на 50% меньше желаемого.
Это происходит потому, что чем меньше диаметр горловины контейнера, тем выше поверхностное натяжение и, следовательно, увеличивается сила сцепления между стеклом и жидкостью. Это приводит к снижению нагрузки по жидкости на ручку.
А если взять его под углом 45 ° в емкость с широким горлышком (≥ 22 мм), можно собрать на 150% больше, чем требуется. В этом случае поверхностное натяжение ниже и силы сцепления стекла / пластика уменьшаются, в то время как сила сцепления жидкость-жидкость увеличивается.
Из-за вышесказанного для посева мочи иногда предпочтительны другие методы количественного определения колониеобразующих единиц.
Прямая или игольчатая ручка
Его еще называют ручкой резьбы. Он используется для инокуляции определенных биохимических тестов, особенно тех, которые требуют посева методом пункции. Например, полутвердые среды, приготовленные в виде блока, такие как: среда SIM, MIO и O / F.
Кроме того, в случае MIO и SIM, которые оценивают подвижность, важно, чтобы пункция выполнялась с помощью игольной петли, поскольку интерпретация положительной подвижности происходит, когда бактерии растут по направлению к сторонам исходного посевного материала.
Тест с инокулированной петлей может исказить результаты (ложноположительные). По этой причине при этом типе засева необходимо следить за тем, чтобы прокол был уникальным и чтобы при его удалении он выходил в том же направлении, в котором он вошел.
Еще один тест, который следует засеять иглой, даже если он сделан в форме клина, - это тест Kligler. В этом тесте не рекомендуется, чтобы кислород проникал в глубину агара, поскольку для протекания определенных химических реакций требуется среда с низким содержанием кислорода. Эта ручка также используется для прикосновения к определенной колонии с целью субкультивирования.
Лопатчатая ручка
Большинство микроорганизмов образуют мягкие, легко отделяемые колонии. Однако есть некоторые микробные агенты, колонии которых твердые и сухие, например, микобактерии в целом и некоторые грибы. В этих случаях полезно использовать лопатчатую ручку.
L-образная ручка
Чаще всего его используют для уничтожения грибковых культур, особенно плесени.
Ручка с острым концом
Это полезно для отбора очень маленьких колоний, присутствующих в полимикробных культурах, чтобы иметь возможность их пересеять.
Посевная техника
Видео 1
Стерилизация платиновой ручки
Ручку необходимо стерилизовать до и после использования. Чтобы стерилизовать бактериологическую петлю в зажигалке, действуйте следующим образом: ручку следует поместить в верхнюю часть пламени, приняв положение как можно более вертикальное, таким образом, чтобы стерилизовать кончик вверх.
Когда тонкая нить становится ярко-красной, можно сказать, что она стерильна. Для использования его охлаждают и отбирают выбранный образец. (Смотрите видео 2).
Приготовление нативных препаратов микроорганизмов для микроскопирования.
Теоретические пояснения:
Для работы с микроорганизмами используют бактериологические петли, иглы, шпатели. Бактериологические петли изготовляют из проволоки, которую закрепляют в специальных металлических держателях. Бактериологическая петля прокаливается, пробки и край пробирки с культурой микроорганизмов фламбируются. Если в работе используются суспензии микроорганизмов или культуры, выращенные на жидких средах, они берутся предварительно простерилизованной пипеткой, у которой широкий конец закрыт ватой. Изучают микроорганизмы, изготавливая препараты из них. Для этого применяют чистые, хорошо обезжиренные стекла, на поверхности которых капля воды свободно растекается. С этой целью промытые и высушенные стекла натирают хозяйственным мылом, увлажняют дыханием и протирают салфеткой. При микроскопировании можно использовать культуры, выращенные в жидких средах. Культуры, выращенные на твердых средах, можно суспендировать (развести) с помощью стерильной петли или иглы в капле стерильной жидкой среды или какого-нибудь раствора до слабого помутнения. В зависимости от цели исследования готовят прижизненные или фиксированные препараты.
Цель работы: изучить методы приготовления прижизненных микропрепаратов (раздавленная капля, висячая капля).
Материалы и оборудование: Предметные и покровные стёкла, предметные стёкла с углублениями, микробиологические петли, пипетки, культура микроорганизмов в пробирке, микроскопы, иммерсионное масло.
Ход работы:
1. Приготовить нативный микропрепарат методом раздавленной капли.
- приготовить предметное и покровное стекла и зажечь спиртовку;
- взять пробирку со стерильной водой в левую руку и поместить её наклонно между большим и указательным пальцем на расстоянии 3–5 см от пламени;
- в правую руку взять петлю, простерилизовать ее в пламени спиртовки, включая часть петледержателя, которая при работе помещается в пробирку;
- мизинцем правой руки зажать пробку пробирки, повернуть, вынуть ее и держать, не касаясь окружающих предметов;
- обжечь края пробирки и взять петлей каплю воды, поместить её на предметное стекло;
- обжечь края пробирки и пробку, закрыть пробирку и поставить в штатив;
- открыть пробирку с культурой так же, как в п. 4;
- стерильную петлю ввести в пробирку с культурой, охладить, прикоснувшись к внутренней поверхности пробирки, а затем взять ею небольшое количество микроорганизмов;
- петлей с микроорганизмами сделать штрих на стекле внутри капли воды. После этого петлю прожечь и охладить, прикоснувшись к стеклу;
- растереть штрих петлей круговыми движениями, чтобы получилась слегка опалесцирущая суспензия и накрыть покровным стеклом. Чтобы не образовывалось пузырьков воздуха, покровное стекло подводят ребром к краю капли и резко опускают его.
2. Приготовить микропрепарат методом висячей капли.
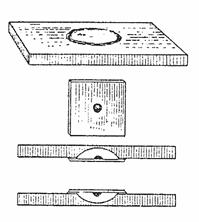
- Для приготовления препарата необходимы стекло с лункой, покровное стекло и вазелин. Края лунки покрывают тонким слоем вазелина. На покровное стекло наносят каплю культуры (Рис. 2).
- Накрывают покровное стекло стеклом с лункой так, чтобы капля оказалась в центре.
- Склеившиеся стёкла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время.
3. Исследовать препараты под микроскопом.
4. Зарисовать и сделать вывод о подвижности микроорганизмов.
Вопросы для самоконтроля:
2. Какая посуда используется для выращивания микроорганизмов?
3. Как правильно держать пробирку с микроорганизмами и петлю?
4. Какие свойства микроорганизмов исследуются на прижизненных и
Приготовление нативных препаратов микроорганизмов для микроскопирования.
Теоретические пояснения:
Для работы с микроорганизмами используют бактериологические петли, иглы, шпатели. Бактериологические петли изготовляют из проволоки, которую закрепляют в специальных металлических держателях. Бактериологическая петля прокаливается, пробки и край пробирки с культурой микроорганизмов фламбируются. Если в работе используются суспензии микроорганизмов или культуры, выращенные на жидких средах, они берутся предварительно простерилизованной пипеткой, у которой широкий конец закрыт ватой. Изучают микроорганизмы, изготавливая препараты из них. Для этого применяют чистые, хорошо обезжиренные стекла, на поверхности которых капля воды свободно растекается. С этой целью промытые и высушенные стекла натирают хозяйственным мылом, увлажняют дыханием и протирают салфеткой. При микроскопировании можно использовать культуры, выращенные в жидких средах. Культуры, выращенные на твердых средах, можно суспендировать (развести) с помощью стерильной петли или иглы в капле стерильной жидкой среды или какого-нибудь раствора до слабого помутнения. В зависимости от цели исследования готовят прижизненные или фиксированные препараты.

Цель работы: изучить методы приготовления прижизненных микропрепаратов (раздавленная капля, висячая капля).
Материалы и оборудование: Предметные и покровные стёкла, предметные стёкла с углублениями, микробиологические петли, пипетки, культура микроорганизмов в пробирке, микроскопы, иммерсионное масло.
Ход работы:
1. Приготовить нативный микропрепарат методом раздавленной капли.
- приготовить предметное и покровное стекла и зажечь спиртовку;
- взять пробирку со стерильной водой в левую руку и поместить её наклонно между большим и указательным пальцем на расстоянии 3–5 см от пламени;
- в правую руку взять петлю, простерилизовать ее в пламени спиртовки, включая часть петледержателя, которая при работе помещается в пробирку;
- мизинцем правой руки зажать пробку пробирки, повернуть, вынуть ее и держать, не касаясь окружающих предметов;
- обжечь края пробирки и взять петлей каплю воды, поместить её на предметное стекло;
- обжечь края пробирки и пробку, закрыть пробирку и поставить в штатив;
- открыть пробирку с культурой так же, как в п. 4;
- стерильную петлю ввести в пробирку с культурой, охладить, прикоснувшись к внутренней поверхности пробирки, а затем взять ею небольшое количество микроорганизмов;
- петлей с микроорганизмами сделать штрих на стекле внутри капли воды. После этого петлю прожечь и охладить, прикоснувшись к стеклу;

- растереть штрих петлей круговыми движениями, чтобы получилась слегка опалесцирущая суспензия и накрыть покровным стеклом. Чтобы не образовывалось пузырьков воздуха, покровное стекло подводят ребром к краю капли и резко опускают его.
2. Приготовить микропрепарат методом висячей капли.
- Для приготовления препарата необходимы стекло с лункой, покровное стекло и вазелин. Края лунки покрывают тонким слоем вазелина. На покровное стекло наносят каплю культуры (Рис. 2).
- Накрывают покровное стекло стеклом с лункой так, чтобы капля оказалась в центре.
- Склеившиеся стёкла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время.
3. Исследовать препараты под микроскопом.
4. Зарисовать и сделать вывод о подвижности микроорганизмов.
Вопросы для самоконтроля:
8.1. Техника посева и выделения чистых культур микроорганизмов
Доставляемый в лабораторию материал подвергают бактериологическому исследованию в тот же день. Техника посева зависит от характера засеваемого материала, консистенции питательной среды и цели исследования.
Для проведения посевов необходимы: подлежащий исследованию материал, питательные среды, бактериологическая петля, шпатели (стеклянные, металлические), пастеровские и градуированные пипетки, металлические кюветы или поднос для переноса засеянных чашек и металлические коробки для переноса пробирок, ведро или бачок с крышками для сброса отработанного инфицированного материала, спиртовая или газовая горелка.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку – "зеркало". Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериологической петлей.
Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю перед взятием материала прокаливают в пламени горелки, затем ее остужают так, чтобы при соприкосновении с жидкой средой она не вызывала кипения жидкости, а прикосновение к агару не сопровождалось его плавлением. Для остуживания петли лучше всего погружать ее в конденсационную жидкость пробирки со стерильной питательной средой или прикасаться к крышке чашки Петри со стерильной средой. Нельзя остужать петлю прикосновением к поверхности питательной среды, даже свободной от микробного роста, так как на ней могут находиться колонии, не видимые простым глазом.
После окончания посева петлю прожигают повторно для уничтожения находящейся в ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, использованные для посевов, опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках – в верхней трети надписывают название засеянного материала или ставят номер анализа и дату посевов.
8.1.1. Техника посевов на плотные и жидкие питательные среды
- При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.
- При посеве на скошенный мясопептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой IV и V пальцами, не прикасаясь к той ее части, которая входит внутрь пробирки. Остальные три пальца правой руки остаются свободными для взятия бактериологической петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
При посеве на скошенный агар петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрихи снизу вверх от одной стенки пробирки к другой (рис. 8.1).
- • При посеве на поверхность плотной питательной среды из пробирки в чашки Петри пробирку фиксируют II, III и V пальцами левой руки, а крышку чашки Петри приоткрывают I и IV пальцами левой руки настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель (рис. 8.2). Небольшое количество исследуемого материала, взятого из пробирки бактериологической петлей, втирают в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериологическую петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхность, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на 4, 8 или 16 равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микробов в концевой ее части.
- • Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
- Для посева материала в толщу плотной питательной среды готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1–1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15–20 мл мясопептонного агара, расплавленного и остуженного до температуры 40– 45 "С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
- Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
- Калиброванной бактериологической петлей (диаметр 2 мм, емкость 0,005 мл) производят посев мочи на сектор А чашки Петри с простым агаром, сделав около 40 штрихов. Затем петлю прожигают и производят 4 штриховых посева из сектора А в сектор I, из сектора I в сектор II и из сектора II в сектор III, каждый раз после прожигания петли (рис. 8.3).
Чашки инкубируют при температуре 37 °С в течение 18– 24 ч, после чего подсчитывают количество колоний, выросших в разных секторах, и определяют количество бактерий в 1,0 мл по приведенной табл. 8.1 (этот метод принят для определения степени бактериурии).
Таблица 8.1. Определение количества бактерий в 1 мл методом секторных посевов*
Количество колоний в секторах
Количество бактерий в 1 мл
*Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений" (Москва, 1985).
8.1.2. Методы выделения чистых культур
Чистой культурой принято называть совокупность однородных микроорганизмов, относящихся к одному виду, полученных из массы одной колонии, клетки которой идентичны по морфологическим, тинкториальным, культуральным, метаболическим и генетическим признакам, так как по существующим представлениям микробная колония является популяцией бактериальных клеток, возникшей в результате размножения единственной материнской клетки. Микробная колония являются аналогом клона.
Чистые культуры микроорганизмов одного вида, выделенные из различных источников, могут отличаться друг от друга незначительным отклонением морфологических, культуральных или биохимических признаков, не выходя за пределы своего вида или подвида. Такие культуры называют штаммами. Вместо ранее именованных типов в зависимости от характера изменившегося признака их обозначают морфоварами (отличные по морфологическим признакам), сероварами (имеющие антигенные отличия), биоварами (отличающиеся биологическими свойствами).
Чистая культура необходима для изучения морфологических, культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды. Очень широко применяются селективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить. Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споровых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине среды (по Коху). Три пробирки, содержащие по 15 мл мясопептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43–45 °С. В пробирку вносят одну бактериологическую петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого одну петлю (прокаленную и остуженную) содержимого 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.
После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского. Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливного роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во 2-ю, а затем и 3-ю чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 90°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся в петле, расходуется постепенно, и по линиям штрихов, нанесенных в конце посева, вырастают изолированные колонии микробов.
Выращивание и выделение чистых культур анаэробов. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых для выращивания анаэробов, служит пониженное содержание в них свободного кислорода. Самым простым способом удаления растворенного кислорода является кипячение. Непосредственно перед посевом материала пробирки с питательными Средами кипятят на водяной бане в течение 10–20 мин. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежепрокипяченную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1–1,5 см). Засев среды производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глутатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта – Тароцци (рецепт 161), широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физические способы культивирования анаэробов:
- • способ Виньяля – Вейона. Берут 4–5 пробирок с 0,5 % расплавленным и охлажденным до температуры 40–45 °С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, пока их кончик не обломлен, пипетки погружают на 3–5 мин в стерильную воду с температурой 45–50 °С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2–3 сут в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микроба, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду;
- • выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микробов засевают в пробирки с жидкой средой или в чашки Петри с плотной питательной средой. Посевы помещают в анаэростат, затем присоединяют его к насосу и выкачивают воздух. Степень разреженности воздуха определяют по показаниям вакуумметра. Колонии анаэробов в вакуумных условиях растут на поверхности плотной питательной среды.
Химические методы выращивания анаэробов (метод Аристовского). Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфит натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор закрывают крышкой и помещают в термостат при температуре 37 *С на 24–48 ч.
Биологический метод выращивания анаэробов (по Фортнеру). В чашку Петри наливают толстым слоем 5 % кровяной агар с 1–2 % глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1–1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие материалом, другую половину – культурой аэробов: чудесной палочкой (Serratia marcescens) или кишечной палочкой (Escherichia coli). Перед посевом чашки подсушивают в термостате, чтобы аэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстро растущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат – прибор для выращивания микробов в анаэробных условиях – представляет собой толстостенную металлическую или пластиковую камеру с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу. Вместо кислорода в нем используются газовые смеси.
Основное требование при работе с микроорганизмами - соблюдение асептики, т. е. таких условий, при которых в пробирку с изучаемой культурой не смогли бы попасть другие микроорганизмы (например, из воздуха, с предметов, используемых в процессе выполнения работы).
Кроме того, нужно иметь в виду, что среди микроорганизмов многие условно патогенны, что требует повышенного внимания и аккуратности в работе.
Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели. Бактериологические петли изготовляют из проволоки, которую закрепляют в специальных металлических держателях или впаивают в стеклянные палочки. Толщина игл и петель не должна превышать 0,5 мм (рис. 10).

Рис. 10. Бактериологическая петля (1) и шпатель Дригальского (2)
Выращивают микроорганизмы в стеклянной посуде: пробирках, колбах или чашках Петри. В пробирках микроорганизмы культивируют как в жидких, так и на плотных средах. Пробирки со средами и культурами при работе следует устанавливать на штативах.
Бактериологическая петля прокаливается, пробки и край пробирки фламбируются. Если в работе используются суспензии микроорганизмов или культуры, выращенные на жидких средах, они берутся предварительно простерилизованной пипеткой, у которой широкий конец закрыт ватой. Такие пипетки стерилизуются и хранятся завернутыми в бумагу (каждая отдельно).
Изучают микроорганизмы, изготавливая препараты из них. Для этого применяют чистые, хорошо обезжиренные стекла, на поверхности которых капля воды свободно растекается. С этой целью промытые и высушенные стекла натирают хозяйственным мылом, увлажняют дыханием и протирают салфеткой.
При микроскопировании можно использовать культуры, выращенные в жидких средах. Культуры, выращенные на твердых средах, можно суспендировать (развести) с помощью стерильной петли или иглы в капле стерильной жидкой среды или какого-нибудь раствора, но не водопроводной воды, до слабого помутнения.
1) приготовить предметное и покровное стекла;
2) зажечь спиртовку;
3) взять пробирку со стерильной водой в левую руку и поместить её наклонно между большим и указательным пальцем на расстоянии 3-5 см от пламени;
4) в правую руку взять петлю простерилизовать ее в пламени спиртовки, включая часть петледержателя, которая при работе помещается в пробирку;
5) мизинцем правой руки зажать пробку пробирки, повернуть, вынуть ее и держать, не касаясь окружающих предметов;
6) обжечь края пробирки и взять петлей каплю воды, поместить её на предметное стекло;
7) обжечь края пробирки и пробку. Закрыть пробирку и поставить в штатив;
8) прожечь петлю;
9) открыть пробирку с культурой так же, как в п.5;
10) стерильную петлю ввести в пробирку с культурой, охладить, прикоснувшись к внутренней поверхности пробирки, а затем взять ею небольшое количество микроорганизмов;
11) петлей с микроорганизмами сделать штрих на стекле внутри капли воды. После этого петлю прожечь и охладить, прикоснувшись к стеклу;
12) растереть штрих петлей круговыми движениями, чтобы получилась слегка опалесцирущая суспензия;
13) петлю прожечь;
14) полученную суспензию микроорганизмов накрыть покровным стеклом и микроскопировать.
Чтобы избежать в поле зрения пузырьков воздуха, нужно, расположив покровное стекло под углом 40-45°, прикоснуться им к краю капли и, когда она распределится вдоль грани, осторожно накрыть каплю.
Препарат можно подкрасить метиленовым синим (в концентрации 0,010,001), капнув непосредственно в препарат или поместив каплю красителя у края покровного отекла, с противоположное стороны полоску фильтровальной бумаги.
При изготовлении препарата нужно учитывать размер капли, который должен быть равен приблизительно объему двух рисовых зерен.
Маленькая капля быстро высыхает, при большой - покровное стекло плавает на поверхности капли, что мешает качественному изображению объекта при микро- скопировании.
Висячая капля. На середину необезжиренного покровного стекла наносят очень маленькую, с четкими краями каплю суспензии микроорганизмов, как описано выше. Каплю материала покрывают предметным стеклом с лункой, края которой предварительно смазывают вазелином. Предметное стекло с прилипшим к нему покровным стеклом переворачивают. Капля оказывается висячей в герметически закрытой влажной камере, из которой жидкость испаряется очень медленно и поэтому препарат долгое время остается пригодным для наблюдения. Висячую каплю микроскопируют с плоским зеркалом и суженной диафрагмой.
Фиксированный (постоянный) препарат готовят следующим образом:
1) приготовить суспензию микроорганизмов методом, аналогичным вышеописанному;
2) с помощью стерильной бактериологической петли распределить суспензию тонким слоем на поверхности предметного стекле в виде пятна диаметром около 1 см;
3) высушить мазок на воздухе;
4) фиксировать мазок в пламени спиртовки. Для этого препарат три раза проводят в средней части пламени спиртовки. При этом микроорганизмы погибают, хорошо прикрепляются к стеклу, становятся более восприимчивыми к красителю. Можно вместо термической проводить химическую фиксацию, предусматривающую применение средств, вызывающих коагуляцию белков. В этом случае она осуществляется с помощью определенных химических веществ (например, метиловый, этиловый спирты, формалин) или различных смесей (например, уксусная кислота, абсолютный этиловый спирт и хлороформ - фиксирующая смесь Карнуа).
Для микроскопического исследования приготовленные мазки, высушенные и зафиксированные, подвергают окраске. Окраска бывает простая и сложная. Простая окраска заключается в нанесении на мазок какой-либо одной краски на определенное время. Чаще всего для простой окраски применяют водно-спиртовый 1:10 фуксин, метиленовую синьку и сафранин.
При простой окраске микробные тела воспринимают цвет применяемой краски так же интенсивно, как и ядра клеток; в то же время цитоплазма и весь фон мазка (если это не мазок из чистой культуры) окрашиваются в тот же цвет, но несколько бледнее. Обычно фуксином 1:10 красят 10-30 секунд, а метиленовой синькой - 2-10 минут. Фуксин и генцианвиолет окрашивает мазки более интенсивно. А при окраске метиленовой синькой получаются нежные, более изящные препараты.
Восприятие окраски зависит не только от свойств красок, но и от свойств подвергаемых окраске микробов.
Для окраски мазков пользуются растворами красок или красящей бумагой. Простота приготовления, удобство применения, а также возможность хранения красящих бумаг в течение неограниченно долгого времени явились основанием для широкого их использования при различных способах окраски.
Читайте также:
- Что означало заявление гитлера для государств европы кратко
- Что изучает демография кратко
- Почему начальный меридиан называют гринвичским нулевым кратко
- С какими величинами производят вычисления с векторными или скалярными кратко
- Почему порты северо западного бассейна играют ведущую роль в морских перевозках кратко

