Как объяснить происхождение линейчатых спектров кратко
Обновлено: 03.07.2024
1. Как формулируются постулаты Бора?
Одним из основоположников квантовой механики был датский физик Нильс Бор.
Бор пришел к заключению, что свет излучается атомами вещества.
В связи с этим в 1913 г. он сформулировал два постулата:
1). Атом может находиться только в особых, стационарных состояниях.
Каждому состоянию соответствует определенное значение энергии — энергетический уровень.
Находясь в стационарном состоянии, атом не излучает и не поглощает.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны.
Номера стационарных орбит и энергетических уровней (начиная с первого) в общем случае обозначаютсяч латинскими буквами.
Радиусы орбит, как и энергии стационарных состояний, могут принимать не любые, а определенные дискретные значения.
Первая орбита расположена ближе всех к ярду.
2). Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ек в стационарное состояние с меньшей энергией Еп.
Атом может также поглощать фотоны.
При поглощении фотона атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией.
2. Как записать уравнение для определения энергии и частоты излученного фотона?
Согласно закону сохранения энергии энергия излученного фотона равна разности энергий стационарных состояний:

Отсюда следует, что атом может излучать свет только с частотами:

3. Какое состояние атома называют основным? возбужденным?
Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным.
Все другие состояния атома называются возбужденными.
4. Почему атомы каждого химического элемента имеют свой строго индивидуальный набор спектральных линий?
У атомов каждого химического элемента имеется свой характерный набор энергетических уровней.
Поэтому переходу с более высокого энергетического уровня на более низкий будут соответствовать характерные линии в спектре испускания, отличные от линий в спектре другого элемента.
5. Как объясняется совпадение линий в спектрах излучения и поглощения данного химического элемента?
Совпадение линий излучения и поглощения в спектрах атомов данного химического элемента объясняется тем, что частоты волн, соответствующих этим линиям в спектре, определяются одними и теми же энергетическими уровнями.
Поэтому атомы могут поглощать свет только тех частот, которые они способны излучать.
Физическая оптика. - Спектры и спектральные закономерности.
Исследование показало, что тип спектра определяется характером светящегося объекта.
Сплошные спектры получаются в результате свечения твердых или жидких тел. В пламени свечи светятся раскаленные частицы угля, в электрической лампочке — накаленная металлическая нить. Такие же спектры дают и расплавленные металлы, а также светящиеся газы или пары, если они обладают значительной плотностью, т. е. находятся под очень высоким давлением. В частности, сплошной спектр Солнца представляет собой, по-видимому, свечение паров высокой плотности.
Линейчатые и полосатые спектры характерны для свечения газов или паров малой плотности. Линейчатые спектры испускаются светящимися атомами. Многие газы состоят из отдельных атомов, например пары металлов и так называемые инертные газы — гелий, неон, аргон и др. Газы, состоящие из молекул, например водород, кислород, пар иода и др. , могут при возбуждении распадаться на атомы (диссоциировать) . Такие атомарные газы дают линейчатые спектры. Но можно вызвать свечение и целых молекул, не разбивая их на атомы. В таком случае испускаются полосатые спектры. При возбуждении таких многоатомных газов или паров нередко происходит частичная диссоциация и наблюдается одновременно и линейчатый и полосатый спектры.
Свечение атомов и молекул в парах и газах можно вызвать нагреванием. Например, в пламени газовой горелки можно наблюдать полосы, соответствующие свечению молекул циана, представляющих соединение углерода и азота (CN). Если в пламя внести крупинку поваренной соли (хлористого натрия, NaCl), то пламя окрашивается в интенсивный желтый цвет, и спектральный аппарат обнаруживает в желтой части спектра две близко расположенные линии, характерные для спектра паров натрия. Это означает, что в пламени горелки молекулы хлористого натрия распались на атомы натрия и хлора, свечение атомов натрия легко наблюдается, свечение же атомов хлора возбудить не легко, и оно обычно слишком слабо. Гораздо чаще для возбуждения спектров атомов и молекул пользуются явлениями электрического разряда в газах. В этом случае трубка с электродами, через которую пропускают электрический ток, наполняется газом при низком давлении.
В этих условиях разряд имеет характер тлеющего (см. т. II, § 100). Нередко трубке тлеющего разряда придают форму, указанную на рис. 325, с тем чтобы сконцентрировать свечение в узкой части, что удобно для освещения щели спектрографа. На этом рисунке 1 — электроды, 2 — узкая часть, где плотность тока (т. е. ток, рассчитанный на единицу площади) и яркость свечения имеют наибольшее значение. Для той же цели может служить электрическая искра или дуга между исследуемыми электродами.
Если повышать давление светящегося пара или газа, то спектральные линии начинают расширяться, захватывая
больший спектральный интервал. При очень больших давлениях (сотни и больше атмосфер) линейчатый спектр постепенно переходит в сплошной, характерный для сжатых газов.

На данном видеоуроке мы с вами поговорим о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров. Рассмотрим два постулата Бора и узнаем, где и зачем применяется спектральный анализ.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров"
Мирозданье постигая, все познай, не отбирая:
Что — внутри, во внешнем сыщешь.
Так примите ж без оглядки
Мира внятные загадки.
В данной теме речь пойдёт о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров.
В прошлой теме говорилось о дисперсии света. Дисперсия света — это зависимость показателя преломления среды и скорости света в нем от частоты световой волны.
В 1664–1668 гг. Исаак Ньютон провел серию опытов по изучению солнечного света и причин возникновения цветов с помощью стеклянной призмы. При разложении с помощью трёхгранной призмы белого света, т.е. света в видимом диапазоне, содержащего длины волн в диапазоне 380—760 нм, возникает радужная полоска, которую Ньютон назвал спектром.
В настоящее время для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма (которые использовал Ньютон), уже недостаточны. Необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма. Рассмотрим схему устройства призменного спектрального аппарата.
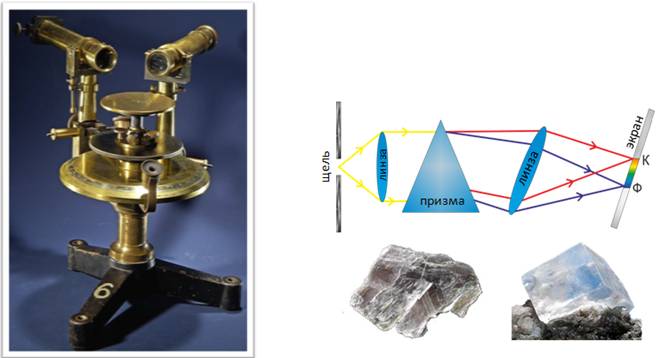
Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором. Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом - собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму, которая может быть изготовлена не только из стекла, но и кварца, соли и т.п.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран — матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений. Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр. Описанный прибор называется спектрографом.
Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом.
Спектральный состав излучений различных веществ весьма различен. Но многочисленные наблюдения и фотографии спектров показывают, что все спектры можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
В опыте Ньютона, при пропускании солнечного света через призму, получали спектр в виде сплошной полосы. В ней были представлены все цвета, плавно переходящие один в другой. Такой спектр называется сплошным или непрерывным спектром.
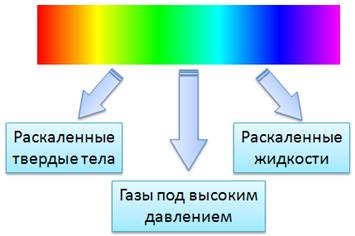
Сплошные спектры излучаются раскаленными твердыми и жидкими веществами, а также газами, находящимися под большим давлением. Это указывает на то, что вид непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом. Основную роль в излучении играет возбуждение атомов и молекул при хаотическом движении этих частиц, обусловленное высокой температурой. Солнце дает сплошной спектр, так как его оболочка состоит из плазмы высокой плотности.
Второй тип спектров — это линейчатые спектры.

Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
Например, если внести в пламя газовой горелки кусочек поваренной соли, то пламя окрасится в желтый цвет, а в спектре будут видны две близко расположенные желтые линии, характерные для спектра паров натрия.

Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину.
Такие спектры получаются от светящихся атомарных газов или паров. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Линейчатые спектры различных химических элементов отличаются цветом, положением и числом отдельных светящихся линий.
И последний тип спектров — это полосатые спектры.

Они состоят из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий.
Полосатые спектры излучаются отдельными возбужденными молекулами (молекулярный газ). Излучение вызвано как электронными переходами в атомах, так и колебательными движениями самих атомов в молекуле.
Все описанные выше спектры называются спектрами испускания, т.е. спектрами, получаемыми при разложении света, излученного самосветящимися телами.
Однако, кроме спектров испускания, существуют еще так называемые спектры поглощения.
Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии.

Спектры поглощения твердых и жидких тел обычно имеют вид широких темных полос, закрывающих часть сплошного спектра источника, а в случае атомарных газов или паров они состоят из отдельных черных линий, видимых на фоне сплошного спектра. Пропустив, например, свет от электрической лампы через сосуд с парами натрия, мы получим на сплошном спектре лампы две узкие черные линии в желтой области спектра как раз в том месте, где располагаются желтые линии в спектре испускания натрия. Другими словами, линии поглощения атомов натрия точно соответствуют его линиям испускания.
Совпадение частот линий испускания и поглощения можно наблюдать и в спектрах других элементов, например водорода и гелия.
В 1859 году на основе экспериментальных данных немецкий ученый Густав Роберт Кирхгоф сформулировал закон обратимости спектральных линий: линии поглощения соответствуют линиям испускания, т.е. атомы менее нагретого вещества поглощают из сплошного спектра как раз те частоты, которые они в других условиях испускают.
Спектр атомов каждого химического элемента уникален. Как не бывает двух людей с одинаковым дактилоскопическим узором, или окраской радужной оболочки глаз, или двух китов с одинаковой окраской хвостового плавника, так и не существует двух химических элементов, атомы которых излучали бы одинаковый набор спектральных линий.
Благодаря этому стало возможным появление метода спектрального анализа, разработанного в 1859 году Кирхгофом и его соотечественником немецким физиком Бунзеном. Спектральным анализом называют метод исследования химического состава различных веществ по их спектрам.
Анализ, проводимый по спектрам испускания, называют эмиссионным, а по спектрам поглощения — абсорбционным спектральным анализом.

В основе эмиссионного спектрального анализе лежат следующие факты:
1) Каждый элемент имеет свой спектр (отличается числом линий, их расположением и длинами волн), который не зависит от способов возбуждения.
2) Интенсивность спектральных линий зависит от концентрации элемента в данном веществе.
Для выполнения спектрального анализа вещества с неизвестным химическим составом необходимо осуществить две операции: заставить каким-то образом атомы этого вещества излучать свет с линейчатым спектром, затем разложить этот свет в спектр и определить длины волн наблюдаемых в нем линий. Сравнивая полученный линейчатый спектр с известными спектрами химических элементов таблицы Менделеева, можно определить, какие химические элементы имеются в составе исследуемого вещества. Путем сравнения интенсивности различных линий спектра можно определить и относительное содержание различных элементов в этом веществе.
Спектральный анализ выгодно отличается от химического анализа своей простотой, высокой чувствительностью, а также возможностью определять химический состав отдаленных тел, например звезд. Он используется для контроля состава вещества в металлургии, машиностроении и атомной индустрии. Этот метод применяется также в геологии, археологии, криминалистике и многих других сферах деятельности.В астрономии методом спектрального анализа определяют химический состав атмосфер планет и звезд, температуру звезд и магнитную индукцию их полей.

В процессе изучения и применения линейчатых спектров возникли различные вопросы, которые нельзя было объяснить в рамках классической механики Ньютона. Как, например, объяснить, почему атомы каждого химического элемента имеют свой строго индивидуальный набор спектральных линий? Почему совпадают линии излучения и поглощения в спектре данного элементы? Чем обусловлены различия в спектрах атомов разных элементов? Ответы на эти и многие другие вопросы удалось найти только в начале ХХ в. благодаря возникновению новой физической теории — квантовой механики. Одним из основоположником этой теории был датский физик Нильс Бор. Бор пришел к заключению, что свет излучается атомами вещества. В связи с этим в 1913 г. он сформулировал два постулата:
Первый постулат (его еще называют постулатом стационарных состояний) гласит, что атомная система может находиться только в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны не излучают электромагнитные волны, несмотря на ускоренное движение. В каждом стационарном состоянии атом обладает определенным квантовым значением энергии.
Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.

Атомы излучают и поглощают энергию дискретными порциями — квантами, значение которых равно разности энергии тех стационарных состояний, между которыми происходит данный переход.
Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным. Все другие состояния атома называются возбужденными. У атомов каждого химического элемента имеется свой характерный набор энергетических уровней. Поэтому переходу с более высокого энергетического уровня на более низкий будут соответствовать характерные линии в спектре испускания, отличные от линий в спектре другого элемента.
Совпадение линий излучения и поглощения в спектрах атомов данного химического элемента объясняется тем, что частоты волн, соответствующих этим линиям, а спектре, определяются одними и теми же энергетическими уровнями. Поэтому атомы могут поглощатьсвет только тех частот, которые они способны излучать.
Основные выводы:
– Все спектры испускания можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
– Сплошной спектр. Сплошной спектр представляет собойсплошную полосу, в которой все цвета, плавно переходят один в другой.
– Линейчатый спектр. Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
– Полосатый спектр. Полосатый спектр состоит из отдельных полос, разделенных темными промежутками.
– Для изучения спектров использую специальные приборы, которые называются спектральными — это приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра.
– Из опыта следует, что атомы могут поглощать свет только тех частот, которые они способны излучать. Это утверждение носит название закона обратимости спектральных линий.
– Спектральный анализ — это метод исследования химического состава различных веществ по их спектрам.
– В процессе изучения и применения линейчатых спектров возникли различные вопросы, ответы на которые дал Нильс Бор в 1913 году, сформулировав два постулата.
– Первый постулат (постулат стационарных состояний) гласит, что атомная система может находиться только в особых стационарных состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
– Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.

Объяснение происхождения линейчатых спектров. Экспериментальное наблюдение спектров.
Тема: Объяснение происхождения линейчатых спектров. Цель урока:– познакомить учащихся со спектрами химических веществ и практическим применением спектрального анализа в астрофизике, химии и других отраслях.
Образовательные: сформировать понятия о видах спектров, спектральном анализе и его применении.
Развивающие: развивать представление о процессе научного познания, обеспечить развитие аналитических умений, применять знания в конкретных ситуациях.
Воспитательные: воспитание и формирование коммуникативных качеств, прививать культуру умственного труда, повышать познавательный интерес к предмету.
Тип урока: урок усвоения новых знаний.
Вид урока: урок дискуссия с элементами проблемного обучения.
Оборудование: оптическая доска, осветитель, рамка с щелью, линза, дифракционная решетка, полупрозрачный экран, ртутная лампа, растворы различных веществ, спектроскоп.
Демонстрации: наблюдение сплошного и линейчатых спектров при помощи аппарата ФОС и спектроскопа, получение их фотографий при помощи цифрового фотоаппарата и веб-камеры.
I. Организация класса. (1 мин)
Проверка наличия в классе учащихся. Готовность к уроку.
II. Актуализация опорных знаний (5 мин).
Вспомним предыдущие темы и ответим на вопросы.
Что такое свет? (поток электромагнитных волн с длиной волны 4*10 -7 –8*10 -7 м)
При каком условии электромагнитные волны излучаются? (Электромагнитные волны излучаются при ускоренном движении заряженных частиц)
Что необходимо сделать, чтобы атом излучал? (Для того чтобы атом начал излучал, ему необходимо передать определенную энергию)
Какие источники света вы знаете? (Естественные и искусственные, а они в свою очередь подразделяются на тепловые и люминесцирующие)
Охарактеризуйте тепловое излучение, электролюминесценцию, катодолюминесценцию, хемилюминесценцию, фотолюминесценцию.
Вспомните, что называют дисперсией? (Дисперсией называется зависимость показателя преломления среды от частоты световой волны)
Кто открыл явление дисперсии и какой опыт со светом поставил этот учёный? (Ньютон. Направил на призму световой пучок малого поперечного сечения. Падая на стеклянную призму, он преломлялся и давал на стене изображение с радужным чередованием цветов. Радужную полоску он назвал спектром.)
Выполняя лабораторную работу по определению длины световой волны, вы использовали замечательное устройство. Как оно называется? (дифракционная решётка). Что вы получали с помощью дифракционной решётки (радужную полоску-спектр)
Цель урока:– познакомиться со спектрами химических веществ и практическим применением спектрального анализа в астрофизике, химии и других отраслях.
IV. Изучение нового материала. (18 мин)
1. Спектроскоп и спектрограф.
Для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма, уже недостаточны. Необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма или дифракционная решетка.
Рассмотрим схему устройства призменного спектрального аппарата. Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором (Слайд 4,5).
Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом - собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран -матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений. Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр.
Описанный прибор называется спектрографом. Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом. Призмы и другие детали спектральных аппаратов необязательно изготовляются из стекла. Вместо стекла применяются и такие прозрачные материалы, как кварц, каменная соль и др.
Спектральный состав излучения веществ весьма разнообразен. Но, несмотря на это, все спектры, как показывает опыт, можно разделить на три типа.
2. Виды спектров испускания (Слайд6).
Непрерывный (сплошной) спектры.
Эксперимент №1 по наблюдению спектра при помощи проекционного аппарата ФОС. (Слайд7)
Спектр можно получить, используя осветитель. Его световой поток пропускают через диафрагму с узкой щелью, объектив и дифракционную решётку или призму. Включим осветитель. Поместим за решёткой полупрозрачный экран. На экране наблюдается центральный дифракционный максимум. Он виден как белая полоса. Чуть дальше расположен максимум первого порядка. При использовании в осветителе лампы накаливания на экране наблюдается спектр. (Учащиеся наблюдают спектр).
Эксперимент №2 по наблюдению спектра при помощи спектроскопа
Направив узкую щель коллиматора на лампу накаливания, через зрительную трубу можно наблюдать спектр.
С помощью веб-камеры, компьютера и мультимедийного проектора спектр можно вывести на экран всему классу. Используя цифровой фотоаппарат, сфотографировать его.
Что же мы видим в наблюдаемых спектрах? Есть ли разрывы в данном спектре? (Слушаем ответы учащихся, а затем даём вместе понятие данного спектра).
В наблюдаемых спектрах мы видим все цвета радуги, то есть волны всех длин. В спектре нет разрывов и он представляет сплошную, непрерывную разноцветную полосу. Такие спектры называют непрерывными или сплошными.
Солнечный спектр или спектр дугового фонаря является непрерывным.
Непрерывные (или сплошные) спектры, как показывает опыт, дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры.
Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом.
Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.

Линейчатый спектр.
Эксперимент №1 по наблюдению линейчатого спектра при помощи проекционного аппарата ФОС.
Вместо лампы накаливания, воспользуемся осветителем, лампа которого излучает свет благодаря электрическому разряду в парах ртути. Наблюдается спектр в виде отдельных линий. Видны жёлтая, зелёная, синяя и фиолетовые линии спектра. (Слайд10) (Учащиеся наблюдают спектр).
Эксперимент №2 Внесем в бледное пламя газовой горелки кусочек асбеста, смоченного раствором обыкновенной поваренной соли. При наблюдении пламени в спектроскоп на фоне едва различимого непрерывного спектра пламени вспыхнет ярко желтая линия. Эту желтую линию дают пары натрия, которые образуются при расщеплении молекул поваренной соли в пламени. (Слайд11)
Эксперимент№3 Помещаем в генератор высоковольтный спектральные газоразрядные трубки с гелием, водородом, криптоном. Генератор подключаем к источнику питания. С помощью спектроскопа наблюдаем за спектрами. (Слайд12)
Что представляют спектры, которые вы наблюдали? (Слушаем ответы учащихся).
Каждый из спектров- это частокол цветных линий различной яркости, разделённых широкими тёмными полосами. Такие спектры называются линейчатыми. Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном) состоянии. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Изолированные атомы данного химического элемента излучают строго определенные длины волн.
При увеличении плотности атомарного газа отдельные спектральные линии расширяются и, наконец при очень большой плотности газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Линейчатые спектры представлены в учебнике рис.V,2,3,4 на цветной вклейке.

1-натрий; 2-водород; 3-гелий
Полосатые спектры.
Как вы думаете, чем отличаются спектры, которые излучаются атомами от молекулярных? (ответы учащихся) Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда. (Слайд 14)
С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий, разделённых тёмными промежутками. Это полосатый спектр. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
3. Спектры поглощения. (Слайд 15)
Все вещества, атомы которых находятся в возбужденном состоянии, излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Так, красное стекло пропускает волны, соответствующие красному свету и поглощает все остальные. Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появляются темные линии. Газ поглощает наиболее интенсивно свет как раз тех длин волн, которые он испускает в сильно нагретом состоянии. Темные линии на фоне непрерывного спектра - это линии поглощения, образующие в совокупности спектр поглощения.
Спектры поглощения представлены в учебнике рис.V,5-8 на цветной вклейке.


4. Спектральный анализ
Линейчатые спектры играют особо важную роль, потому что их структура прямо связана со строением атома. Ведь эти спектры создаются атомами, не испытывающими внешних воздействий.
Главное свойство линейчатых спектров состоит в том, что длины волн (или частоты) линейчатого спектра какого-либо вещества зависят только от свойств атомов этого вещества, но совершенно не зависят от способа возбуждения свечения атомов. Атомы любого химического элемента дают спектр, не похожий на спектры всех других элементов: они способны излучать строго-определенный набор длин волн.
На этом основан спектральный анализ - метод определения химического состава вещества по его спектру. Подобно отпечаткам пальцев у людей линейчатые спектры имеют неповторимую индивидуальность. Неповторимость узоров на коже пальца помогает часто найти преступника. Точно так же благодаря индивидуальности спектров каждого атома химического элемента, имеется возможность определить химический состав тела. С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества, если даже его масса не превышает 10 -10 г. Это очень чувствительный метод.
Количественное содержание элемента в исследуемом образце определяется путем сравнения интенсивности отдельных линий спектра этого элемента с интенсивностью линий другого химического элемента, количественное содержание которого в образце известно.
Количественный анализ состава вещества по его спектру затруднен, так как яркость спектральных линий зависит не только от массы вещества, но и от способа возбуждения свечения. Так, при низких температурах многие спектральные линии вообще не появляются. Однако при соблюдении стандартных условий возбуждения свечения можно проводить и количественный спектральный анализ.
V. Закрепление первичных знаний (7 мин)
Вопросы по теме:
Какие виды спектров вы знаете?
Какой спектр называется спектром поглощения?
Что называют спектральным анализом?
Где применяется спектральный анализ?
Задания на экране. (выполнение заданий обучающего характера с последующей проверкой).
VII. Итоги урока. Оценки. (3 минуты)
Как же это ему удалось? Как вы думаете, что использовал Роберт Вуд?
Ответ: Он всыпал в еду немного хлористого лития - безопасного для человеческого организма, а по виду и вкусу похожего на соль. На другой день спектральный анализ новой еды выдал красную линию, характерную для этого вещества. Подозрения Вуда подтвердились.
Молекулы и атомы излучают и поглощают свет определённых частот. Спектры эти можно наблюдать с помощью приборов невооруженным глазом, но существуют также невидимые лучи. На следующем занятии пойдёт речь об инфракрасном и ультрафиолетовом излучении.
VIII. Домашнее задание (1 минута)
1. § 81-83 изучить параграфы, уметь отвечать на вопросы в конце параграфов
Читайте также:
- Занимательная информатика для начальной школы внеурочная деятельность
- Когда была создана славянская письменность как назывались славянские алфавиты кратко
- Что должны принимать во внимание разработчики законов кратко
- План библиотечных уроков в библиотеке названия
- Что входит в набор для вышивания в школу

