Как диссоциируют вещества с ковалентной связью кратко
Обновлено: 02.07.2024
При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате химическая связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор.
Последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
2) гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная полярная связь (например, молекулы хлороводорода \(HCl\)), только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную, и последовательность процессов, происходящих при этом, будет такая:

Иначе происходит диссоциация полярных молекул. Механизм диссоциации таких молекул рассмотрим на примере растворения в воде хлороводорода . При этом, как вы помните, образуется электролит – соляная кислота.
Ниже представлена схема образования молекулы хлороводорода.
+ −
Диполь или полярная молекула
Молекулу воды также можно рассматривать как диполь (см. схему справа).


+ −
Молекулы воды, притянувшись к концам полярной молекулы хлороводорода, вызывают расхождение ее полюсов – поляризуют молекулу (см. рис.2 – 1,2).
Рис.2. Механизм электролитической диссоциации веществ с ковалентной
Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы на ионы (рис.2 – 3). Как и в случае растворения ионного кристалла, эти ионы гидратируются: перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов.Иначе говоря, в результате диссоциации образуются не свободные ионы, а соединения ионов с молекулами воды. При этом ион водорода оказывается прочно связанным с молекулой воды в ион гидроксония . Если вместо воды взят какой-то другой растворитель, эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, так как их состав может изменяться.
Третье положение ТЭД
Ионы в растворах находятся в сольватированном состоянии
Так при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:

.

−краткая запись

Иначе происходит диссоциация полярных молекул. Механизм диссоциации таких молекул рассмотрим на примере растворения в воде хлороводорода . При этом, как вы помните, образуется электролит – соляная кислота.
Ниже представлена схема образования молекулы хлороводорода.
+ −
Диполь или полярная молекула
Молекулу воды также можно рассматривать как диполь (см. схему справа).


+ −
Молекулы воды, притянувшись к концам полярной молекулы хлороводорода, вызывают расхождение ее полюсов – поляризуют молекулу (см. рис.2 – 1,2).
Рис.2. Механизм электролитической диссоциации веществ с ковалентной
Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы на ионы (рис.2 – 3). Как и в случае растворения ионного кристалла, эти ионы гидратируются: перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов.Иначе говоря, в результате диссоциации образуются не свободные ионы, а соединения ионов с молекулами воды. При этом ион водорода оказывается прочно связанным с молекулой воды в ион гидроксония . Если вместо воды взят какой-то другой растворитель, эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, так как их состав может изменяться.
Третье положение ТЭД
Ионы в растворах находятся в сольватированном состоянии
Так при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:

.

−краткая запись
§ 25. Электролитическая диссоциация веществ в растворах
Сванте Август
Аррениус —
шведский физико-
химик, автор теории
электролитической
диссоциации ( 1887 г. )
К началу XIX века естествоиспытатели установили, что все растворы можно разделить на две большие группы — непроводящие электрический ток и проводящие его. Немецкий физик Г. С. Ом выявил, что растворы-проводники проводят ток по тем же законам, что и металлы-проводники. Английский физик М. Фарадей изучил явление электролиза и установил его основные законы. Наблюдаемые в растворах явления и закономерности в 1887 году объяснил шведский учёный Сванте Аррениус, предложивший теорию электролитической диссоциации. Её сущность можно выразить следующим образом:
электролиты распадаются на ионы в расплавах под действием высокой температуры, а в растворах вследствие взаимодействия с растворителем ( рис. 56 ).
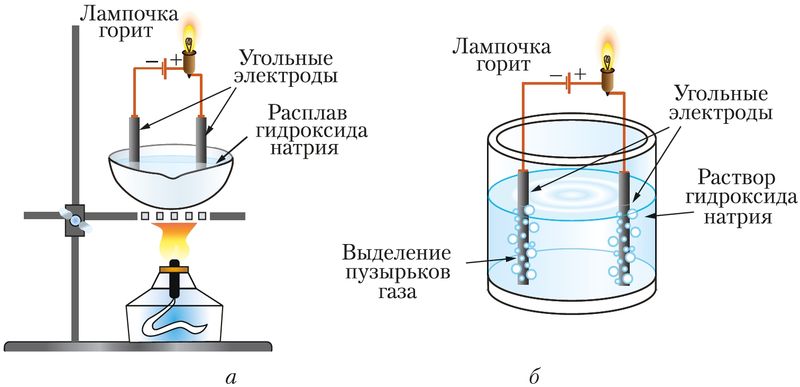
Рис. 56. Электролиты: а — расплав NaOH, б — раствор NaOH в воде
Процесс распада электролита на ионы называют электролитической диссоциацией.
В твёрдом состоянии большинство ионных и молекулярных соединений — это диэлектрики, не проводящие ток. Так, электропроводность твёрдого NaCl в 1000 млрд раз меньше, чем у металлов или графита. В то же время водные растворы электролитов проводят ток вследствие того, что ионные и многие молекулярные соединения под влиянием полярных молекул воды при растворении распадаются (диссоциируют) на катионы и анионы.
Электролит — это вещество, которое проводит электрический ток вследствие диссоциации на катионы и анионы в расплаве или в растворе.
Электропроводность электролитов обусловлена подвижностью катионов и анионов в расплавах и растворах.
К электролитам относятся соли, щёлочи, кислоты, то есть соединения с ионной или ковалентной полярной химической связью.

Кислоты относятся к веществам, в молекулах которых атомы связаны ковалентными полярными связями. Говоря об электролитах с таким типом связи, мы будем иметь в виду только растворимые органические и неорганические кислоты.
Кислоты имеют молекулярное строение, и готовых ионов в них нет, но, как правило, все молекулы кислот полярные. Особенностью диссоциации кислот является то, что диполи воды притягиваются к разноименно заряженным концам полярной молекулы кислоты, а затем как бы растягивают ее до образования ионов.
Образовавшийся при диссоциации кислот ион водорода гидратируется молекулой воды и при этом образуется сложный ион Н + (Н2O), или Н3O + , — ион гидроксония. Установлено, что механизм возникновения ковалентной связи в ионе гидроксония донорно-акцепторный:
Молекула воды — донор электронной пары, ион водорода — ее акцептор.
Однако в дальнейшем для упрощения записей в уравнениях ионных реащий мы будем записывать гидратированный ион водорода просто как Н+.
Кислоты диссоциируют в водных растворах на ионы водорода и кислотных остатков:
По числу атомов водорода кислоты делятся на одно-, двух-, трехосновные. Многоосновные кислоты диссоциируют ступенчато. По первой ступени диссоциация протекает обычно легко, последующие ионы водорода отщепляются менее активно.
Свойства ионов отличаются от свойств атомов и молекул, потому что они обладают различным электронным строением.
Ионы, как известно, образуются в результате отдачи или присоединения электронов атомами, что и является причиной наличия заряда у ионов. Так же, как ионы водорода, все ионы в водных растворах гидратируются, т. е. взаимодействуют с молекулами воды. Гидратация отчасти затрудняет обратное соединение ионов (ассоциацию). Гидратированные ионы имеют как постоянное, так и переменное число молекул воды. При написании формул гидратированных ионов их можно обозначать:
NaCl → Na + (p-p) + Cl — (p-p),
однако для простоты написания указания в скобках опускают.

Движение ионов в растворе под действием электрического поля
Свойства заряженных ионов отличаются от свойств электронейтральных атомов. Ионы натрия Na + не разлагают воду, а нейтральные атомы натрия Na 0 взаимодействуют с ней с выделением водорода.
Ионы хлора CI — не имеют ни цвета, ни запаха, не являются токсичными, т. е. не проявляют свойств газообразного хлора. В электрическом поле ионы перемещаются к разноименно заряженным электродам. Положительно заряженные ионы направляются к катоду, и их называют катионами. Отрицательно заряженные ионы называют анионами, так как они перемещаются к аноду (рисунок выше).
Читайте также:

