Элементы 2 ii а группы план урока
Обновлено: 05.07.2024
Актуализация опорных знаний.
Учащиеся сообщают сведения, известные им на данный момент, об элементах II группы главной подгруппы и простых веществах, ими образованных, их применении.
2) Изучение нового материала. Восприятие, осмысление и первичное запоминание сведений о металлах II группы главной подгруппы. Формы работы - индивидуальная, групповая, самостоятельная работа с источниками информации.
Учитель. Химические элементы, входящие в главную подгруппу II группы: бериллий, магний и щелочноземельные металлы - кальций, стронций, барий и радий. Каково происхождение данного названия? Гидроксиды этих элементов – сильные основания - похожи по свойствам на гидроксиды щелочных металлов; оксиды же их тугоплавки и напоминают оксиды алюминия и некоторых тяжелых металлов (такие оксиды прежде называли “землями”). Отсюда и название “Щелочноземельные металлы”.
Используются дополнительные источники информации - тексты, подготовленные учителем, о каждом из элементов II группы главной подгруппы. При работе с текстами используется прием “Пометки на полях”. Он является средством, позволяющим ученику послеживать свое понимание прочитанного текста (осмысление) Для этого используются специальные маркировочные знаки, например:
“V” - информация известна;
Данный прием требует от ученика не привычного пассивного чтения, а активного и внимательного. Он обязывает не просто читать, а вчитываться в текст, отслеживать собственное понимание информации. На практике ученики просто пропускают то, что не поняли. И в данном случае маркировочный знак “?” обязывает их быть внимательными и отмечать непонятный материал. Особенно эффективен он при изучении материала, имеющего опору на жизненный опыт и знания учащихся.
Учитель определяет персонал шести лабораторий (рабочих групп). Каждая группа получает задание и проводит исследование. Темы исследований в лабораториях: “Бериллий”, “Магний”, “Кальций”, “Стронций”, “Барий”, “Радий” - соответствуют названиям химических элементов IIА группы. Группы работают в течение 7 минут.
Тема исследования: “Бериллий”
Цель: Составить отчет о бериллии согласно полученным пунктам плана исследования.
1) Подготовить историческую справку об открытии бериллия.
2) Объясните физические свойства металла: ковкость, тепло- и электропроводность на основе строения кристаллической решетки. Построить модель металлической кристаллической решетки с помощью раздаточного материала (магнитные модели электронов и ионов).
3) Определить области распространения бериллия в природе.
4) Выяснить содержание бериллия в живых организмах.
5) Подготовить устный отчет о проделанной работе.
Тема исследования: “Магний”
Цель: Составить отчет о кальции согласно полученным пунктам плана исследования.
1) Подготовить историческую справку об открытии магния.
2) Объясните физические свойства металла: ковкость, тепло- и электропроводность на основе строения кристаллической решетки. Построить модель металлической кристаллической решетки с помощью раздаточного материала (магнитные модели электронов и ионов).
3) Определить области распространения магния в природе.
4) Выяснить содержание магния в живых организмах.
5) Подготовить устный отчет о проделанной работе.
Тема исследования: “Кальций”.
Цель: Составить отчет о кальции согласно полученным пунктам плана исследования.
1) Подготовить историческую справку об открытии кальция.
2) Объясните физические свойства металла: ковкость, тепло- и электропроводность на основе строения кристаллической решетки. Построить модель металлической кристаллической решетки с помощью раздаточного материала (магнитные модели электронов и ионов).
3) Определить области распространения кальция в природе.
4) Выяснить содержание кальция в живых организмах.
5) Подготовить устный отчет о проделанной работе
Тема исследования: “Стронций”
Цель: Составить отчет о кальции согласно полученным пунктам плана исследования.
1) Подготовить историческую справку об открытии стронция.
2) Объясните физические свойства металла: ковкость, тепло- и электропроводность на основе строения кристаллической решетки. Построить модель металлической кристаллической решетки с помощью раздаточного материала (магнитные модели электронов и ионов).
3) Определить области распространения стронция в природе.
4) Выяснить содержание стронция в живых организмах.
5) Подготовить устный отчет о проделанной работе.
Тема исследования: “Барий”
Цель: Составить отчет о кальции согласно полученным пунктам плана исследования.
1) Подготовить историческую справку об открытии бария.
2) Объясните физические свойства металла: ковкость, тепло- и электропроводность на основе строения кристаллической решетки. Построить модель металлической кристаллической решетки с помощью раздаточного материала (магнитные модели электронов и ионов).
3) Определить области распространения бария в природе.
4) Выяснить содержание бария в живых организмах.
5) Подготовить устный отчет о проделанной работе
Тема исследования: “Радий”
Цель: Составить отчет о кальции согласно полученным пунктам плана исследования.
1) Подготовить историческую справку об открытии радия.
2) Объясните физические свойства металла: ковкость, тепло- и электропроводность на основе строения кристаллической решетки. Построить модель металлической кристаллической решетки с помощью раздаточного материала (магнитные модели электронов и ионов).
3) Определить области распространения радия в природе.
4) Выяснить содержание радия в живых организмах.
5) Подготовить устный отчет о проделанной работе
Учащиеся знакомятся с учебным материалом о металлах IIА группы, делают необходимые им записи, принимают самостоятельное решение о важности и соответствии информации цели своего исследования, готовятся выступить на конференции с результатами исследовательской деятельности.
По окончании работы проводится мини-конференция на которой с докладами выступают руководители исследовательских лабораторий. Они докладывают о результатах своих исследований и полученных данных. В итоге вместе с учителем группы составляют обобщающую схему-кластер о взаимосвязи важнейших характеристик элементов II группы главной подгруппы Периодической системы.
С отчетом о работе химической лабораторий выступает учитель.
Учитель. Настало время изучить химические свойства элементов II группы главной подгруппы. Ее составляют: бериллий - переходный элемент, его свойства и свойства его соединений сходны с алюминием и образованными им веществами (диагональное сходство); магния и щелочноземельные металлы: кальций, стронций, барий и радий.
- Что общего в строении атомов металлов II А подгруппы?
- Как изменяется строение атома и химические свойства металлов от магния до радия?
- Какие свойства, окислительные или восстановительные, проявляют металлы II группы главной подгруппы?
- С какими веществами могут реагировать металлы II группы?
Итак, бериллий, магний и все щелочноземельные металлы взаимодействуют при нагревании почти со всеми неметаллами - хлором, серой, азотом, водородом и т.д., образуя соответственно хлориды, сульфиды, нитриды, гидриды. Учащиеся записывают уравнения химических реакций, расставляя коэффициенты в них методом электронного баланса.
При нагревании на воздухе все рассматриваемые металлы энергично сгорают с образованием оксидов. Видеофрагмент - взаимодействие кальция с кислородом. (Диск “Образовательная коллекция.1С.Самоучитель.Химия для всех. XXI)
Дайте характеристику реакции: 1) по числу и составу исходных веществ и продуктов реакции; 2) по изменению степени окисления атомов; 3) по использованию катализатора; 4) по направлению; 5) по тепловому эффекту.
Проблемная ситуация. Углекислый газ не поддерживает горение, воду используют для тушения пожаров. Можно ли потушить горящий магний водой или углекислым газом? Демонстрационный эксперимент. Вносим горящий магний в воду и наблюдаем, как он сгорает, ярко вспыхивая. Обсуждаем причины данного явления, записываем уравнения химических реакций. Магний восстанавливает неметаллы из оксидов. Горящий магний невозможно потушить не только водой, но и углекислым газом, с которым он реагирует:
2Mg + CO2 = 2MgO + C (а также CO)
Из всех металлов главной подгруппы II группы только бериллий практически не взаимодействует с водой (препятствует защитная пленка на его поверхности), магний реагирует при нагревании, остальные металлы взаимодействуют с водой при обычных условиях.
Металлы IIА группы Периодической системы Д.И. Менделеева способны вытеснять менее активные металлы из их оксидов. На этом свойстве основан один из пирометаллургических способов получения металлов – металлотермия. В качестве восстановителей чаще всего используют магний и кальций. Магниетермией получают, например, ниобий, тантал, молибден. Кальциетермией – почти все редкоземельные металлы, хром, цирконий, ванадий и др.
1. Какие элементы относятся к группе щелочноземельных металлов?
2. Каково строение внешнего энергетического уровня щелочноземельных металлов?
3. Какие свойства характерны для металлов II группы главной подгруппы?
4. Как изменяется активность щелочноземельных металлов в группе?
5. С какими простыми веществами взаимодействуют металлы II группы главной подгруппы?
6. С какими сложными веществами взаимодействуют металлы II группы главной подгруппы?
Верны ли данные утверждения?
Все щелочноземельные металлы открыты в XIX веке.
Название магния произошло от названия города.
Радий единственный радиоактивный элемент в своей группе.
Бериллий при обычных условиях не взаимодействует с водой.
От строения кристаллической решетки зависят физические свойства металлов.
Для живых организмов особое значение имеет кальций.
4) Домашнее задание: §12 до соединений щелочноземельных металлов, упр.1, 6, 9. Напишите рассказ или сочинение о химическом веществе или процессе, посвященное химии щелочноземельных металлов. Учитель в качестве примера зачитывает рассказ.
“Открытие радия вызвало переворот в физике и химии. Он был обнаружен благодаря своей радиоактивности в 1898 году супругами Кюри. Выделение радия стало примером упорного, настойчивого труда.
Поэзия –
Та же добыча радия.
В грамм добыча, в год труды.
Радий принадлежит к трудовой семье щелочноземельных металлов, но в жилах его течет голубая кровь. Впрочем, это нисколько не мешает ему общаться с другими веществами, вступать сними в контакты и завязывать прочные связи. Радий сыграл огромную роль в развитии науки о микромире. Благодаря нему обнаружено существование ядра атома, осуществлено первое искусственное ядерное превращение, открыт нейтрон.
В настоящее время радий активно работает в медицине – радиотерапия. Он является источником радона при лечении радоновыми ваннами”.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Тема урока "Металлы II группы главной подгруппы"
Цель: дать общую характеристику металлов главной подгруппы II группы и рассмотреть их основные физические и химические свойства.
Образовательная: организовать деятельность учащихся по изучению строения, нахождения в природе, свойств, применению и биологической роли элементов II группы для организма человека.
Развивающая: создать условия для развития умений наблюдать химический эксперимент, анализировать, делать выводы; развитие познавательной активности и самостоятельности учащихся.
Воспитательная: создать условия для воспитания ценностного отношения к своему здоровью, развитие коммуникативных навыков.
Тип урока: Урок изучения нового материала.
Вид урока: комбинированный.
Формы организации учебной деятельности: фронтальная, индивидуальная работа.
Методы: объяснение материала, фронтальный опрос, демонстрация опытов, работа с таблицей и учебником. выполнение теста, самостоятельная работа, проблемный вопрос.
Оборудование: ПСХЭ Д.И.Менделеева, ИКТ, хим. стаканы, пробирки, штатив, лоток.
Вещества: Мg, Ca, H 2 O , HCl (раствор), фенолфталеин.
I. Организационный момент
Здравствуйте ребята! Я очень рада видеть вас на уроке. Давайте мысленно друг другу пожелаем удачи. Перед вами лежит лист самооценки ( приложение 1), в котором на каждом этапе урока вы будете ставить себе баллы.
II . Актуализация знаний
Мы продолжаем с вами изучать тему "Металлы" и сегодня я хочу начать урок со слов
Эпиграф " Чем больше узнаешь, тем лучше понимаешь, как много тебе еще нужно узнать. "
Прежде, чем перейти к новой теме, давайте вспомним ( фронтальная работа с классом)
1.Элементы какой группы мы изучили? Как они называются и почему? Перечислите данные элементы.
2. Почему элементы I группы хранят как "кощееву смерть"?
3. Какими физическими свойствами обладают металлы I группы?
4. Все ли металлы I группы главной подгруппы вступают с кислородом в реакцию одинаково? Напишите уравнения реакций(работа у доски).
III . Переход к изучению нового материала
А теперь прослушайте стихотворение и ответьте: об элементах какой группы пойдет сегодня речь?
Мы идем за первой следом,
И валентность наша два,
Без стесненья, скажем смело-
О нас добрая молва.
Средь химического братства
Народ мы очень дружный.
С нами трудно состязаться,
Каждый из нас в жизни архиважный,
Каждый из нас в жизни архинужный!
Итак, тема нашего урока" Металлы II группы главной подгруппы". (Постановка целей и задач урока).
Как еще можно назвать элементы данной группы?
Все ли элементы II группы главной подгруппы являются щелочноземельными металлами? Почему?
IV. Изучение нового материала
Самостоятельная работа по ПСХЭ Д.И.Менделеева и учебнику.
Дайте характеристику элементам II группы по положению в ПСХЭ(перечисляют элементы главной подгруппы, строение внешнего энергетического уровня, высшая валентность ,изменение металлических свойств по группе, ЭО, радиус атома). А теперь проверьте себя по учебнику (стр.60 учебник Химия 9 класс О.С.Габриелян).
Как вы думаете, в природе данные металлы находятся в виде соединений или простых веществ? (только в соединениях, так как являются активными и поэтому их хранят также как и элементы I группы, кроме магния).

Слайд 1. Физические свойства металлов II группы
Видео: Окрашивание пламени ( DVD - диск " Металлы II группы главной подгруппы").
Живет обычно в керосине
И бегает он по воде
В природе, в комнате - отныне
Свободным нет его нигде
В солях открыть его возможно
Желтеет пламя от него
И получить из соли можно
Как Дэви получил его (Натрий )
Горит лиловым в кислороде
Свободным нет его в природе
Но соль находит примененье
Как для растений удобренья (Калий)
Металл я легкий, серебристый.
Сгораю даже очень быстро,
Сверкаю вспышкою огня.
(Фотограф раньше знал меня). (Магний)
Я, поверьте, не пустяк:
Без меня ни мел, ни мрамор
Не обходятся никак
Я построю вам скелет
Без меня опоры нет. (Кальций)
(учащиеся по ходу записывают уравнения реакций)
1. Горение магния на воздухе ( видео DVD - диск " Металлы II группы главной подгруппы").
2 Mg + O 2 =2 MgO (составление ОВР)
2. Взаимодействие с водой(дем. опыта)
Ве- практически не взаимодействует с водой, М g - реагирует медленно, остальные бурно. Поэтому Ве и М g не являются щелочноземельными металлами.
3. Взаимодействие с кислотами (дем. опыта)
4. Взаимодействие с неметаллами ( при обычной темпер.- О 2 , С l 2 , при температуре - S , N 2 , при повышенной темпер.- Н 2 )
5. Являются восстановителями редких металлов (магниетермия)
2 Mg + TiO 2 =2 MgO + Ti
А теперь поговорим с вами о здоровье. Здоровье человека зависит от наличия или отсутствия в организме некоторых металлов. В крови человека найдено 76 хим.элементов из них 62 металла.
К металлам - "элементам жизни" относятся 10 хим.элементов- K, Na, Mg , Ca , Fe , Mn , Co , Cu , Zn , Mo .
Выполнение теста ( у каждого учащегося)
"Щелочноземельные металлы"
Задание: выберите правильный ответ
1) Все элементы II группы главной подгруппы периодической системы относятся к.
а) типичным окислителям
б) переходным элементам
2) Атомы щелочноземельных элементов имеют.
а) по 1 электрону на внешнем уровне
б) по 2 электрону на внешнем уровне
в) полностью заполненный внешний уровень
3) Атомы щелочноземельных элементов имеют.
а) возможность терять два внешних электрона, образуя катион со степенью окисления +2
б) возможность терять единственный внешний электрон, образуя катион со степенью окисления +1
в) возможность приобретать один электрон на внешний уровень, образуя анион со степенью окисления -1
4) Радий, завершающий II группу, является.
а) очень твердым
б) самым распространенным в земной коре
5) Все s -металлы очень активны и поэтому.
а) хранятся в открытых банках
б) хранятся в воде
в) хранятся в керосине
6) Поскольку внешние электроны s - металлов легко переходят к другим элементам, все эти металлы являются.
а) типичными изоляторами
б) сильными восстановителями
7) Все щелочноземельные металлы горят в атмосфере кислорода, образуя.
а) оксиды состава МеО
б) гидроксиды состава Ме(ОН) 2
в) оксиды состава Ме 2 О
8) При взаимодействии щелочноземельных металлов с водой образуются.
а) гидриды и кислород
б) гидроксиды и водород
в) пероксиды и водород
(самопроверка или взаимопроверка по готовым ответам)
VI . Подведение итога урока (ответы на поставленные учащимися цели и задачи урока).
Задание на дом: п.12 с.60-62 упр.5 с.67(объяснение)(слайд)
Дополнительное задание "Нигде нет покоя"
Когда Магний пришел в бар, там уже сидели: Кислород, Сера, Хлорид натрия в растворе, разбавленная Серная кислота и Гидроксид Меди( II ). Присутствие каких веществ испортило ему настроение? Почему? Подтвердите свой ответ уравнениями соответствующих реакций.
VII .Заполнение листа самооценки. Рефлексия "Выбор" (слайд).
Хочется закончить свой урок словами Веры Захаровой(слайд)
И у природы есть всему свой срок
И осени пора, и бурного цветенья
Но химии не кончится урок
Жизнь будет ее вечным продолжением!
Приложение 1
Лист самооценки деятельности учащегося
5 баллов - понимаю, выполняю все правильно, активно участвую в обсуждении вопросов;
4 балла - иногда затрудняюсь, допускаю ошибки, принимаю участие в обсуждении вопросов;
3 балла - ничего не понял, беру готовое, пассивен.
Отметка "5" - 46-50 баллов; "4"- 41-45 баллов; "3" - 34-40 баллов; "2" - менее 33 баллов.
- Продолжить формировать умения давать характеристику элемента по его положению в периодической системе химических элементов Д.И. Менделеева, на основе строения атома объяснять физические и химические свойства металлов.
Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитательные: воспитывать позитивное отношение к учению, прививать любовь к предмету, создавать комфортные отношения между участниками.
Оборудование для учителя: компьютер, мультимедийный проектор и презентация Microsoft PowerPoint, а также спиртовка, спички, пинцет, нож, пробирки, ложка для сжигания веществ
Чуть больше 200 лет назад во втором кругосветном путешествии Джеймса Кука сопровождал немецкий естествоиспытатель Иоганн Рейнгольд Форстер, воображение которого поразила изумительная картина коралловых островов Тихого океана. Но дело было не только в красоте рифов и лагун. Форстер первым осмыслил и оценил ту грандиозную созидательную деятельность живых организмов, благодаря которой возникают известковые массивы.
В древнем Египте плотные известняки служили материалом для постройки жилищ и храмов. Известная пирамида Хеопса, весящая около 5 млн. тонн, сложена из 2 млн. брусков известняка. Из него строили Великую китайскую стену.
- Соединения какого химического элемента так поразили людей прошлых столетий, что были увековечены в географических названиях?
Ве – амфотерный металл, Mg – металл, Сa, Sr, Ba – щёлочноземельные металлы, Ra – радиоактивный элемент
Учитель: Все эти элементы находятся в одной группе, в главной подгруппе, но по какой-то причине магний и бериллий к группе щелочноземельных металлов (ЩЗМ) не относят?! Оказывается, если магний по свойства во многом тяготеет к ЩЗМ, то бериллий стоит как бы особняком, по свойствам он ближе к алюминию, проявляет амфотерные свойства.
У металлов II группы главной подгруппы на внешнем энергетическом уровне содержится по 2 электрона, находящихся на меньшем удалении от ядра, чем у щелочных металлов. Поэтому их восстановительные свойства хотя и велики, но все же менее чем у элементов I группы. Усиление восстановительных свойств также наблюдается при переходе от Mg к Ba, что связано с увеличением радиусов их атомов, во всех соединениях проявляют степень окисления +2.
Проблема: В каком виде щелочноземельные металлы встречаются в природе? Почему в природе щелочноземельные металлы в основном существуют в виде соединений?
Учитель: Зная общие физические свойства, активность металлов, предположите химические свойства щелочноземельных металлов. С какими веществами взаимодействуют щелочные металлы?
- Щелочноземельные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами (с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами (слайд № 8,9).
Работа у доски, записывают уравнения реакций, характеризующих химические свойства металлов главной подгруппы II группы ПС.
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
Важнейшие параметры элементов IIA группы приведены в таблице:
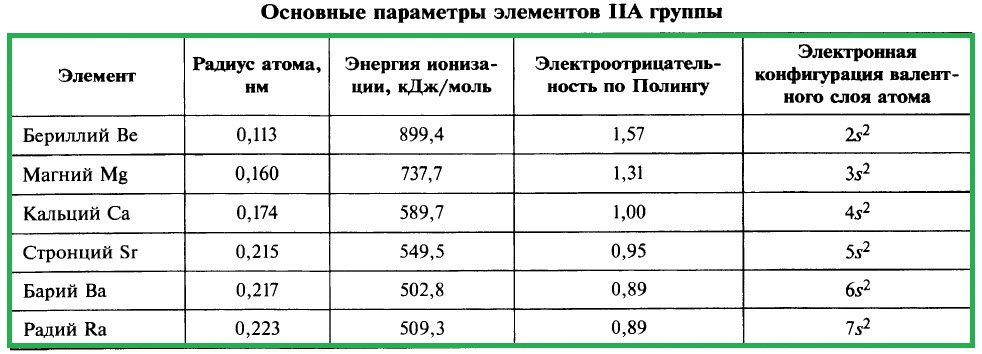
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:

Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях:

При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:
При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.

Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды:

При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления):

При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Читайте также:

