Элементы 17 7а группы план урока
Обновлено: 06.07.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Краткосрочный план урока
Раздел долгосрочного плана: Раздел № 1
Элементы 17 (VII) группы
ФИО преподавателя: Байманкулова Ж.З.
Всего в группе: 25
Количество присутствующих:
Тема урока №13
Элементы 17 (7А) группы. Галогены, закономерности изменения свойств галогенов, физиологические свойства галогенов.
Цели обучения, которые достигаются на данном уроке
-составлять электронные формулы молекул галогенов, определять вид связи и тип кристаллической решетки ;
-прогнозировать тенденции изменения свойств галогенов в группе
Составлять электронные формулы молекул фтора, хлора, брома, йода, определят вид связи и тип кристаллической решетки и спрогнозируют изменения свойств в ряду от фтора к йоду
Критерии оценивания
- составлять электронные формулы фтора, хлора, брома
- определят вид связи и тип кристаллической решетки в молекулах галогенов
- спрогнозируют изменение физических и химических свойств галогенов в зависимости от строения атома
Языковые цели
Галогены – солеобразующие, плавиковая кислота, галит, сильвин, бишофит, теннессин.
Привитие ценностей
Общество всеобщего труда
Сотрудничество, уважение, труд и творчество.
Межпредметные связи
Биология: действие на организм.
География: нахождение в природе, минералы.
Предварительные знания
Данный урок основывается на знаниях и навыках, которые были получены на уроках в предыдущих классах при изучении тем: строение атома, электроотрицательность, химическая связь, кристаллические решетки.
Запланированные
этапы урока
Запланированная деятельность
Ресурсы и оценивание
Начало урока
(Стадия вызова)
Здравствуйте, ребята! Я рада вас видеть на сегодняшнем уроке. Садитесь. Давайте проведем перекличку. Кто сегодня присутствует на уроке?
На рабочем столе размещен Оценочный лист по химии, в течение урока Вы будете сами себя оценивать по указанным критериям.
Я желаю Вам удачи, желаю активного участия на уроке и постарайтесь извлечь из урока все самое интересное.
Ребята! В какой группе расположены галогеныв периодической системе химических элементов Д. И. Менделеева?
(Ответ учащегося: в главной подгруппе 17 ( VII ) группе).
Откройте тетради и запишите дату и тему урока: Элементы 17 (7А) группы.
- Что вы хотите узнать о галогенах?
- Попробуйте сформулировать цели нашего урока (ответ учащихся: нам предстоит сегодня на уроке).
Оценочный лист по химии
Таблица Д.И. Менделеева
Середина урока
(Стадия осмысления)
Изучение нового материала.
Ребята! Перечислите, какие элементы относятся к галогенам?
Элементы главной подгруппы 17 (7А) группы Периодической системы Д.И.Менделеева, объединенные под общим названием галогены, - фтор, хлор, бром, йод, астат, теннессин.
Индивидуальная работа №1.
Напишите строение атомов фтора, хлора, брома, йода.
Критерии: написать электронные формулы галогенов
Дескрипторы:
- правильно написать электронную формулу фтора
- правильно написатьэлектронную формулу хлора
- правильно написатьэлектронную формулу брома
- правильно написатьэлектронную формулу йода
Ребята! Что общего в строении атомов галогенов? (Одинаковое число электронов на внешнем энергетическом уровне, и им недостаёт лишь одного электрона, чтобы завершить его).
Общая конфигурация ns 2 np 5 , где n- номер периода.
Атомы галогенов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь.
Рассмотрим взаимодействие натрия с хлором.
Какой тип химической связи существует в молекулах галогенов?
Между атомами ковалентная неполярная связь.
Индивидуальная работа №2.
Определите тип химической связи молекулы фтора, хлора, брома, йода.
Критерии: определить типы химической связи галогенов
Дескрипторы:
- Правильно определить тип химической связи молекулы фтора
- Правильно определить тип химической связи молекулы хлора
- Правильно определить тип химической связи молекулы брома
- Правильно определить тип химической связи молекулы йода
Почему в природе не встречаются галогены в форме простых веществ?
Галогены - химически активные вещества, сильные окислители, поэтому и не встречаются в природе в виде простых веществ, только в виде соединений. Причем в состав соединений входят в основном в степени окисления -1 (галогениды).
Индивидуальная работа №3.
Критерии: Расставить коэффициенты в химических уравнениях используя закон сохранения массы веществ.
Дескрипторы:
- умение расставлять коэфиценты
- знать валентность химических элементов
- знать понятие закон сохранения массы
Индивидуальная работа №4.
Критерии: вычислить относительную молекулярную массу галогенов Br2O , НСl , KBr , K Сl , Н Br , NaCl , FeI 2 , BaCl2
Дескрипторы:
- знать химическую формулу
- умение вычислять Mr
Групповое задание.
Критерии: написать уравнения химических превращений
Дескрипторы:
- знать химические элементы
- умение расставлять коэффициенты
- учитывать валентность
- дать название продукту реакции.
1 группа . Что общего в строении атомов галогенов?
2 группа . Чем отличается строение атомов разных галогенов?
3 группа . Как эти различия влияют на физические свойства?
4 группа . Как и почему происходит изменение химической активности в группе?
Критерии: отвечают на вопросы. Обсуждают в группе.
- правильно отвечает на вопрос 1
- правильно отвечает на вопрос 2
- правильно отвечает на вопрос 3
- правильно отвечает на вопрос 4
Изучим физиологические свойства галогенов и ответим на главный вопрос урока: какую роль в нашей жизни играют галогены – положительную или отрицательную? Для записи положительной и отрицательной роли галогенов имеется изображением скелета рыбы(технология ФИШБОУН).
Преподаватель: на “верхних косточках” “рыбного скелета” от головы к хвосту запишите положительные свойства галогенов для организма, а на “нижних косточках” – отрицательные.
Опыт и наблюдение - таковы величайшие источники мудрости, доступ к которым открыт для каждого человека.
(Чаннинг.)
Ход урока:
1.Организационный момент
1.Приветсвие учащихся
2.Проверка отсутствующих
2.Изучение новой темы
Как вы уже догадались, сегодня на уроке мы будем изучать элементы 7А группы. Эти элементы называются галогенами. От греч. hals соль и genesis род, происхождение. Данная группа образуют соли при соединении с металлами.
Работать вы будите в группах, проводя независимое расследование по данной теме. Расследование вы будете проводить самостоятельно, по тематическим блокам. Я буду вашим инструктором. В течение изучения новой темы каждая группа будет заполнять карту расследования по данной теме. Вот как она выглядит (демонстрация на интерактивной доске)
Тематические блоки Галогены
1.История открытия
2.Положение в ПС и строение атома
3.Физические и химические свойства
4.Применение
5.Биологическая роль
3.Закрепление
Разгадывание загадок про галогены
1.Окислитель мощный самый,
Он так активен и силен,
Что вытесняет очень славно
Всех окислителей вагон (фтор)
2. Желто-зеленый, ядовитый,
Весьма опасный галоген,
Он очень сильный окислитель,
И удушающий фосген (хлор)
3.У меня дурная слава,
Я известная отрава.
Даже имя говорит,
Что я страшно ядовит! (бром)
4.Он с морской капустой дружит,
И лекарством людям служит.
Знает, млад и стар народ,
Коль ушиб, то нужен… (йод)
5.Домашнее задание
п.8.20-8.23 упр.5 стр.274
Человек рождается на свет,
Чтоб творить, дерзать и не иначе.
Чтоб оставить в жизни добрый след,
И решить все трудные задачи.
Человек рождается на свет…
Для чего? Ищите свой ответ!

Соединения брома и йода хорошо растворяются в воде, поэтому чаще всего они встречаются в водах морей и океанов.
Водоросль ламинария накапливает значительное количество йода

Простые вещества – галогены
Характеристика простых веществ
Агрегатное состояние при обычных условиях
Газ, не сжижается при обычной температуре
Газ, сжижающийся при обычной температуре
Темпера-тура плавления ˚С
Темпера-тура кипения ˚С
Чёрно-фиолетовый с метал-лическим отблеском
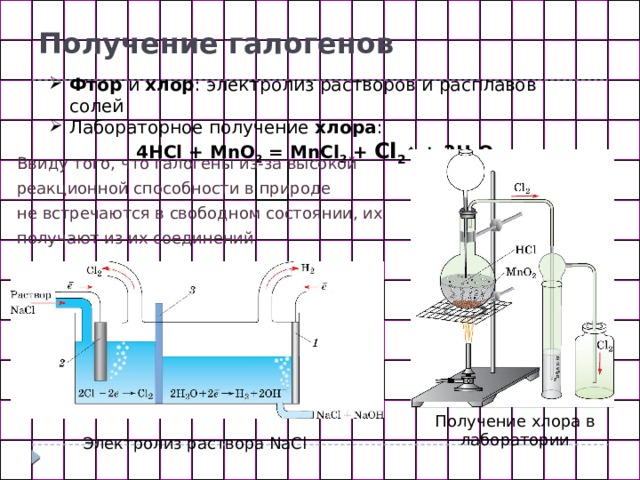
Получение галогенов
- Фтор и хлор : электролиз растворов и расплавов солей
- Лабораторное получение хлора :
4HCl + MnO 2 = MnCl 2 + Cl 2 ↑ + 2H 2 O
Ввиду того, что галогены из-за высокой реакционной способности в природе
не встречаются в свободном состоянии, их получают из их соединений
Получение хлора в лаборатории
Электролиз раствора NaCl

Химические свойства галогенов
Химические свойства
1. Взаимодействие галогенов с металлами с образованием солей - галогенидов :
Йод – более слабый окислитель, поэтому для его реакции с металлами нужно нагревание или присутствие катализатора:
2Al +3I 2 2AlI 3
Порошок сурьмы, попадая в атмосферу хлора, сгорает красивыми искрами-звёздочками:
2Sb + 5Cl 2 = 2SbCl 5
2Fe + 3Cl 2 = 2FeCl 3
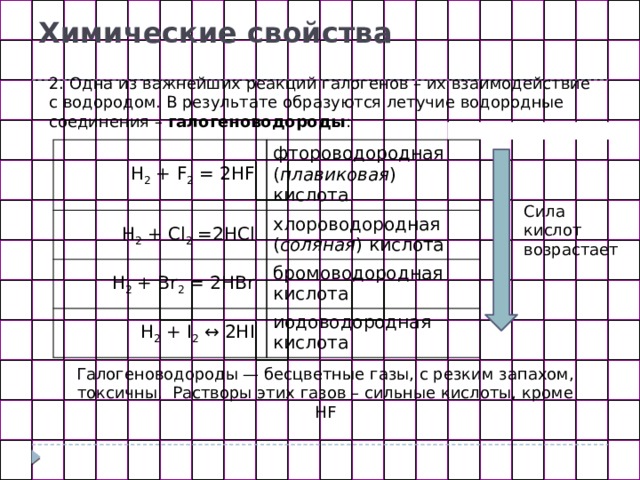
Химические свойства
2. Одна из важнейших реакций галогенов – их взаимодействие с водородом. В результате образуются летучие водородные соединения – галогеноводороды :
фтороводородная ( плавиковая ) кислота
хлороводородная ( соляная ) кислота
H 2 + Br 2 = 2HBr
Сила кислот возрастает
Галогеноводороды — бесцветные газы, с резким запахом, токсичны. Растворы этих газов – сильные кислоты, кроме HF

Химические свойства
3. Реакции взаимного замещения. Бром, как более активный неметалл и более сильный окислитель, способен вытеснить йод из раствора иодидов:
Br 2 + 2KI = 2KBr + I 2
Хлор способен вытеснять как йод, так и бром из растворов солей:
Cl 2 + 2KI = 2KCl + I 2
Cl 2 + 2KBr = 2KCl + Br 2
А вот фтор в подобную реакцию брать нельзя, так как он настолько активен, что реагирует даже с водой:
2F 2 + 2H 2 O = 4HF + O 2

Химические свойства
4. Галогены способны реагировать с растворами щелочей . Состав продуктов реакции зависит от температуры:
Br 2 + 2NaOH NaBr + NaBrO + H 2 O
Br 2 + 6NaOH 5NaBr + NaBrO 3 + 3H 2 O

Применение брома и фтора
2AgBr = 2Ag + Br 2 ↑
Бром имеет важное значение для организма человека. Его соединения регулируют процессы возбуждения и торможения центральной нервной системы.
Бромид серебра используется для применения ч/б пленки.

Применение хлора
В организм хлор поступает в основном
в виде хлорида натрия ( поваренной соли ). Хлорид натрия обеспечивает нормальный обмен веществ , рост волос . В организме взрослого человека содержится около
200 грамм хлорида натрия, причём
45 грамм растворено в крови.

Применение йода
Спиртовой раствор йода широко применяют в медицине для дезинфекции. Пятна йода легко смываются содой или спиртом.
Недостаток йода в организме может привести к заболеваниям щитовидной железы.
Йод окрашивает крахмал в синий цвет - это его качественная реакция

-80%

Общая характеристика неметаллов- элементы VII А группы- солероды.
К ним относятся фтор, хлор, йод, бром, астат. На последнем энергетическом уровне у них 7 электронов, характерная степень окисления-1являются сильным оксилителями.молекулы состоят из 2 атомов.встречаются только в виде соединении.
Закрепление дописать
- Нахождение в природе: только в виде соединении встречаются
- Получение: в промышленности - при электролизе, а в лаборатории- хлор получают 4HCl+MnO2= MnCl2+Cl2+2H2O
Вытеснением из из солей: 2KBr+Cl2= 2KCl+ Br2
- Физические свойства: с увеличением атомных масс возрастает температура кипения, сгущается окраска. Мало растворимы в воде.
- Химические свойства:
Галогены реагируют с:
А) простыми веществами: с металлами, водородом
Б) со сложными веществами: водой, щелочами, галогенидами.
Закрепление: Дописать
5. Применение: в быту и в медицине.
Соединение и их характер: Хлороводород - бесцветный газ, немного тяжелее воздуха с резким запахом, во влажном воздухе дымит, хорошо растворяется в воде. Получают в промышленности сжигаем водорода в хлоре: H2+Cl2= 2HCl, в лаборатории 2NaCl+H2SO4= Na2SO4+ 2 HCl. Используют для получения соляной кислоты. Не реагируют с металлами, ни с оксидами.
Соляная кислота- бесцветный раствор, с резким запахом.
Реагирует с металлами, основным и амфотерным оксидом, с основаниями, солями. Качественная реакция с нитратом серебра.
План учебного занятия № 16
Дата Предмет химия группа
Ф.И.О. преподавателя: Кайырбекова И.А.
І. Тема занятия: Галогены. Общая характристика неметаллов. Элементы VII А группы. Неорганические вещества и охрана окружающей среды.
Тип занятия: лабораторный
Цель: Дать характеристику химическим элементам V ІІ А группы.
А) Образовательные: повторить и систематизировать знания учеников о свойствах химических элементов седьмой группы, о строении атома о применении соединений;
закрепить умение решать расчетные задачи по уравнениям реакций;
Ә) Воспитательные : проводить экологическое воспитание на уроке химии.
Б) Развивающие: продолжить развитие логического мышления, умения использовать теоретические знания в новых ситуациях;
закрепить умения сравнивать, сопоставлять, анализировать;
ІІ. Ожидаемые результаты:
А) Учащиеся должны знать: Характеристику химических элементов V ІІ А группы.
Ә) Учащиеся должны уметь: Уметь описывать и доказывать на примере химические свойства серы
б) учащиеся должны владеть: Познакомить учащихся со строением и общими свойствами неметаллов, исходя из положения их в периодической системе строения атомов
ІІІ. Метод и приемы каждого этапа занятия: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
IV. Средства:интерактивная доска
1.Организационный момент: Проверить посещаемость учащихся. Ознакомить целями урока.
2. Актуализация опорных знании:
Проверка домашнего задания.
Общая характеристика неметаллов- элементы VII А группы- солероды.
К ним относятся фтор, хлор, йод, бром, астат. На последнем энергетическом уровне у них 7 электронов, характерная степень окисления-1являются сильным оксилителями.молекулы состоят из 2 атомов.встречаются только в виде соединении.
Закрепление дописать
Нахождение в природе: только в виде соединении встречаются
Получение: в промышленности - при электролизе, а в лаборатории- хлор получают 4HCl+MnO2= MnCl2+Cl2+2H2O
Вытеснением из из солей: 2KBr+Cl2= 2KCl+ Br2
Физические свойства: с увеличением атомных масс возрастает температура кипения, сгущается окраска. Мало растворимы в воде.
Химические свойства:
Галогены реагируют с:
А) простыми веществами: с металлами, водородом
Б) со сложными веществами: водой, щелочами, галогенидами.
Закрепление: Дописать
5. Применение: в быту и в медицине.
Соединение и их характер: Хлороводород - бесцветный газ, немного тяжелее воздуха с резким запахом, во влажном воздухе дымит, хорошо растворяется в воде. Получают в промышленности сжигаем водорода в хлоре: H2+Cl2= 2HCl, в лаборатории 2NaCl+H2SO4= Na2SO4+ 2 HCl. Используют для получения соляной кислоты. Не реагируют с металлами, ни с оксидами.
Соляная кислота- бесцветный раствор, с резким запахом.
Реагирует с металлами, основным и амфотерным оксидом, с основаниями, солями. Качественная реакция с нитратом серебра.

Положение галогенов в ПСХЭ Д.И. Менделеева, физические и химические свойства, получение, нахождение в природе.
Открытый урок по химии в 9 классе на тему:
Цель урока: На основе положения галогенов в периодической системе элементов рассмотреть и сформировать знания о строении атомов галогенов, свойствах галогенах и их соединений, их применении
Задачи урока:
Воспитательные: воспитание ответственного отношения к учебе, воспитание решительности и смелости при выполнении заданий. Самостоятельности
Планируемые результаты:
1. Предметные:
- находить черты, свидетельствующие об общих признаках химических процессов и их различиях.
– объяснять значение веществ в жизни и хозяйстве человека.
- определять основные классы неорганических веществ;
- понимать смысл химических терминов.
2. Личностные:
- умение формировать высказывания, суждения, делать предложения;
- развитие умственной деятельности: умений обобщать, делать выводы.
3. Метапредметные:
- умение анализировать информацию, делать выводы на основании своих наблюдений;
- формирование устной речи: формулирование вопроса и ответа на вопрос;
- перенесение информации с учебной и справочной литературы в опорную схему;
- владение способами самоконтроля и самооценки;
- умение работать в группе.
Тип урока: комбинированный.
Методы: обьяснительно - иллюстративный, частично - поисковый.
Оборудование: компьютер, мультимедийный проектор, электронная презентация, дидактический материал
1 этап. Организационный момент – 1 мин
Учитель: Доброе утро. Садитесь. Готовьтесь к уроку (наличие учебных принадлежностей).
Работа с дежурным класса (отсутствующие).
2 этап. Актуализация знаний(4-5мин)
Учитель: Ребята, сегодня на уроке мы с вами продолжим знакомство с химическими элементами. Отгадывая загадки, вы определите тему нашего урока.
Фтор:
Я - светло-желтый газ
Во мне горит вода.
Всех, кто стоит мне на пути
Окислю я всегда.
Хлор:
Меня применяли даже в войну,
Я резкий, удушливый газ.
Мой запах и желто-зеленый цвет
Очень опасен для вас!
Бром:
В парах моих сгорает медь
Я бурый, прямо как медведь.
Открыт давно я был Баларом
3 этап. Изучение нового материала - 25 мин
План нашего урока:
Положение в ПСХЭ
История открытия галогенов
Галогены в природе.
Учитель: Мы сейчас рассмотрим положение галогенов в ПСХЭ Менделеева и строение атома.
Перед вами Задание 1. (зашифрованное письмо) В 7-этажном доме на улице имени Д.И. Менделеева в 7 подъезде жили химические элементы – галогены. Расселились они по этажам, соблюдая строгую субординацию и в зависимости от своего богатства и прихотей. Те, которые очень любят полетать – повыше, которым это удается с трудом, расположились на нижних этажах. Но вместе их объединила очень важная особенность.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия. Дайте характеристику по положению в ПСХЭ.
Учащиеся: Галогены расположены в периодической системе Д.И.Менделеева в 7 группе главной подгруппе. Окислительные свойства галогенов возрастают в ряду от астата к фтору. Фтор самый сильный окислитель, астат самый слабый окислитель. Общее у них на внешнем энергетическом уровне по 7 электронов – они все могут проявлять степень окисления -1, т. е принимать один электрон.
Учитель: Давайте рассмотрим строения атома фтора, хлора, брома.
(работают с ПСХЭ, в тетради записывают строение атомов галогенов. У доски один ученик выполняет задание)
Физкультминутка
Учитель: Перед вами Задание 2. Физические свойства (работа с учебником).
Галогены не любят показывать свое лицо, обычно они прячутся за спинами других. Иногда, в экстремальных обстоятельствах, они появляются на свет и тогда все любуются их красивыми нарядами, но при этом страдают от крайне неприятного запаха.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия.
Учащиеся: В этом задании речь идет о физических свойствах галогенов.
Учитель: Все верно, давайте рассмотрим физические свойства галогенов у доски и используя таблицу №7 на стр. 105 учебника.
(Один ученик работает у доски, ему помогает класс)
Учащиеся формулируют вывод: с увеличением молекулярной массы галогена повышается их температура плавления и кипения, возрастает плотность фтор и хлор – газы, бром-жидкость, йод - твердое вещество. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.
“Фторос” - разрушающий. Анри Муассан был удостоен Нобелевской премии за открытие фтора. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз его был закрыт черной повязкой. В истории фтора немало трагических страниц.
“Хлорос” - желто-зеленый, открыл Шееле
“Иодэс” - фиолетовый, открыл Куртуа. Любимый кот ученого прыгнул на бутылки, содержащие золу морских водорослей в спиртовом растворе и концентрированную серную кислоту. Бутылки разбились, жидкости смешались, с пола стали подниматься клубы сине-фиолетового пара, который и оказался иодом.
“Бромос” - зловонный, открыл Балар. Получен при исследовании жидкости из растворенной в воде золы морских водорослей (при пропускании через нее хлора).
Учитель: Ребята, могут галогены в природе встречаться в свободном виде?
Учащиеся: Нет, т.к. у них ярко выражены окислительные свойства, химически очень активны.
Галогены в природе. Слайды №10-11
Учитель: Химическая активность галогенов от фтора к йоду ослабевает.
Переходим к химическим свойствам, более подробно рассмотрим свойства фтора и хлора.
Каждый галоген является самым сильным окислителем в своем периоде, Окислительные свойства отчетливо проявляются при взаимодействии с металлами, при этом, как вы уже знаете, образуются соли. Так, фтор при обычных условиях реагирует с большинством металлов, при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью.
Уравнения реакции приведены в презентации к уроку
Применение галогенов. Слайд №14-17
Биологическое значение. Слайд №18
Получение галогенов. Слайд № 19
4 этап. Закрепление – 10 мин
↓ - По вертикали Вводное слово: Роль галогенов в окислительно-восстановительных реакциях
Читайте также:

