Что такое осадок в химии кратко
Обновлено: 04.07.2024
В химии и металлургии , осадок представляет собой гетерогенную дисперсную фазу в преобладающем фазе. Образование осадка - это выпадение осадка . Этот термин также используется в биохимии для обозначения образования молекулярного агрегата, например антитела , которое оседает (или осаждается при центрифугировании ) на дне пробирки.
В химии это обычно относится к твердому кристаллу соли или молекулярного соединения в жидкости. Две основные ситуации образования осадка: (1) химическая реакция, в которой один из продуктов плохо растворим в реакционном растворителе, или (2) во время изменения температуры. Это определение исключает введение твердого вещества, плохо растворимого в воде, что, тем не менее, рекомендуется в некоторых работах. В металлургии это также может обозначать образование кристалла заданного состава в сплаве. В метеорологии это относится к образованию капель воды или кристаллов льда в атмосфере , см. Осадки .
Резюме
Химический подход
Продукт растворимости
Наличие стабильного осадка является результатом термодинамического равновесия между жидкой фазой ( раствором ) и твердой фазой (солью).
В случае, когда C s увеличивается с повышением температуры, возможно растворение осадка при нагревании, который будет преобразовываться при охлаждении раствора. Если C - концентрация соли, то:
C C > C s ( T ): осаждается соль (насыщение).
Осаждение обозначается как химическое уравнение :
Na + + Cl - ↔ (NaCl) кр
Как и для любой равновесной реакции, мы можем определить константу равновесия K s , называемую произведением растворимости :
K s ( T ) = [Na + ] · [Cl - ] (когда есть осадки)
и потенциал этой постоянной p K s :
Использование K s является более общим, потому что ионы Na + и Cl - могут происходить из нескольких различных солей. Если концентрации выражены в мольных долях , то в данном конкретном случае до выпадения осадков
C = [Na + ] = [Cl - ]
В общем случае есть два иона A m + и B n -, которые могут образовывать соль A n B m ; произведение растворимости записывается:
K s = [A m + ] n [B n - ] m
Механизмы осадков
Использует
Образование осадка может характеризовать присутствие компонента в растворе в аналитической химии . Это также средство разделения частиц, присутствующих в смеси, иона металла для получения металла или частиц, синтезированных из реакционной смеси.
Материальный подход
В металлургии и материаловедении в целом нас интересуют два явления:
- образование первых кристаллов при затвердевании ;
- образование новой твердой фазы, когда человек уже находится в твердой фазе.
В обоих случаях формирование этой гетерогенной фазы происходит в два этапа:
В твердой фазе после роста выделений последние могут продолжать эволюционировать за счет коалесценции. Наконец, существует также особый режим преципитации - спинодальный распад .
Затвердевание
Прорастание
В случае затвердевания прорастание обычно происходит при охлаждении.
Возьмем случай чистого тела. При заданном давлении P ниже заданной температуры T f ( точка плавления , в зависимости от давления) стабильна только твердая фаза, поэтому теоретически температура остается стабильной при T f ( P ), когда вся жидкость затвердевает. (при затвердевании выделяется тепло , скрытая теплота плавления , которая компенсирует снижение температуры).
Фактически, мы наблюдаем переохлаждение : кристаллы, образовавшиеся при T f , растворяются при тепловом перемешивании. Чтобы эти микрокристаллы оставались стабильными, температура должна упасть достаточно сильно; прорастание может быть инициировано внесением модификатора (это зерна или межузельные атомы, внесенные добровольно для ускорения процесса прорастания и придания сплаву большей прочности и твердости; мы также говорим о примесях (зернах другого состава, которые не плавятся и которые будут формируют начало кристаллов)). Эти примеси улучшают характеристики сформированного сплава, потому что они вызывают более высокое образование в некоторых местах зародышей, которые дадут начало зернам.
Термодинамически создание кристалла высвобождает энергию, но также требует ее из-за создания границы раздела твердое тело-жидкость ( поверхностное натяжение ); Чтобы прорастание происходило, оно должно быть термодинамически благоприятным, то есть энергия, выделяемая при расположении атомов, компенсирует поверхностное натяжение.
Твердофазное осаждение
Внутри сплава происходит выделение твердой фазы. Как правило, это основной металл M, содержащий незначительное количество сплава A. Когда концентрация легирующего элемента A низкая, имеется гомогенная фаза, состоящая из твердого раствора A в M (см. Статью Одноразовая неисправность ).
Когда концентрация A превышает предельное значение C s ( T ), образуются кристаллы стехиометрического сплава, обычно упорядоченного, из M и A: M m A a ( m и a являются стехиометрическими пропорциями). При этом сплав обедняется A, поэтому процесс останавливается, когда общая концентрация A в оставшемся M упадет ниже C s ( T ). Если A также является металлом, M m A a называется интерметаллидом .
Если температура повышается и C s ( T ) становится больше, чем концентрация A в фазе M, тогда происходит растворение осадков, все еще находящихся в твердой фазе.
Например, сталь или чугун - это сплав железа, содержащий небольшую долю углерода . При определенных температурных условиях в стали или чугуне могут образовываться выделения карбида Fe 3 C ( цементита ).
На самом деле это явление более сложное, потому что обычно существует несколько легирующих элементов, которые влияют на фазовую стабильность.
Прорастание
Осаждение твердой фазы также происходит при медленном охлаждении ( закалка может предотвратить осаждение).
Как и в случае затвердевания, поверхностное натяжение вызывает прорастание при температуре ниже температуры растворения осадка.
Рост относится к увеличению или увеличению размера кристаллов.
Коалесценция
Подход в биохимии / иммунохимии
Осаждение биомолекул , частиц или клеток , их агрегатов или их комплексов с другими соединениями происходит в результате потери растворимости и увеличения молекулярной массы или веса ( например, образования комплексов антиген / антитело ; агрегации клеток (= агглютинации ); ассоциации частицы и клетки). Это также может быть результатом изменения состава среды (изменение полярности биомолекул или изменение ионной силы) или характеристик биомолекул (потеря или увеличение полярных групп в результате химической реакции).

Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а нерастворимое вещество, уходящее из сферы реакции — в молекулярном виде.
- Получившееся уравнение — полное ионное уравнение реакции :
2 Na + + SO 4 2 − + Ba 2 + + 2 Cl − = BaSO 4 ↓ + 2 Na + + 2 Cl − .
- Если исключить из обеих частей равенства одинаковые ионы, которые не участвуют в реакции, то получится сокращённое ионное уравнение реакции :
Сокращённое ионное уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария Ba 2 + и сульфат-ионов SO 4 2 − , в результате которого образуется осадок сульфата бария BaSO 4 .
Сокращённое ионное уравнение характеризует сущность реакции, показывает, какие ионы реагируют между собой, и какое вещество они образуют в результате ионной реакции.
При этом неважно, в состав каких веществ-электролитов входили эти ионы до реакции. Это могли быть растворы серной кислоты и нитрата бария, или сульфата аммония и хлорида бария и т. д. Сокращённое ионное уравнение реакций этих пар веществ будет иметь вид:
Таким образом, если в любых водных растворах электролитов содержатся ионы бария и сульфат-ионы, то они всегда взаимодействуют между собой, образуя белый осадок сульфата бария.

Как отличить одно сложное вещество от другого, если они внешне выглядят одинаково? Для этого есть качественные реакции, которые также называют аналитическими. Они сопровождаются каким-либо внешним эффектом, по которому и опознают состав вещества. В этом материале мы рассмотрим качественные реакции органических и неорганических соединений.
О чем эта статья:
Что такое качественная реакция
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.

Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
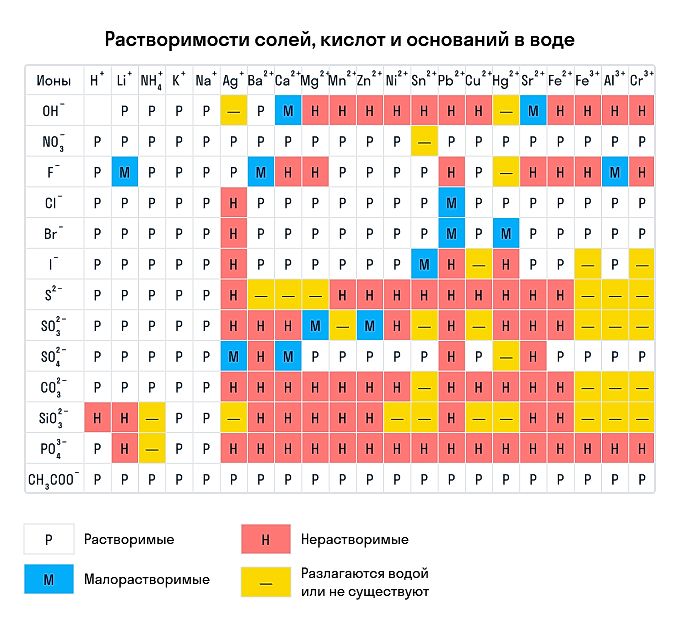
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).

Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).

Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.

1. Мельчайшие частицы какого-л. вещества, выделившиеся из раствора, жидкости и осевшие на дно. Осадок в растительном масле. Дать осадок. □ Вода [в ведре] была мутная, с желтым осадком — в нее нападала глина с потолка. Симонов, Живые и мертвые.
2. перен. Тяжелое, неприятное чувство, остающееся после какого-л. разговора, события и т. п. Я и сам не знаю, откуда взялся в моей душе этот едва заметный, но горький осадок разочарования? Куприн, Прапорщик армейский. Разговор этот [с Евдокией] оставил в душе Быланина неприятный осадок. Наседкин, Большая семья.
3. обычно мн. ч. (оса́дки, -ов). Геол. Горные породы, образовавшиеся на дне ранее существовавших водоемов путем осаждения минеральных и органических веществ; осадочные горные породы.
4. мн. ч. (оса́дки, -ов). Атмосферная влага, выпадающая на землю в виде дождя, снега, росы и т. п. Атмосферные осадки. Среднегодовое количество осадков.
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
ОСА'ДОК, дка, м. 1. Посторонняя примесь к жидкости в виде мельчайших твердых частиц, опускающаяся на дно или на стенки сосуда. Вода дала о. || Нерастворимое вещество, выделившееся из раствора в результате химической реакции. Белый о. 2. перен. Тяжелое чувство, остающееся в памяти после каких-н. событий. В душе был страшный осадок. Л. Тлстй. 3. только мн. Атмосферная влага, падающая на землю в виде дождя, снега. Обильные осадки. 4. чаще мн. Отложения на дне ранее существовавших водоемов, образовавшие горные, т. наз. осадочные, породы (геол.).
оса́док I
Фразеологизмы и устойчивые сочетания
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Читайте также:

