Что такое изотопы кратко
Обновлено: 07.07.2024
В постиндустриальную эпоху развития человечества все больше стало отдавать предпочтение новым технология получения энергии. Изотопы являются субстратом в энергетическом производстве (топливный компонент ядерного реактора). Также данные видоизменные химические атомы используются и других областях человеческой деятельности: медицина, патологическая физиология, отрасль изготовление ядерного оружия.
- Что такое изотоп?
- Обозначения изотопов
- Изотопы водорода
- Изотопы урана
- Нуклиды
- Изотопы галлия
- Превращения изотопов
- Применение радиоактивных изотопов
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
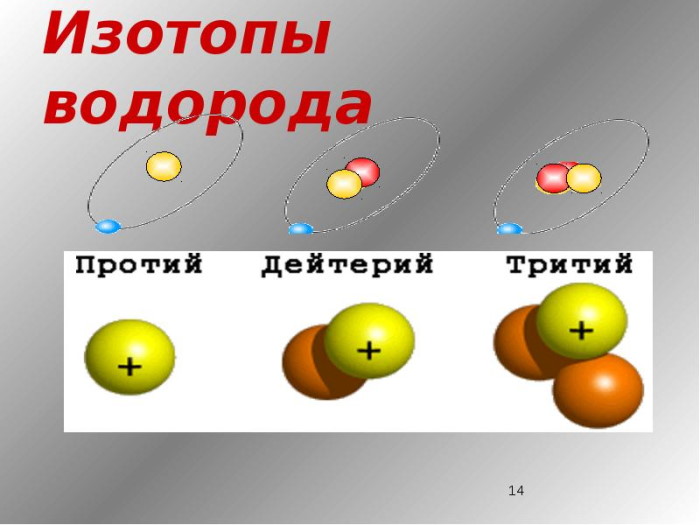
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
В природе чаще всего встречается протий (в 99,98 процентах случаев), именно поэтому среднее массовое число водорода будет равняться приблизительно 1 а.е.м. Стоит, отметить, что бета-распад трития составляет порядка 12 лет, после чего он переходит в форму Гелий - 3.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Изотопные атомные урана с массовыми числами 235 и 238 представляют собой основной компонент для производства плутония – 239 (основного компонента ядерного оружия и ядерного топлива для реакторов нового поколения).
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
Изотопный ряд галлия представлен элементами, обладающими промежутком массовых числен от 49 а.е.м. до 71 а.е.м. Наиболее часто в природе встречаются следующие изотопные атомы: галлий – 69, галлий -71. Природный галлий обычно представлен смесью двух данных видоизмененных атомов, имеющих малый период полураспада (порядка 68 минут). Для представителей изотопного ряда галлия характерные следующие виды ядерных превращений:
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
Ясное дело, химикам и физикам это лучше не читать. Объяснения в статье примитивные, со множеством допущений, рассчитанные на людей, далеких от науки.
Итак, изотоп. Лучше всего рассматривать его на примере водорода – самого распространенного во Вселенной элемента, занимающего первый атомный номер в периодической таблице.
Протоны имеют положительный заряд, электроны – отрицательный, а нейтроны – нейтральны. Поэтому атом электрически нейтрален тогда, когда число протонов и электронов совпадает. В противном случае этот атом будет называться ионом. Протоны и нейтроны в ядре связаны сильным взаимодействием – одним из самых сильных в природе.
Мы договорились рассматривать изотопы на примере водорода. Водород выглядит намного проще, чем верхний рисунок: он имеет один-единственный протон, вокруг которого по орбите движется электрон (даже нейтрона у него нет):
Изотопы – это те вещества, у которых атомы имеют одинаковое число протонов и электронов, а отличаются лишь числом нейтронов. Атомный номер элемента при этом не меняется, ведь число протонов остается то же самое. Но меняется массовое число – так как нейтроны добавляют массу атому.
Давайте добавим к нашему простейшему водороду один нейтрон. Теперь водород выглядит так:
С точки зрения химика ничего не изменилось, остался прежний водород с его химическими свойствами. И остался этот наш водород по-прежнему в первой ячейки периодической системы. А вот с физической точки зрения есть большая разница: это самый настоящий изотоп. С точки зрения изотопов простейший водород (без нейтрона) также является изотопом и называется протием. Водород с одним нейтроном называется дейтерием, а с двумя нейтронами – тритием:
Тритий нестабилен и распадается в течение 12,3 лет. Изотопы водорода с большим количеством нейтронов (квадий, пентий и пр.) в природе устойчиво не существуют, так как распадаются за мельчайшие доли секунды.
Кроме водорода множество других химических элементов имеют изотопы. Они бывают радиоактивные (в которых ядра атомов крайне нестабильны и распадаются с испусканием частиц), а бывают стабильные, которые распадаются миллионы лет. На сегодня известно более 2000 нестабильных изотопов и около 270 стабильных. Атомное ядро не может содержать произвольное количество нейтронов, делающих вещество изотопом, поэтому количество изотопов не бесконечно.
Для чего нам нужны изотопы? Для огромного количества самых разных задач, в том числе биологических, агрохимических, медицинских, научных. Так, например, наверняка все слышали про радиоуглеродный анализ, позволяющий определить возраст биологических останков. Дело в том, что один из изотопов углерода 14С содержится в большом количестве в атмосфере, имеет период полураспада 5600 лет и активно участвует в углеродном обмене со всеми живыми организмами. После гибели организма данный изотоп начинает постепенно распадаться. Зная примерное содержание изотопа в организме и измерив его активность можно с большой точностью определить время смерти организма.
Широко применяются изотопы и в медицинских средствах инструментальной диагностики.
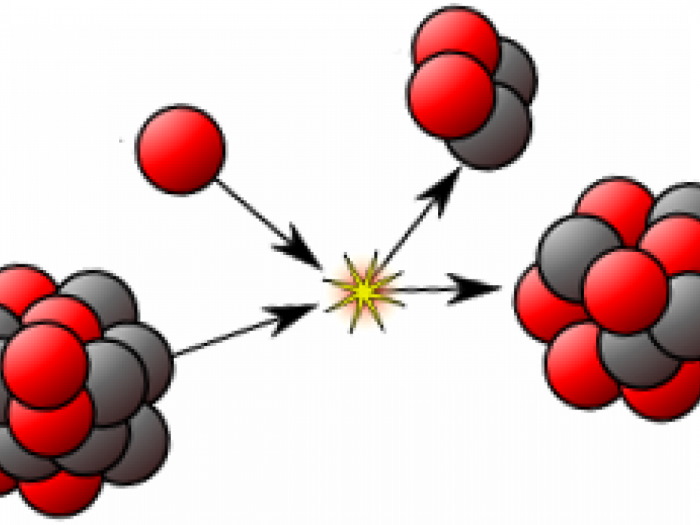
Разумеется, изотопы применяются в ядерном оружии. Например, в водородной бомбе происходит практически мгновенная реакция синтеза уже упомянутых дейтерия и трития в более тяжелые элементы.
Итак, что необходимо запомнить? Что изотопы – это вещества, в атомном ядре которого находится различное количество нейтронов.
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение A X.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2 H и 3 H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1 H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка.
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов.
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Применение изотопов.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
Пример изотопов: 16 8 O, 17 8 O, 18 8 O — три стабильных изотопа кислорода.
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
В технологической деятельности люди научились изменять изотопный состав элементов для получения каких-либо специфических свойств материалов. Например, 235 U способен к цепной реакции деления тепловыми нейтронами и может использоваться в качестве топлива для ядерных реакторов или ядерного оружия. Однако в природном уране лишь 0,72 % этого нуклида, тогда как цепная реакция практически осуществима лишь при содержании 235 U не менее 3 %. В связи с близостью физико-химических свойств изотопов тяжёлых элементов, процедура изотопного обогащения урана является крайне сложной технологической задачей, которая доступна лишь десятку государств в мире. Во многих отраслях науки и техники (например, в радиоиммунном анализе) используются изотопные метки.
Изотопы 60 Co и 137 Cs используются в стерилизации Υ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 мкГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится). [1]

Тема урока - "Состав атомных ядер. Изотопы". Мы повторим, что собой представляет элементарная модель атома, ее строение, похожее на нашу Солнечную систему. Узнаем, в каком году физики узнали на опыте Резерфорда, из чего на самом деле состоит атомное ядро, его плотность, как можно получить новый элемент путем добавления к нему протона.
Читайте также:

