Что такое электропроводность в химии кратко
Обновлено: 03.07.2024
Атомы химических элементов, входящих в состав любого вещества, состоят из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Атомы обычно электрически нейтральны, так как заряд ядра равен сумме зарядов окружающих его электронов.
Если от нейтрального атома (молекулы) отделяется электрон, то атом превращается в положительный ион. Отделившийся от атома электрон присоединяется к другому нейтральному атому, образуя отрицательный ион, или остается свободным.
Такие свободные электроны называют электронами проводимости, а процесс образования ионов — ионизацией. Количество свободных электронов или ионов в единице объема вещества называется концентрацией носителей электрического заряда ().
В веществе, помещенном в электрическом поле, под действием сил ноля возникает направленное движение электронов проводимости или ионов, называемое электрическим током. Свойство вещества создавать электрический ток под действием электрического поля называется электропроводностью вещества. Степень электропроводности оценивается удельной электрической проводимостью материала (см. § 2-3). Электрическая проводимость вещества (тела) зависит от концентрации носителей заряда. При высокой концентрации проводимость вещества больше, чем при малой. Все вещества в зависимости от электрической проводимости делятся на проводники, диэлектрики (электроизоляционные материалы) и полупроводники.
Проводники обладают высокой проводимостью, к ним относятся металлы и их сплавы, уголь, электролиты (водные растворы солей, кислоты щелочей) и расплавы.
Диэлектрики, наоборот, обладают ничтожной проводимостью. К ним относятся газы, минеральные масла, лаки и большое число твердых неметаллических тел.
Полупроводники обладают промежуточной проводимостью между проводниками и диэлектриками. К ним относятся такие металлы, как кремний, германий, селен, окислы металлов и др.
Каждый электрон в атоме может обладать только определенными значениями энергии, т. е. находиться только в разрешенных энергетических состояниях или уровнях, так как изменение энергии электрона может происходить только определенными порциями - квантами. Переход электрона на более высокий энергетический уровень, т. е. на более удаленную орбиту, требует затраты энергии на преодоление притяжения электрона к ядру. Таким образом, более удаленные от ядра электроны обладают большими энергиями. Переход электрона на более низкий уровень сопровождается излучением энергии атомом.
В твердых веществах, образованных совокупностью атомов, вследствие взаимного влияния соседних атомов энергетические уровни несколько изменяются, образуя энергетические зоны.
Эти зоны отделяются областями, в которых электроны не могут находиться, называемыми запрещенными зонами.
Энергетические зоны, соответствующие разрешенным уровням, делятся на заполненную и свободную. Для возникновения электропроводности необходимо части электронов заполненной зоны перейти в свободную зону. Возможность такого перехода определяется шириной запрещенной зоны, пропорциональной энергии, которую необходимо затратить для указанного перехода электронов.
Различие электрической проводимости проводников, полупроводников и диэлектриков вызывается особенностями их строения. Согласно зонной теории твердого тела у металлических проводников высокая электрическая проводимость обусловливается тем, что заполненная зона вплотную прилегает к свободной зоне (рис. 1-3, а).
Рис. 1-3. Энергетические уровни. а — проводник; б — диэлектрик; в — полупроводник; 1 — свободная зона; 2 — аапрещеннан зона; 3 — заполненная зона.
Вследствие этого электроны в металле могут переходить с уровней заполненной зоны на уровни свободной зоны. Иначе говоря, электроны могут с менее удаленных от ядра орбит переходить на более удаленные орбиты или покидать пределы атома проводника, становясь свободными. Легко возникающая значительная концентрация электронов и обеспечивает большую электрическую проводимость проводников.
При электрическом напряжении, приложенном к концам металлического проводника, в нем возникает электрическое поле. Под влиянием сил этого поля движение свободных электронов упорядочивается, и они дрейфуют в направлении, противоположном направлению поля (так как имеют отрицательный заряд), т. е. в проводнике возникает электрический ток.
Если у данного вещества свободная зона отделена от заполненной (рис. 1-3, б) достаточно широкой запрещенной зоной, то последняя делает практически невозможным переход электронов в свободную зону.
Таким образом, как концентрация свободных электронов, так и проводимость вещества будут ничтожно малы и, следовательно, это будет диэлектрик.
У полупроводников ширина запрещенной зоны значительно уже, чем у диэлектриков (рис. 1-3, б). Следовательно, для перехода электронов в свободную зону требуется небольшое возбуждение, например за счет усиления теплового движения атомов при повышении температуры, в связи с чем полупроводники обладают проводимостью, имеющей промежуточное значение между проводимрстью проводников и диэлектриков.
Проводники, в которых электрический ток создается перемещением одних электронов, называются проводниками с электронной проводимостью или проводниками первого рода. Основными представителями их являются металлы и их сплавы.
Проводники, в которых электрический ток создается перемещением положительных и отрицательных иоиов, называются проводниками с ионной проводимостью или проводниками второго рода — это электролиты, к которым относятся водные растворы кислот, солей и щелочей.
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ, способность электролитов проводить электрич. ток при приложении электрич. напряжения. Носителями тока являются положительно и отрицательно заряженные ионы - катионы и анионы, к-рые существуют в р-ре вследствие электролитич. диссоциации. Ионная электропроводность электролитов, в отличие от электронной, характерной для металлов, сопровождается переносом в-ва к электродам с образованием вблизи них новых хим. соед. (см. Электролиз). Общая (суммарная) проводимость состоит из проводимости катионов и анионов, к-рые под действием внешнего электрич. поля движутся в противоположных направлениях. Доля общего кол-ва электричества, переносимого отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих в переносе, равна единице.
Количественно электропроводность электролитов характеризуют эквивалентной электропроводностью - проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина связана с уд. электропроводностью соотношением:
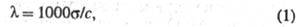
где с - концентрация р-ра в г-экв/л. Эквивалентная электропроводность зависит от природы растворенного в-ва и р-рителя, структуры р-ра, а также от концентрации, т-ры, давления. Предельно разбавленному р-ру, в к-ром все молекулы диссоциированы на ионы, соответствует предельное значение В соответствии с Кольрауша закономравна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в р-ре и характеризует подвижность иона в р-ре.
Описание концентрац. зависимостикак и других св-в р-ров электролитов (см. Растворы электролитов), обычно базируется на ионном подходе, в рамках к-рого р-ритель рассматривается как бесструктурная диэлектрич. среда, в к-рой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком р-рителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в р-ре определяется ур-нием Стокса (см. Вискозиметрия). В рамках применимости этого ур-ния выполняется правило Вальдена-Писаржевского, в соответствии с к-рым для одного и того же электролита в любых р-рителях произведение предельного значения эквивалентной электропроводности на вязкость р-рителя является постоянной величиной, к-рая не зависит от природы р-рителя, но является ф-цией т-ры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение уменьшается в осн. в р-рах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. Электролитическая диссоциация).
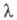
В р-рах сильных электролитов концентрац. зависимость определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, к-рая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера:
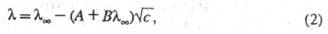
где А и В - эмпирич. постоянные, являющиеся ф-циями т-ры, вязкости и диэлектрич. проницаемости р-рителя.
Как и теория Дебая-Хюккеля, ур-ние Онсагера ограничено областью умеренно разбавленных р-ров. Для описания концентрир. р-ров возникает необходимость в учете некулоновской части межионного взаимод., в частности в учете ионных размеров. Для этой цели применяют методы кинетич. теории ионных систем. К дополнит. уменьшению приводит образование ионных ассоциатов - пар, тройников и т. п., к-рое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в р-ре. Для учета этого эффекта в ур-нии Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов (- степень электролитич. диссоциации), что приводит к ур-нию Фуосса-Онсагера:
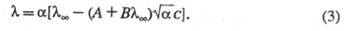
В переменных электрич. полях при достаточно высокой частоте ион не уходит далеко от центра ионной атмосферы, вследствие чего она не деформируется. Обусловленный деформацией релаксац. эффект не возникает, что приводит к увеличению-т.наз. эффект Дебая-Фалькенхагена. Величина возрастает также в постоянных электрич. полях достаточно высокой напряженности (10 4 -10 5 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате стремится к предельному значению (т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов.
Влияние т-ры и давления на электропроводность электролитов обусловлено изменением предельного значения вследствие изменения структуры р-рителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма электропроводности электролитов в широкой области концентраций, т-р и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)= и автокорреляц. ф-цию с помощью соотношения:

где- кол-во ионов электролита в единице объема р-ра, е -элементарный электрич. заряд, - приведенная масса катиона и аниона, za - степень окисления иона сорта a, vа(t) - его скорость в момент времени t.
Специфич. механизм электропроводности характерен для к-т и оснований, содержащих соотв. ионы Н + и ОН - , к-рые в водных р-рах (или других протонных р-рителях) имеют подвижность на порядок больше остальных ионов. Для объяснения аномально высокой проводимости ионов Н + и ОН - предполагается, что под влиянием электрич. поля протоны перемещаются не только путем миграции, но и по механизму протонного обмена, включающему перенос протона в кислой среде от ионов гидроксония Н3О + к молекуле воды, а в щелочной - от молекулы воды к иону ОН - .
Эксперим. изучение электропроводности электролитов- важное направление физико-химического анализа, поскольку зависимость электропроводности электролитов от состава р-ра позволяет судить о концентрации солей, качественный, состав к-рых известен (см. также Кондуктометрия). Измерения l используют для определения подвижностей ионов.
Лит.: Скорчеллетти В. В., Теоретическая электрохимия, 4 изд., Л., 1974; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976; Эрдеи-Груз Т., Явления переноса в водных растворах, пер. с англ., М., 1976. См. также лит. к ст. Растворы электролитов.
Почему медь проводит электричество лучше, чем вода? Прочитав эту статью, вы больше не будете задавать себе больше этот вопрос. Далее мы обсудим электропроводность и рассмотрим формулы, которые описывают это понятие. Наконец, вы можете проверить свои знания на двух примерах.
Простое объяснение.
Электропроводность — это физическая величина, которая описывает насколько хорошо определенный материал проводит электричество.
Формулы
Существует три различных формульных обозначения удельной электропроводности σ (греч. сигма), k (каппа) и γ (гамма). В дальнейшем мы будем использовать σ. Формула электропроводности, также называемой удельной электропроводностью, описывается формулой:
σ = 1 / ρ .
Здесь ρ называется удельным сопротивлением. Вы можете рассчитать электрическое сопротивление R проводника с учетом его параметров следующим образом: R = ( ρ * l ) / S .
Таким образом, сопротивление R равно удельному сопротивлению ρ , умноженному на длину проводника l, деленному на площадь поперечного сечения S. Если теперь вы хотите выразить эту формулу через удельную электропроводность σ = 1 / ρ , полезно знать, что электрическая проводимость G проводника выражается следующим образом: G = 1 / R .
Если в верхнюю формулу подставить удельную электропроводность σ и электрическую проводимость G, то получится следующее: 1 / G = ( 1 / σ ) * ( l / S ) .
Путем дальнейшего преобразования можно получить выражение: G = σ * S / l .
С помощью электропроводности можно также описать важную зависимость между плотностью электрического тока и напряженностью электрического поля с помощью выражения: J = σ * E .
Единица измерения
Единицей удельной электропроводности σ в СИ является: [ σ ] = 1 См/м ( Сименс на метр ).
Эти единицы определяются по формуле G = σ * S / l . Если решить эту формулу в соответствии с σ, то получим σ = G * l / S .
Единица измерения электрической проводимости G задается как: [ G ] = 1 / σ = 1 См ( Сименс, международное обозначение: S ).
Если теперь ввести в формулу все единицы измерения, то получится:
[ σ ] = 1 См * 1 м / м 2 = 1 См / м .
Вы также будете чаще использовать единицы измерения См / см , м / Ом * мм 2 или См * м / мм 2 . Вы можете преобразовать отдельные измеряемые переменные так: См / см = См / 10 -2 м и так: м / Ом * мм 2 = См * м / мм 2 = См * м / 10 -3 м * 10 -3 м = 10 6 См / м .
Электропроводность металлов
В зависимости от количества свободно перемещающихся электронов один материал проводит лучше, чем другой. В принципе, любой материал является проводящим, но в изоляторах, например, протекающий электрический ток ничтожно мал, поэтому здесь мы говорим о непроводниках.
В металлических связях валентные электроны, т.е. крайние электроны в атоме, свободно подвижны. Они расположены в так называемой полосе проводимости. Находящиеся там электроны образуют так называемый электронный газ. Соответственно, металлы являются сравнительно хорошими проводниками. Если теперь подать электрическое напряжение на металл, валентные электроны медленно движутся к положительному полюсу, потому что он их притягивает.

Рис. 1. Движение электронов в металле
На рисунке 1 видно, что некоторые электроны не могут быть притянуты непосредственно к положительному полюсу, потому что на пути стоит, так сказать, твердое атомное ядро. Там они замедляются и в некоторой степени отклоняются. Именно поэтому электроны не могут ускоряться в металле бесконечно, и именно так возникает удельное сопротивление или электропроводность.
Теперь вы также можете измерить удельную электропроводность в металле с помощью следующей формулы: σ = ( n * e 2 * τ ) / m .
В этой формуле n означает число электронов, e — заряд электрона, m — массу электрона, а τ — среднее время полета электрона между двумя столкновениями.
Таблица удельной электропроводности
Для большинства веществ уже известны значения удельной электропроводности. Некоторые из них вы можете найти в следующей таблице ниже. Все значения в этой таблице действительны для комнатной температуры, т.е. 25°C.
| Вещество | Удельная электропроводность в См / м |
| Серебро | 62 · 10 6 |
| Медь | 58 · 10 6 |
| Золото | 45,2 · 10 6 |
| Алюминий | 37,7 · 10 6 |
| Вольфрам | 19 · 10 6 |
| Латунь | 15,5 · 10 6 |
| Железо | 9,93 · 10 6 |
| Нержавеющая сталь (WNr. 1,4301) | 1,36 · 10 6 |
| Германий (легирование -9 ) | 2 |
| Кремний (легирование -12 ) | 0,5 · 10 -3 |
| Морская вода | примерно 5 |
| Водопроводная вода | примерно 0,05 |
| Дистиллированная вода | 5 · 10 -6 |
| Изолятор | обычно -8 |
Удельная электропроводность сильно зависит от температуры, поэтому указанные значения применимы только при 25°C. При повышении температуры вибрация решетки в веществе становится выше. Это нарушает поток электронов, и поэтому электропроводность уменьшается с ростом температуры.
Из таблицы видно, что медь имеет вторую по величине электропроводность, поэтому медные кабели очень часто используются в электротехнике. Серебро обладает еще более высокой проводимостью, но стоит намного дороже меди.
Интересно также сравнение между морской и дистиллированной водой. Здесь электропроводность возникает благодаря растворенным в воде ионам. Морская вода имеет очень высокую долю соли, которая растворяется в воде. Эти ионы передают электрический ток. В дистиллированной воде нет растворенных ионов, поэтому в ней практически не может протекать электрический ток. Поэтому электропроводность морской воды намного выше, чем дистиллированной.
Примеры задач
Для более детального рассмотрения приведём два примера расчетов.
В первой задаче представьте, что у вас есть провод длиной 2 м с поперечным сечением 0,5 мм 2 . Электрическое сопротивление провода при комнатной температуре составляет 106 мОм. Из какого материала изготовлен провод?
Решение данной задачи можно найти с помощью формулы: R = ( 1 / σ ) * ( l / S ). Из этой формулы найдём σ = l / ( S * R ) .
Теперь вы можете вставить заданные значения, убедившись, что вы перевели сечение в м 2 .
σ = l / ( S * R ) = 2 м / ( ( 0,5 * 10 -6 м 2 ) * ( 1 / 106 * 10 -3 Ом ) ) = 37, 7 * 10 6 См / м .
Наконец, вы ищите в таблице, какой материал имеет удельную электропроводность σ = 37, 7 * 10 6 См / м и приходите к выводу, что провод сделан из алюминия.
В задаче 2 вам дано только удельное сопротивление образца с 735 * 10 -9 Ом * м. Из какого материла изготовлен образец?
Вы можете использовать формулу σ = 1 / ρ для расчёта удельной электропроводности. После подстановки значений в эту формулу вы получите: σ = 1 / ρ = 1 / 735 * 10 -9 Ом * м = 1,36 * 10 6 См / м .
Если вы снова заглянете в таблицу, то обнаружите, что образец должен быть изготовлен из нержавеющей стали.
Проводимость (или же удельная проводимость) из электролит решение - это мера его способности проводит электричество. В SI единица проводимости Сименс на метр (См / м).
Измерения электропроводности обычно используются во многих промышленных и относящийся к окружающей среде приложений как быстрый, недорогой и надежный способ измерения содержания ионов в растворе. [1] Например, измерение электропроводности продукта - это типичный способ мониторинга и постоянного отслеживания характеристик очистка воды системы.
Во многих случаях проводимость напрямую связана с общее количество растворенных твердых веществ (Т.Д.С.). Высококачественная деионизированная вода имеет проводимость около 0,5 мкСм / см при 25 ° C, типичная питьевая вода находится в диапазоне 200-800 мкСм / см, а морская вода - около 50 мСм / см. [2] (или 50 000 мкСм / см). Электропроводность традиционно определяется путем подключения электролита в Мост Уитстона. Далее следуют разбавленные растворы Кольрауша Законы концентрационной зависимости и аддитивности ионных вкладов. Ларс Онсагер дал теоретическое объяснение закона Кольрауша, расширив Теория Дебая-Хюккеля.
Содержание
Единицы
В SI единица проводимости S/ м и, если не указано иное, относится к 25 ° C. Чаще встречается традиционная единица измерения мкСм / см.
Преобразование проводимости в общее количество растворенных твердых веществ зависит от химического состава образца и может варьироваться от 0,54 до 0,96. Как правило, преобразование выполняется, предполагая, что твердым веществом является хлорид натрия, т.е. 1 мкСм / см в этом случае эквивалентно примерно 0,64 мг NaCl на кг воды.
Молярная проводимость выражается в единицах СИ См · м. 2 моль −1 . В более старых публикациях используется единица Ω −1 см 2 моль −1 .
Измерение

В электрическая проводимость решения электролит измеряется путем определения сопротивление раствора между двумя плоскими или цилиндрическими электроды разделены фиксированным расстоянием. [3] Переменное напряжение используется во избежание электролиз. [ нужна цитата ] Сопротивление измеряется измеритель проводимости. Типичные используемые частоты находятся в диапазоне 1–3 кГц. Зависимость от частоты обычно невелика, [4] но может стать заметным на очень высоких частотах, эффект, известный как Эффект Дебая – Фалькенхагена.
На рынке имеется широкий выбор инструментов. [5] Чаще всего используются два типа электродных датчиков: электродные датчики и индуктивные датчики. Электродные датчики со статической конструкцией подходят для низкой и умеренной проводимости и существуют в различных типах, с 2 или 4 электродами, где электроды могут быть расположены напротив друг друга, плоские или в цилиндре. [6] Электродные ячейки с гибкой конструкцией, в которой расстояние между двумя противоположно расположенными электродами может варьироваться, обеспечивают высокую точность и могут также использоваться для измерения высокопроводящих сред. [7] Индуктивные датчики подходят для жестких химических условий, но требуют большего объема пробы, чем электродные датчики. [8] Датчики проводимости обычно калибруются растворами KCl известной проводимости. Электролитическая проводимость сильно зависит от температуры, но многие коммерческие системы предлагают автоматическую температурную коррекцию. Таблицы эталонных проводимостей доступны для многих распространенных решений. [9]
Определения
Сопротивление, р, пропорциональна расстоянию, л, между электродами и обратно пропорциональна площади поперечного сечения образца, А (отметил S на рисунке выше). Запись ρ (rho) для удельного сопротивления (или удельное сопротивление),
На практике ячейка проводимости откалиброванный используя растворы с известным удельным сопротивлением ρ * , поэтому количества л и А нет необходимости знать точно. [10] Если сопротивление калибровочного раствора равно р * , константа ячейки, C, выводится.
Удельная проводимость (проводимость) κ (каппа) обратно пропорциональна удельному сопротивлению.
Проводимость также зависящий от температуры.Иногда соотношение л и А называется постоянной ячейки и обозначается G * , а проводимость обозначена как G. Тогда удельную проводимость κ (каппа) удобнее записать как
Теория
Удельная проводимость раствора, содержащего один электролит, зависит от концентрации электролита. Следовательно, удобно разделить удельную проводимость на концентрацию. Этот коэффициент, называемый молярная проводимость, обозначается Λм
Сильные электролиты
Сильные электролиты предположительно диссоциировать полностью в растворе. Электропроводность раствора сильного электролита при низкой концентрации следует Закон Кольрауша
Однако по мере увеличения концентрации проводимость больше не увеличивается пропорционально. Более того, Кольрауш также обнаружил, что предельная проводимость электролита;
В следующей таблице приведены значения предельной молярной проводимости для некоторых выбранных ионов. [11]
| Таблица предельных значений ионной проводимости в воде при 298 K (прибл.25 ° C) [11] | |||||||
|---|---|---|---|---|---|---|---|
| Катионы | λ < displaystyle lambda>+ о / РС ⋅ < displaystyle cdot>м 2 ⋅ < displaystyle cdot>моль −1 | Катионы | λ < displaystyle lambda>+ о / РС ⋅ < displaystyle cdot>м 2 ⋅ < displaystyle cdot>моль −1 | Анионы | λ < displaystyle lambda>− о / РС ⋅ < displaystyle cdot>м 2 ⋅ < displaystyle cdot>моль −1 | Анионы | λ < displaystyle lambda>− о / РС ⋅ < displaystyle cdot>м 2 ⋅ < displaystyle cdot>моль −1 λ |
| ЧАС + | 34.982 | Ба 2+ | 12.728 | − ОЙ | 19.8 | ТАК4 2− | 15.96 |
| Ли + | 3.869 | Mg 2+ | 10.612 | Cl − | 7.634 | C2О4 2− | 7.4 |
| Na + | 5.011 | Ла 3+ | 20.88 | Br − | 7.84 | HC2О4 − | 40.2 . [ требуется проверка ] |
| K + | 7.352 | Руб. + | 7.64 | я − | 7.68 | HCOO − | 5.6 |
| NH4 + | 7.34 | CS + | 7.68 | НЕТ3 − | 7.144 | CO3 2− | 7.2 |
| Ag + | 6.192 | Быть 2+ | 4.50 | CH3COO − | 4.09 | HSO3 2− | 5.0 |
| Ca 2+ | 11.90 | ClO4 − | 6.80 | ТАК3 2− | 7.2 | ||
| Co (NH3)6 3+ | 10.2 | F − | 5.50 | ||||
Интерпретация этих результатов была основана на теории Дебая и Хюккеля, что привело к теории Дебая-Хюккеля-Онзагера: [12]
куда А и B являются константами, которые зависят только от известных величин, таких как температура, заряды ионов и диэлектрическая постоянная и вязкость растворителя. Как следует из названия, это расширение Теория Дебая-Хюккеля, из-за Онсагер. Это очень удачно для растворов с низкой концентрацией.
Слабые электролиты
Типичные слабые электролиты: слабые кислоты и слабые базы. Концентрация ионов в растворе слабого электролита меньше, чем концентрация самого электролита. Для кислот и щелочей концентрации можно рассчитать, если значение (а) константа диссоциации кислоты(а) известно (являются).
Для монопротовая кислота, HA, подчиняющаяся закону обратного квадратного корня, с константой диссоциации Kа, явное выражение для проводимости как функции концентрации: c, известный как Закон Оствальда о разбавлении, может быть получен.
Различные растворители демонстрируют одинаковую диссоциацию, если отношение относительных диэлектрических проницаемостей равно отношению кубических корней концентраций электролитов (правило Вальдена).
Более высокие концентрации
Как закон Кольрауша, так и уравнение Дебая-Хюккеля-Онзагера нарушаются, когда концентрация электролита увеличивается выше определенного значения. Причина этого в том, что по мере увеличения концентрации среднее расстояние между катионом и анионом уменьшается, так что межионное взаимодействие усиливается. Является ли это ионная ассоциация это спорный вопрос. Однако часто предполагалось, что катион и анион взаимодействуют с образованием ионная пара. Таким образом, электролит рассматривается как слабая кислота и постоянный ток. K, можно вывести для равновесной
А + + B − ⇌ А + B − ; K = [A + ] [B − ] / [A + B − ]
Существование так называемого минимум проводимости в растворителях, имеющих относительная диэлектрическая проницаемость до 60 лет оказался спорным предметом в плане интерпретации. Фуосс и Краус предположили, что это вызвано образованием ионных триплетов, [15] и это предложение недавно получило некоторую поддержку. [16] [17]
Другие разработки по этой теме были выполнены Теодор Шедловский, [18] Э. Питтс, [19] Р. М. Фуосс, [20] [21] Фуос и Шедловский, [22] Фуосс и Онсагер. [23] [24]
Системы смешанных растворителей
Предельная эквивалентная проводимость растворов на основе смешанных растворителей, таких как водный спирт, имеет минимальные значения в зависимости от природы спирта. Для метанола минимум составляет 15 мол.% Воды, [18] [25] [26] и для этанола в количестве 6 мол.% воды. [27]
Проводимость в зависимости от температуры
Изотопный эффект растворителя
Изменение проводимости из-за изотопный эффект для дейтерированных электролитов значительна. [28]
Приложения
Несмотря на сложность теоретической интерпретации, измеренная электропроводность является хорошим индикатором наличия или отсутствия проводящих ионов в растворе, и измерения широко используются во многих отраслях промышленности. [29] Например, измерения электропроводности используются для контроля качества воды в коммунальном водоснабжении, больницах, котельной и других отраслях промышленности, которые зависят от качества воды, например в пивоварении. Этот тип измерения не зависит от ионов; иногда его можно использовать для определения количества общее количество растворенных твердых веществ (T.D.S.), если известен состав раствора и его проводимость. [1] Измерения проводимости, проводимые для определения чистоты воды, не будут реагировать на непроводящие загрязнения (многие органические соединения попадают в эту категорию), поэтому в зависимости от области применения могут потребоваться дополнительные испытания на чистоту.
Иногда измерения электропроводности связаны с другими методами для повышения чувствительности обнаружения определенных типов ионов. Например, в технологии котловой воды продувка котла постоянно контролируется "катионная проводимость", то есть проводимость воды после того, как она прошла через катионообменную смолу. Это чувствительный метод контроля анионных примесей в котловой воде в присутствии избыточных катионов (в составе подщелачивающего агента, обычно используемого для обработки воды). Чувствительность этого метода обусловлена высокой подвижностью H + по сравнению с подвижностью других катионов или анионов. Помимо катионной проводимости, существуют аналитические инструменты, предназначенные для измерения Проводимость дегазации, где проводимость измеряется после удаления растворенного диоксида углерода из образца путем повторного кипячения или динамической дегазации.

Атомы химических элементов, входящих в состав любого вещества, состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг ядра.
Если от электрически нейтрального атома (молекулы) отделяется электрон, то атом превращается в положительный ион. Отделившийся от атома электрон может присоединиться к другому нейтральному атому, образуя отрицательный ион, или он может остаться свободным. Такие электроны называют электронами проводимости, а процесс образования ионов — ионизацией. Количество свободных электронов или ионов в единице объема определяет концентрацию свободно заряженных частиц.
Каждый электрон в атоме может обладать только определенными значениями энергии, т. е. находиться только в разрешенных энергетических состояниях или уровнях, так как изменение энергии электрона может происходить только определенными порциями — квантами. Переход электрона на более высокий уровень требует затраты энергии. Переход электрона на более низкий уровень сопровождается излучением избытка энергии атомом.
В веществах, образованных совокупностью атомов, вследствие взаимного влияния соседних атомов энергетические уровни несколько изменяются, образуя энергетические зоны. Эти зоны отделяются областями, в которых электроны не могут находиться, называемыми запрещен ными зонами. Энергетические зоны, соответствующие разрешенным уровням, делятся на заполненную и свободную.
Для возникновения электропроводности необходимо части электронов заполненной зоны перейти в свободную зону. Возможность такого перехода определяется шириной запрещенной зоны, пропорциональной энергии, которую необходимо затратить для указанного перехода электронов.
Различие проводимости проводников, полупроводников и диэлектриков вызывается особенностями их строения. Согласно зонной теории твердого тела у металлических проводников высокая проводимость обусловливается тем, что заполненная зона вплотную прилегает к свободной зоне (рис. 1-5, а).
Рис. 1 -5. Энергетические уровни. а — проводник; б — диэлектрик; в — полупроводник; 1 — свободная зона; 2 — запрещенная зона; 3 — заполненная зона.
Вследствие этого электроны в металле могут переходить с уровней заполненной зоны на уровни свободной зоны. Иначе говоря, электроны могут с менее удаленных от ядра орбит переходить на более удаленные орбиты или покидать пределы атома, становясь свободными, перемещаясь от одного атома к другому под действием слабых напряженностей электрического .поля, созданного напряжением, приложенным к концам проводника.
Если у данного вещества свободная зона отделена от заполненной достаточно широкой запрещенной зоной (рис. 1-5, б), то соответственно этому проводимость вещества будет ничтожной и, следовательно, это будет диэлектрик.
У полупроводников ширина запрещенной зоны значительно уже, чем у диэлектриков (рис. 1-5, б), в соответствии
с чем для перехода электронов в свободную зону требуется небольшое возбуждение, например за счет усиления теплового движения атомов при повышении температуры, в связи с чем они обладают проводимостью, имеющей промежуточное значение между проводимостью проводников и диэлектриков.
Проводники делятся на два рода. В проводниках первого рода, к. которым преимущественно относятся металлы и их сплавы, электрический ток создается перемещением только электронов (проводники с электронной проводимостью).
В проводниках второго рода — электролитах, к которым относятся водные растворы кислот и солей, электрический ток создается перемещением отрицательных и положительных ионов, которые получаются вследствие распада молекул вещества под действием растворителя (проводники с ионной проводимостью).
Статья на тему Электропроводность
Похожие страницы:
Содержание статьи1 ЭЛЕКТРОПРОВОДНОСТЬ ПОЛУПРОВОДНИКОВ1.1 Собственная электропроводность1.2 Примесная электропроводность ЭЛЕКТРОПРОВОДНОСТЬ ПОЛУПРОВОДНИКОВ Собственная электропроводность Полупроводники — это материалы, занимающие промежуточное положение между.
Что такое ионизационные потенциалы Мерой энергии связи электронов в различных атомах может служить ионизационный потенциал (потенциал ионизации), т. е. работа.
Теория Бора это попытка объяснить модель атома пользуясь идеями Планка , о дискретности электромагнитного излучения. В соответствии с ними Н.
Содержание статьи1 Строение электронных оболочек атомов1.1 Электроны одного слоя1.2 Электроны наружного слоя1.3 Электронейтральные атомы1.4 Электроны в атомах отдельных элементов Строение.
Валентность химических элементов С точки зрения современных представлений валентность элемента определяется числом не спаренных электронов в его атомах. Однако если.
Содержание статьи1 Линейчатые спектры элементов Теория Бора1.1 Теория Бора строения атома1.2 Постулаты бора спектр элемента Линейчатые спектры элементов Теория Бора Ядерная модель.
Читайте также:

