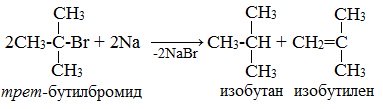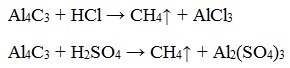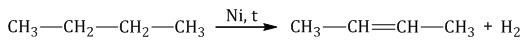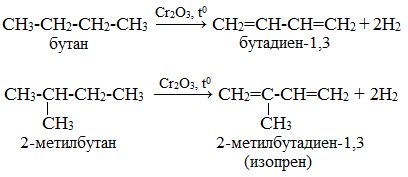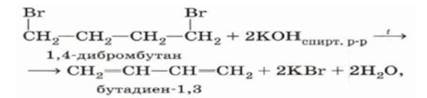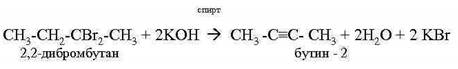Что такое дегидроциклизация кратко
Обновлено: 05.07.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
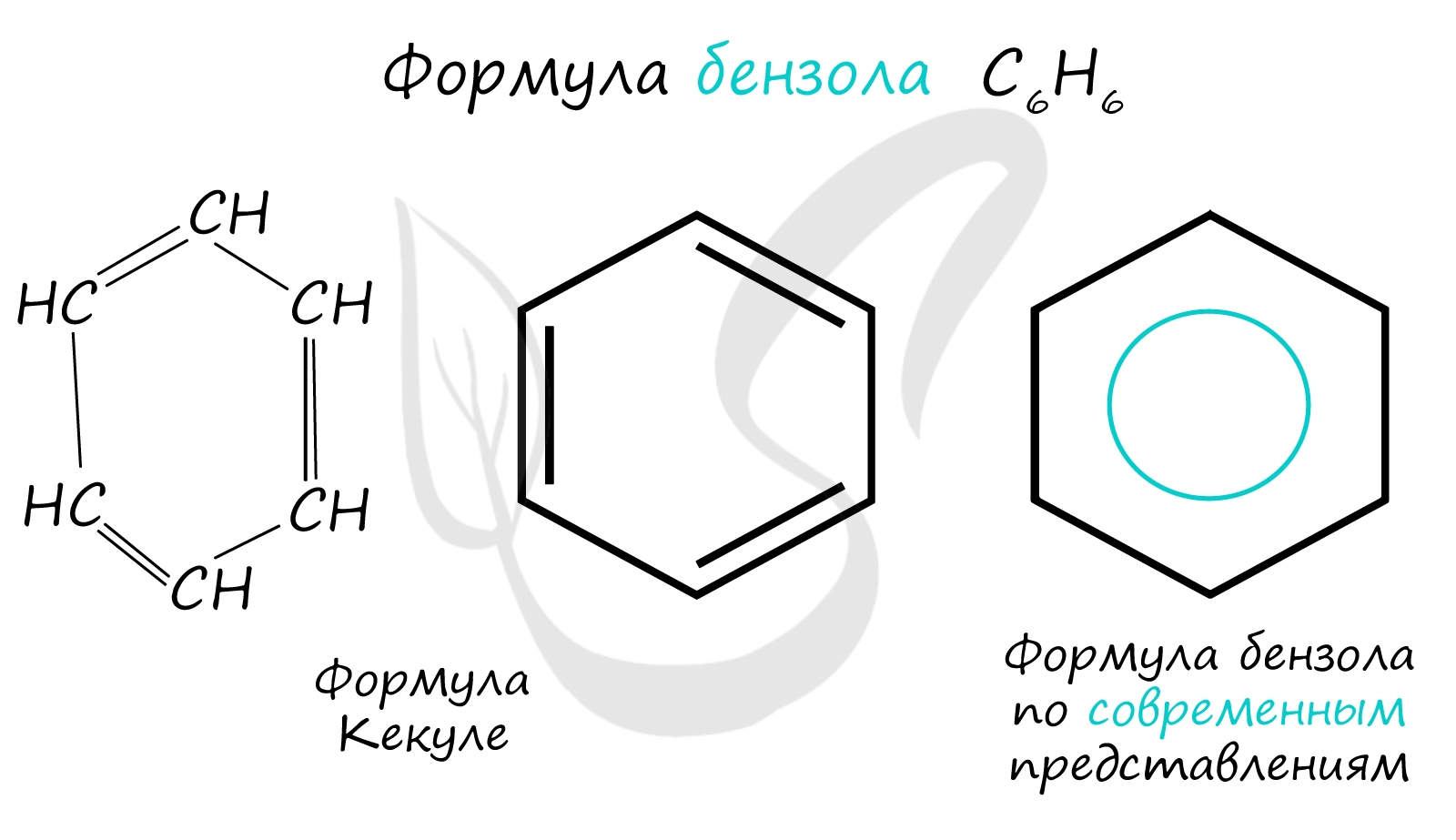
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Дегидроциклизация протекает с поглощением теплоты ( около 250 кДж / моль), поэтому константа равновесия реакции возрастает с повышением температуры. Однако на практике для уменьшения отложений кокса на катализаторе процесс проводят под повышенным давлением водорода. [2] Дегидроциклизация является процессом, обратным гидроге-нолизу С - С-связей. [3] Дегидроциклизация представляет собой принципиально другой путь достижения той же цели. [4] Дегидроциклизация вызывает потерю восьми атомов водорода на превращенную молекулу и, кроме того, существенный сдвиг в плотности при превращении пар; фтаов в ароматические, поэтому условия выхода не столь благоприятны, как при превращения нефтеиов в ароматические, где теряется только шесть атомов водорода на молекулу и изменение плотности значительно меньше. [5] Дегидроциклизация протекает с поглощением теплоты ( около 250 кДж / моль), поэтому константа равновесия реакции возрастает с повышением температуры. Однако на практике для уменьшения отложений кокса на катализаторе процесс проводят под повышенным давлением водорода. [6] Дегидроциклизации благоприятствуют высокие температуры, низкие давления и низкие объемные скорости; наблюдалась конверсия н-гептана в ароматические углеводороды до 58 % мол. Считают, что при конверсии парафинов [155] сначала образуются алкилбензолы с большими ал-кильными заместителями, которые гидрируются в соответствующие нафтены. [7] Дегидроциклизация - гептенов в условиях импульсного режима и в обычной проточной установке. [8] Дегидроциклизация индивидуальных - гептенов на алюмохромокалиевом катализаторе. [9] Дегидроциклизация - гексана на алюмомолибденокалиевом катализаторе в импульсном режиме. [10] Дегидроциклизация - гептана и 2 4-диметилпентана в присутствии алюмопалладиевого катализатора. [11] Дегидроциклизация - гексана в присутствии родия, нанесенного на окись алкминия. [12] Дегидроциклизация триена протекает еще быстрее чем диена: при 450 С на 10 мг катализатора выход толуола из гептатриена примерно в 30 - 40 раз больше, чем из гептадиена. В продуктах реакции содержится также и мртилциклогексадиен. [13] Термическая дегидроциклизация - процесс, широко применяемый при синтезе различных термостойких полимеров; она представляет собой новый тип пиролиза, проходящий с отщеплением только воды. Традиционный пиролиз также часто включает поликонденсационпый процесс, происходящий с отщеплением летучих продуктов: воды, углекислоты, окиси углерода, водорода, метана и других насыщенных и ненасыщенных углеводородов, бензола и других ароматических соединений. Состав этих летучих продуктов изменяется в зависимости от температуры и условий проведения пиролиза. Нелетучими продуктами оказываются кокс или графит, строение и свойства которых также зависят от строения исходных веществ и условий пиролиза. [14] Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи. Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу. Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
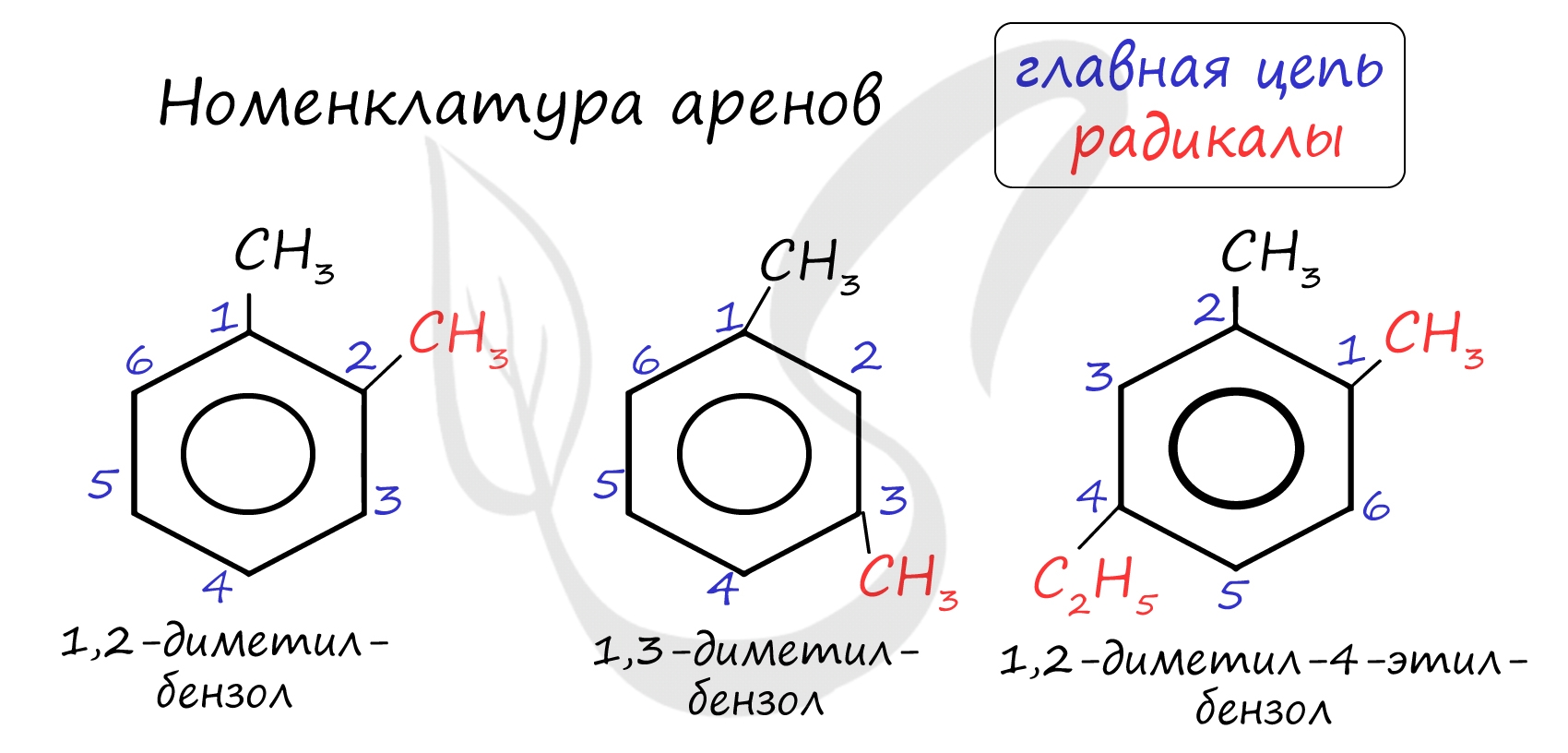
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца. За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол - 120°. Номенклатура и изомерия ареновНазвания аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
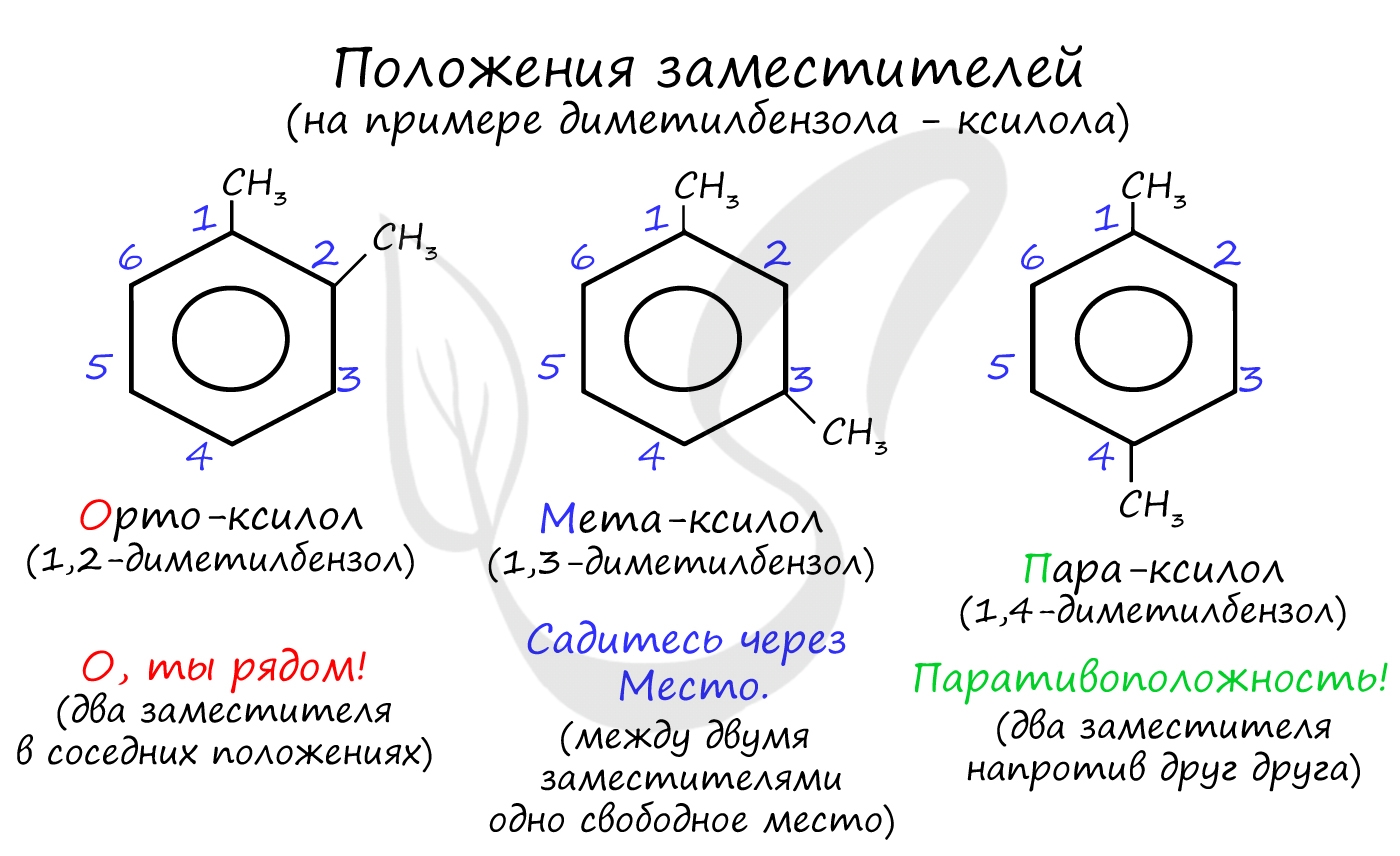
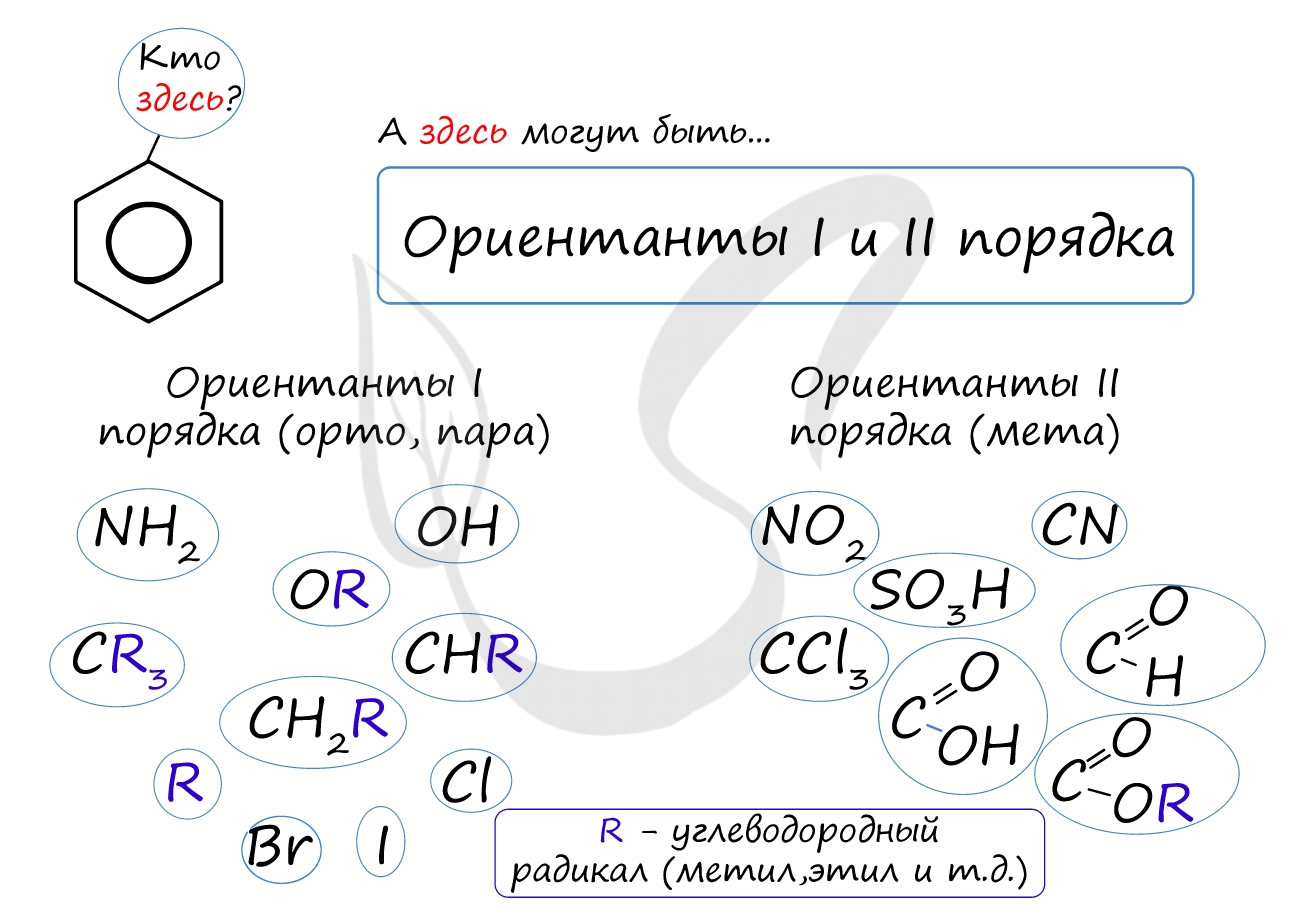
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях. Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
Получение аренов
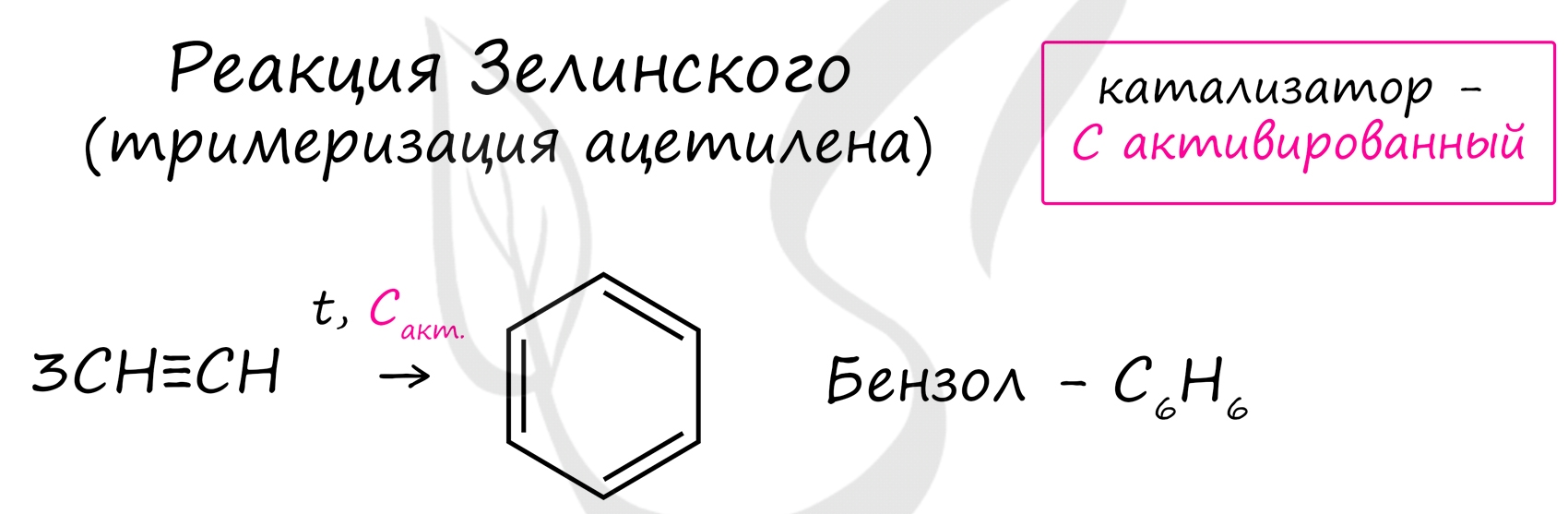
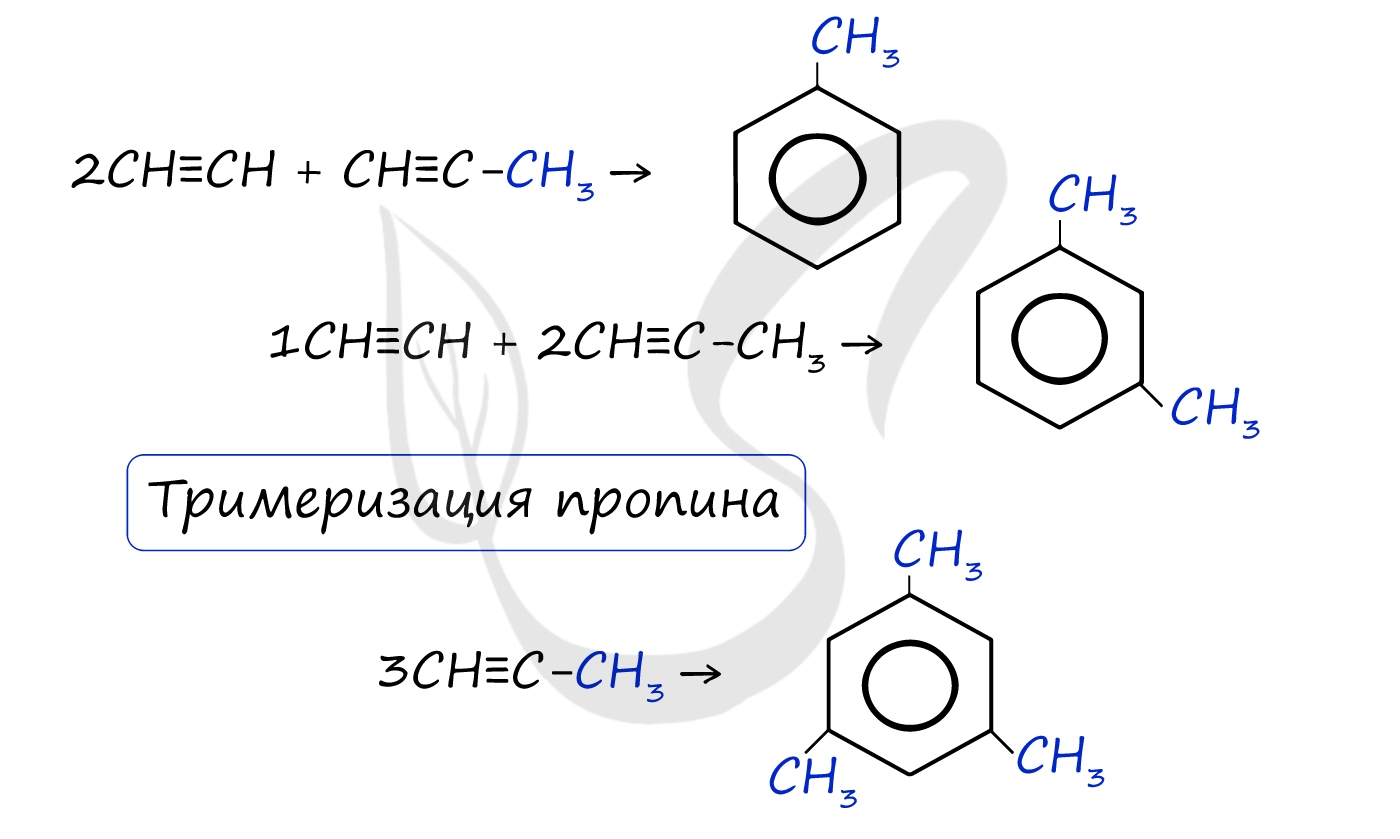
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
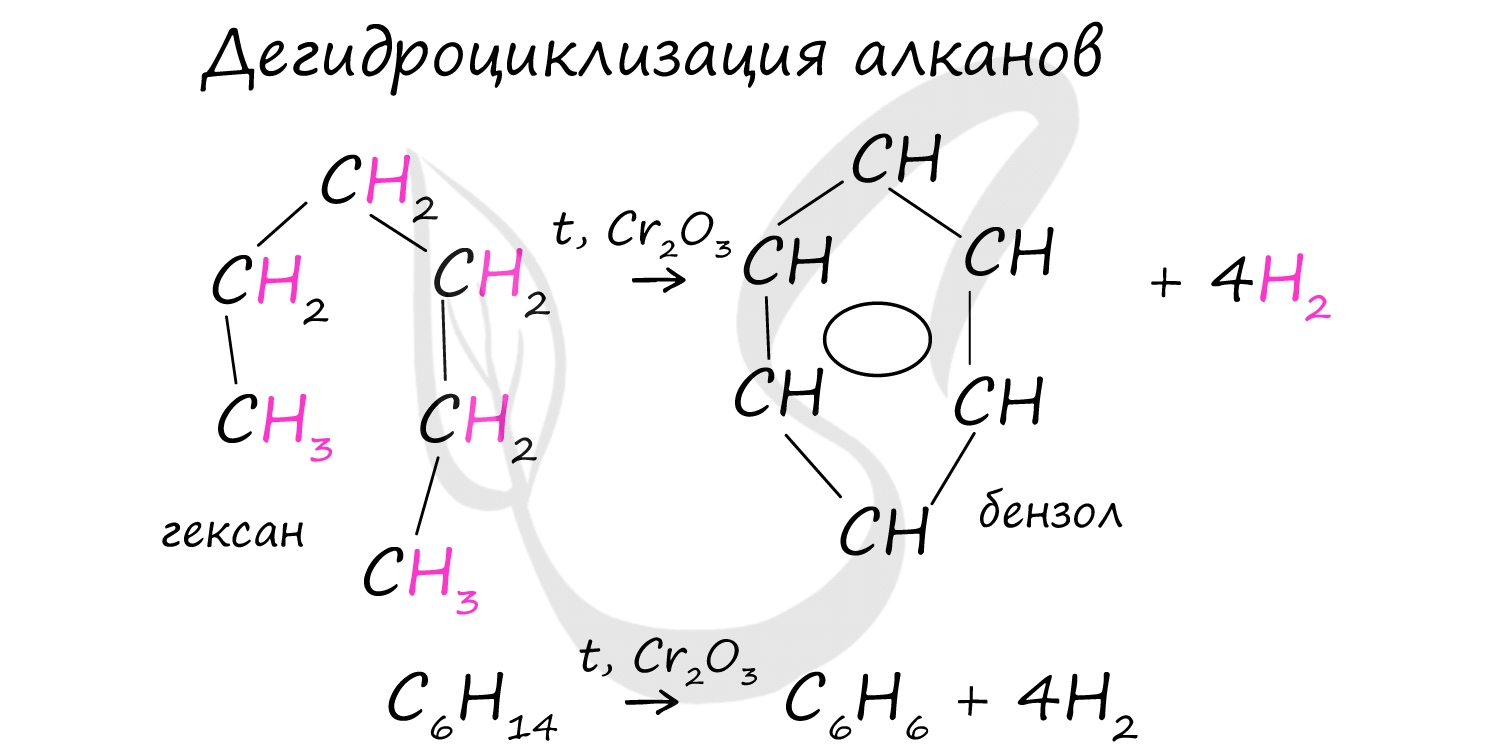
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
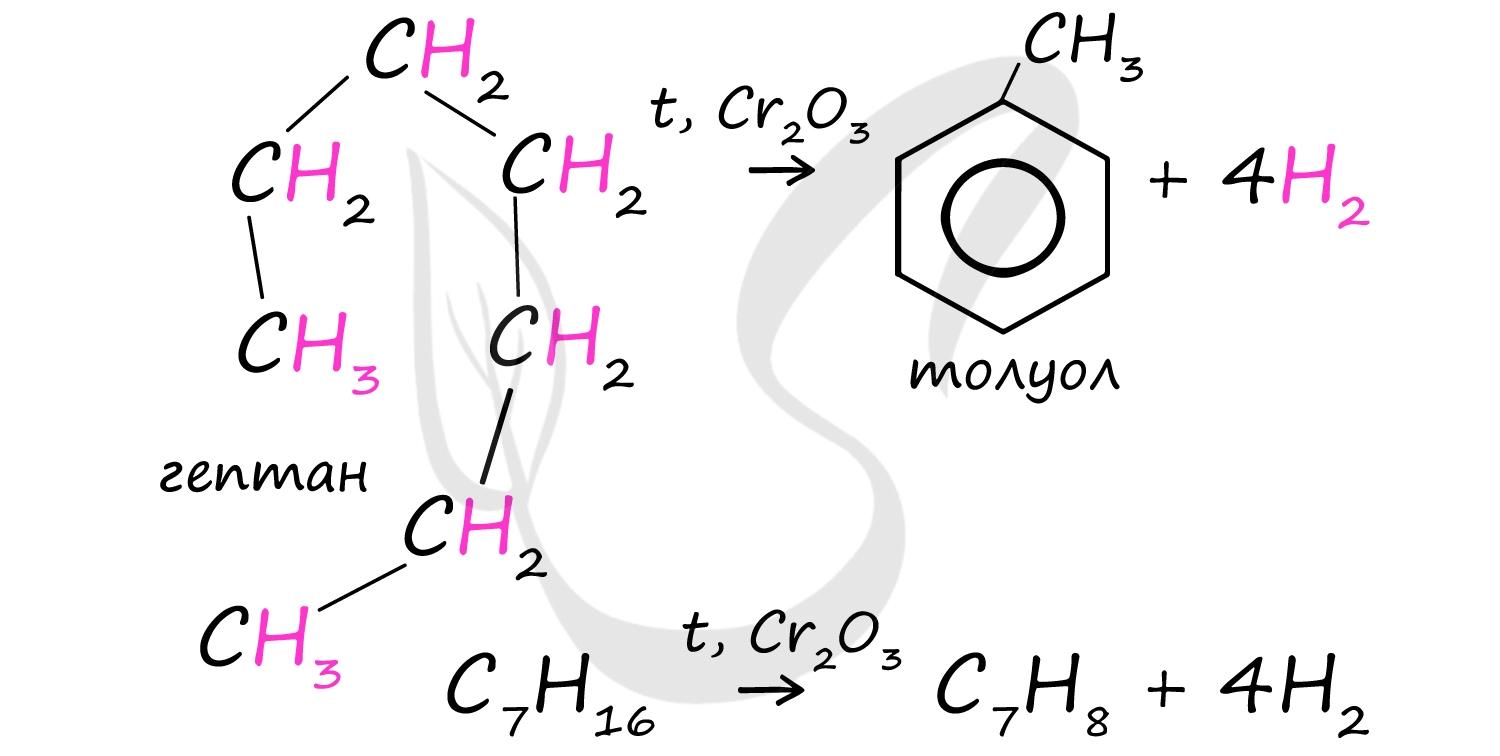
При дегидроциклизации гептана получается толуол.
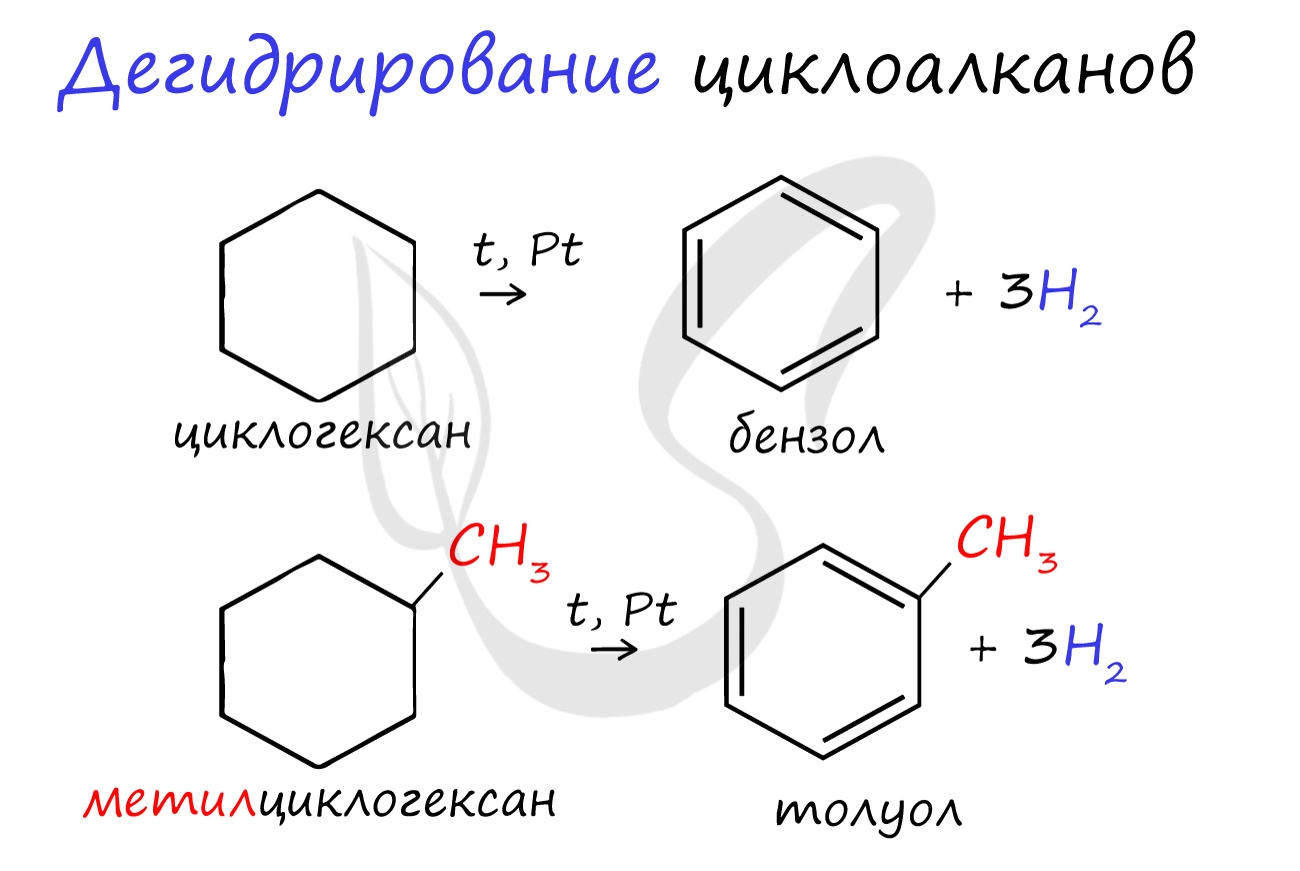
В результате дегидрирования уже "готовых" циклов - циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
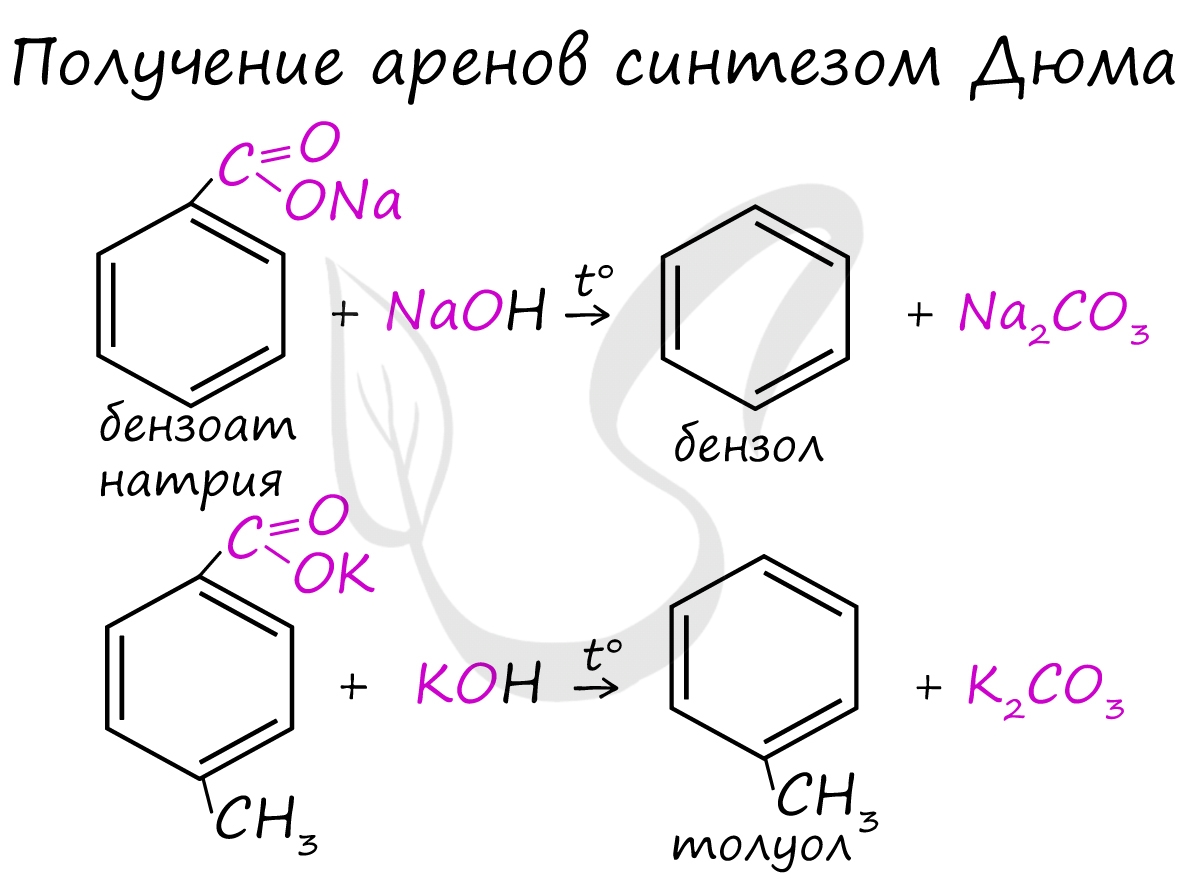
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
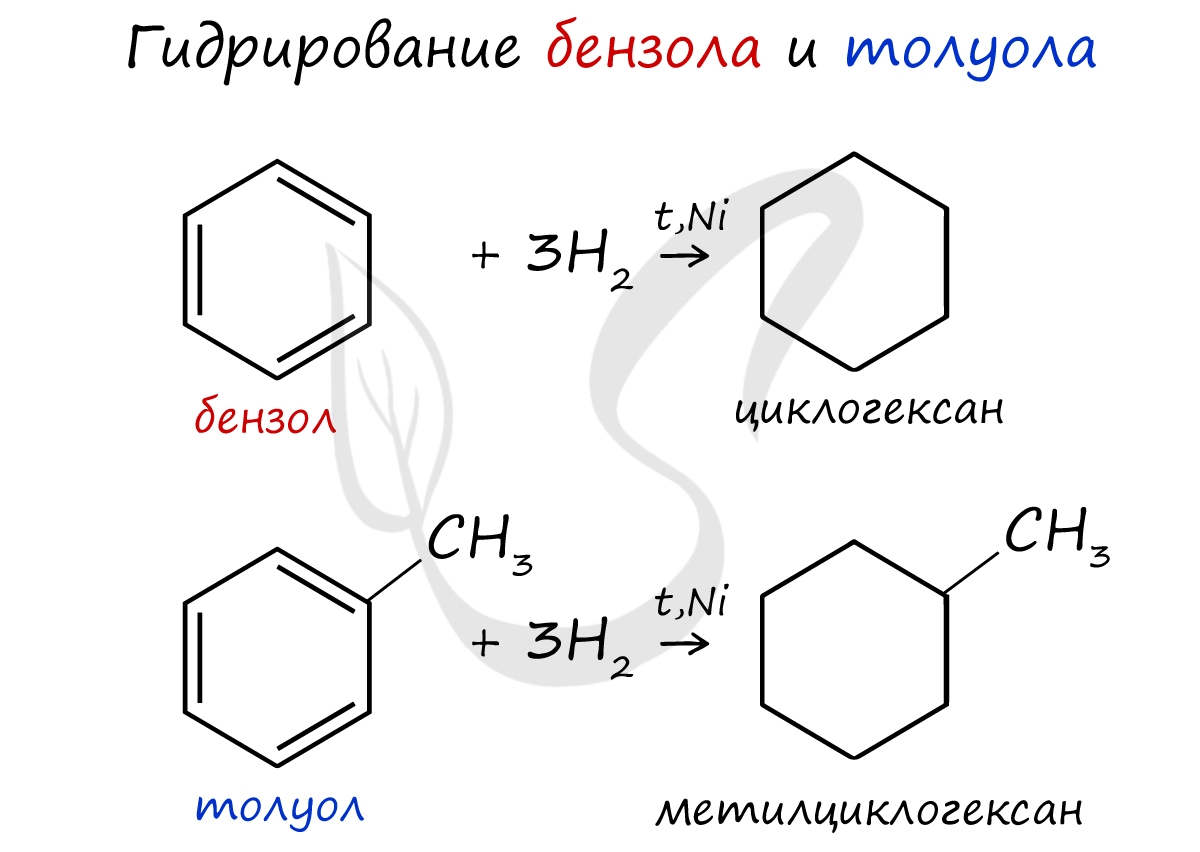
Химические свойства ареновАрены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!) Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия. При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
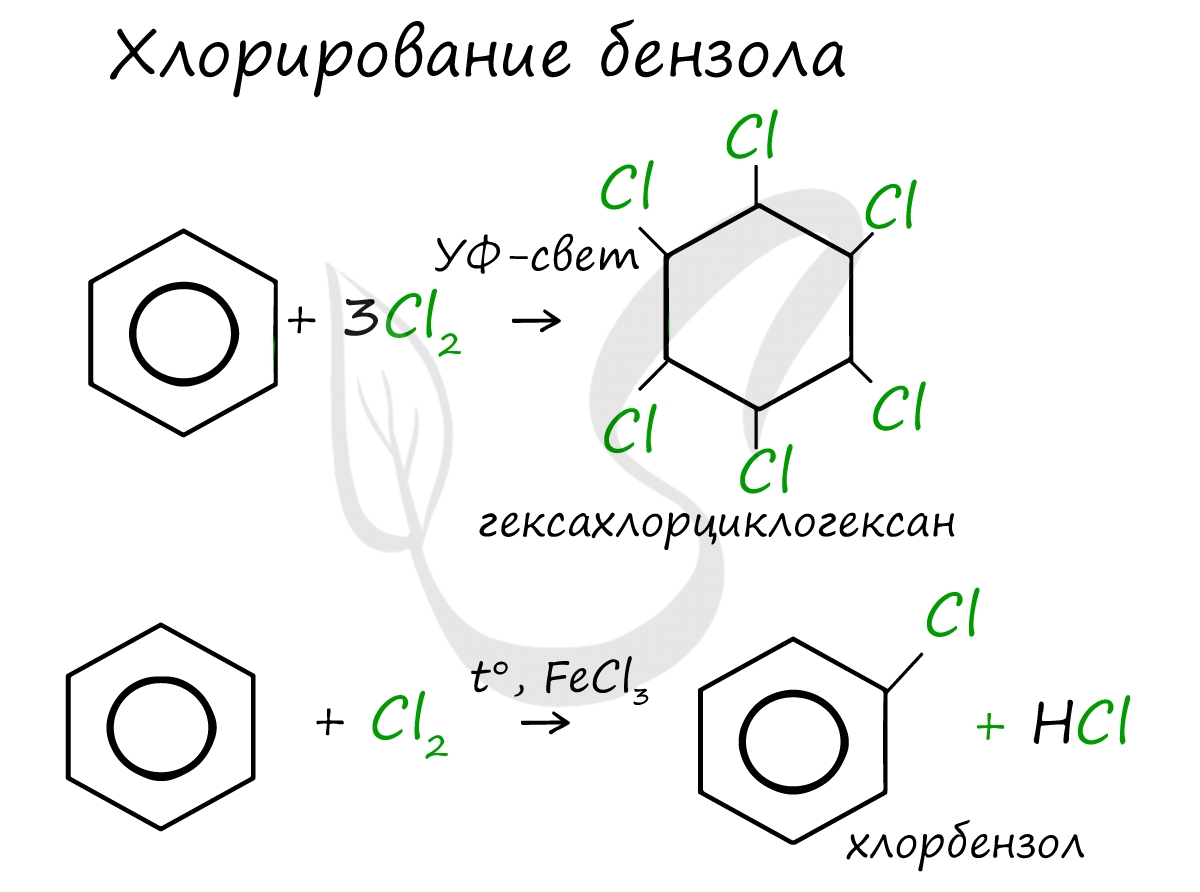
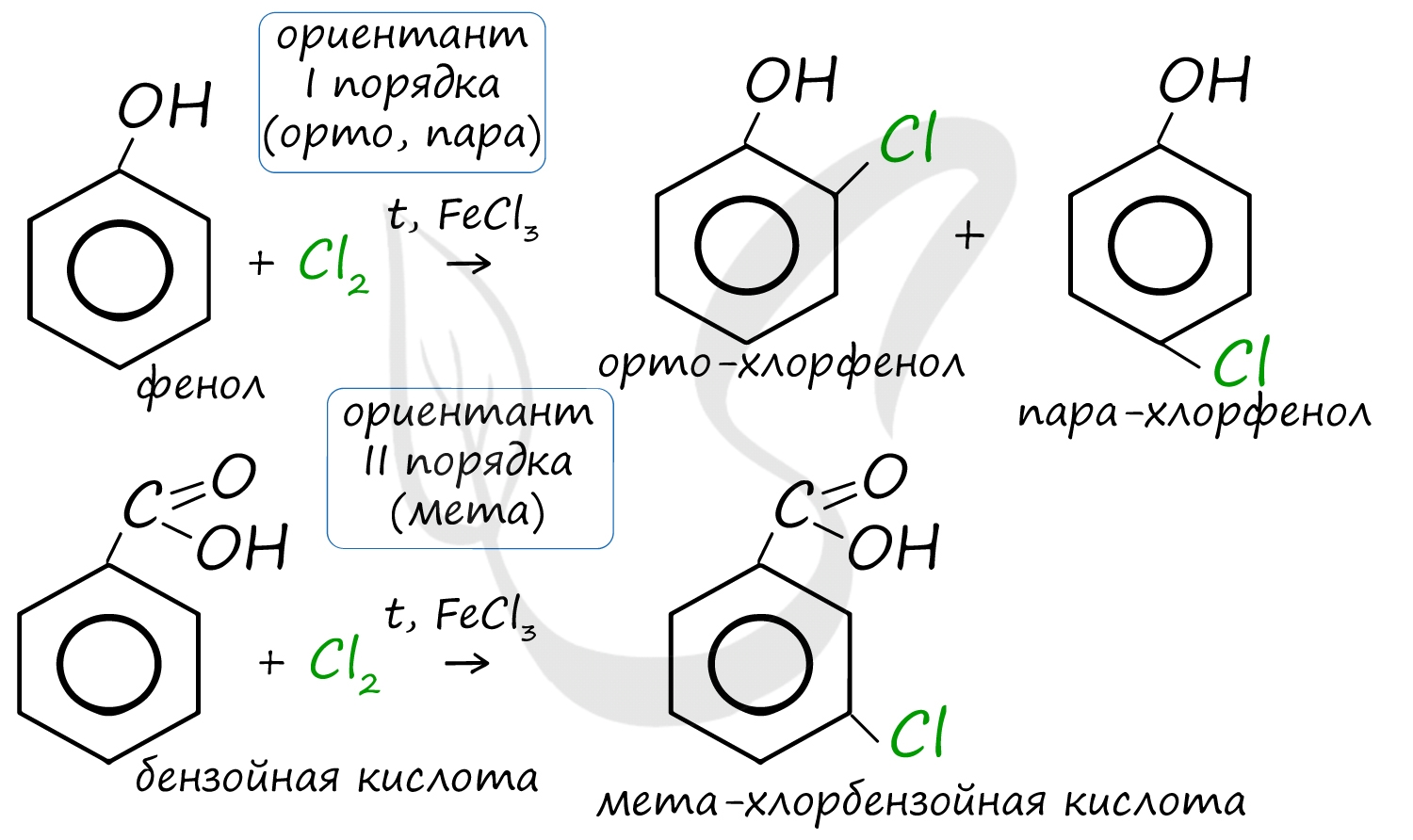
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
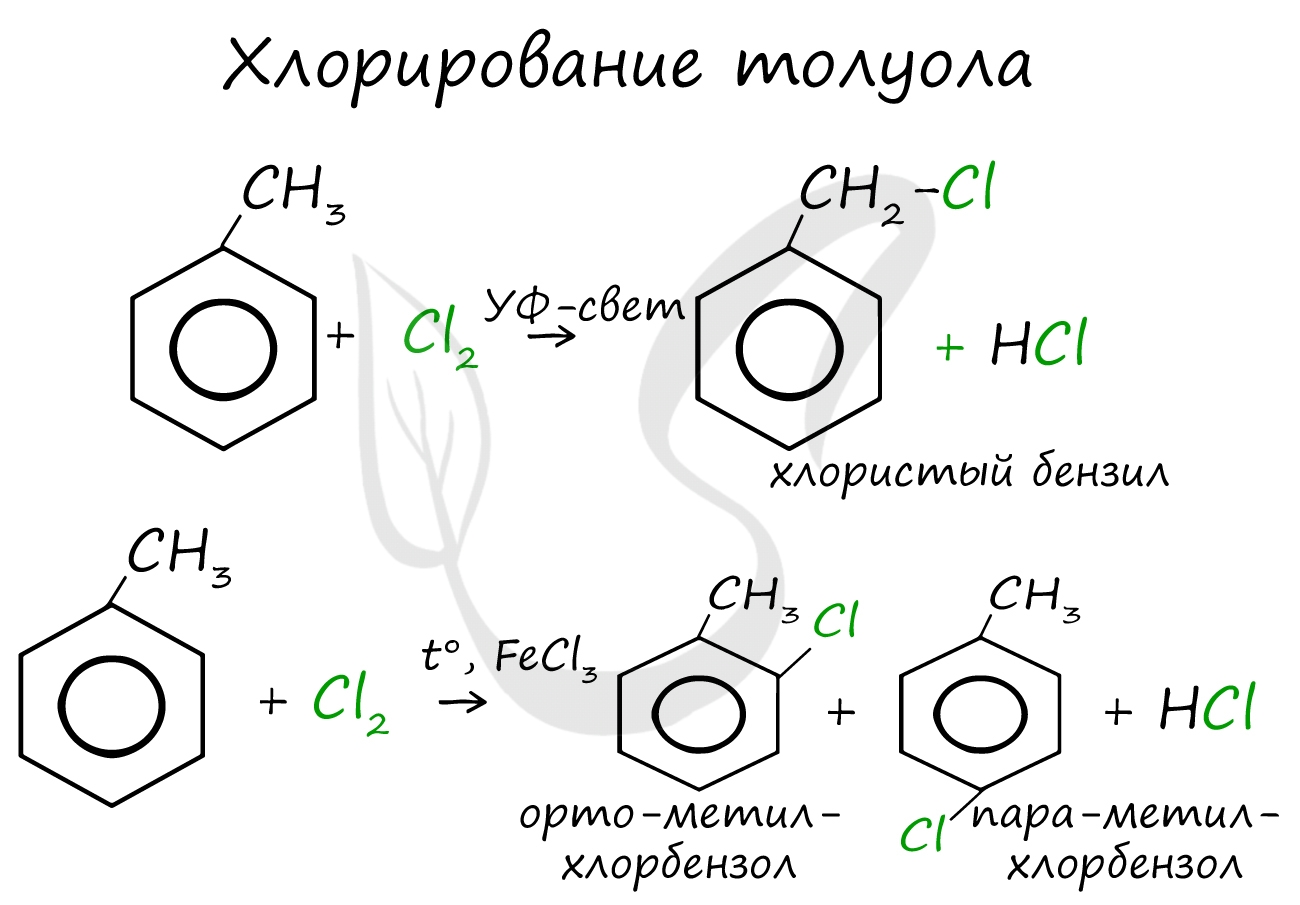
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты). К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
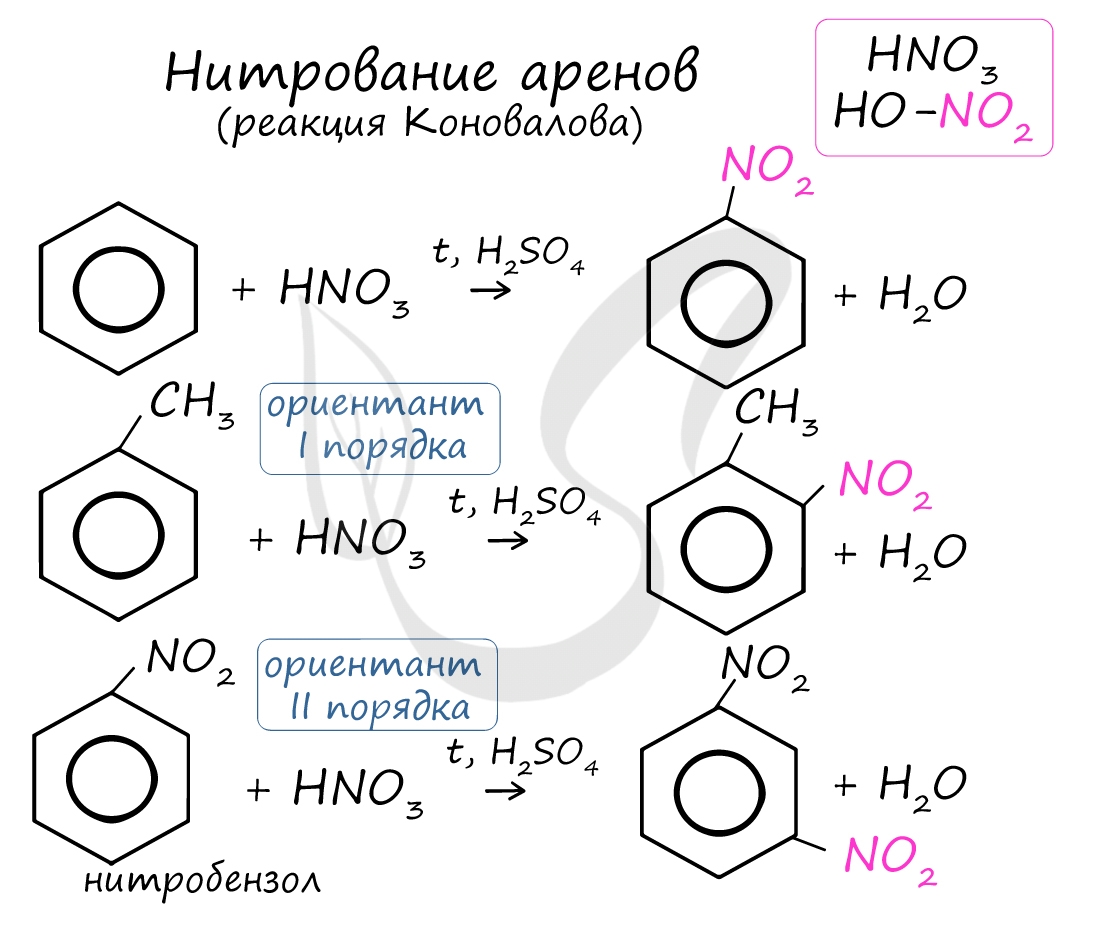
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
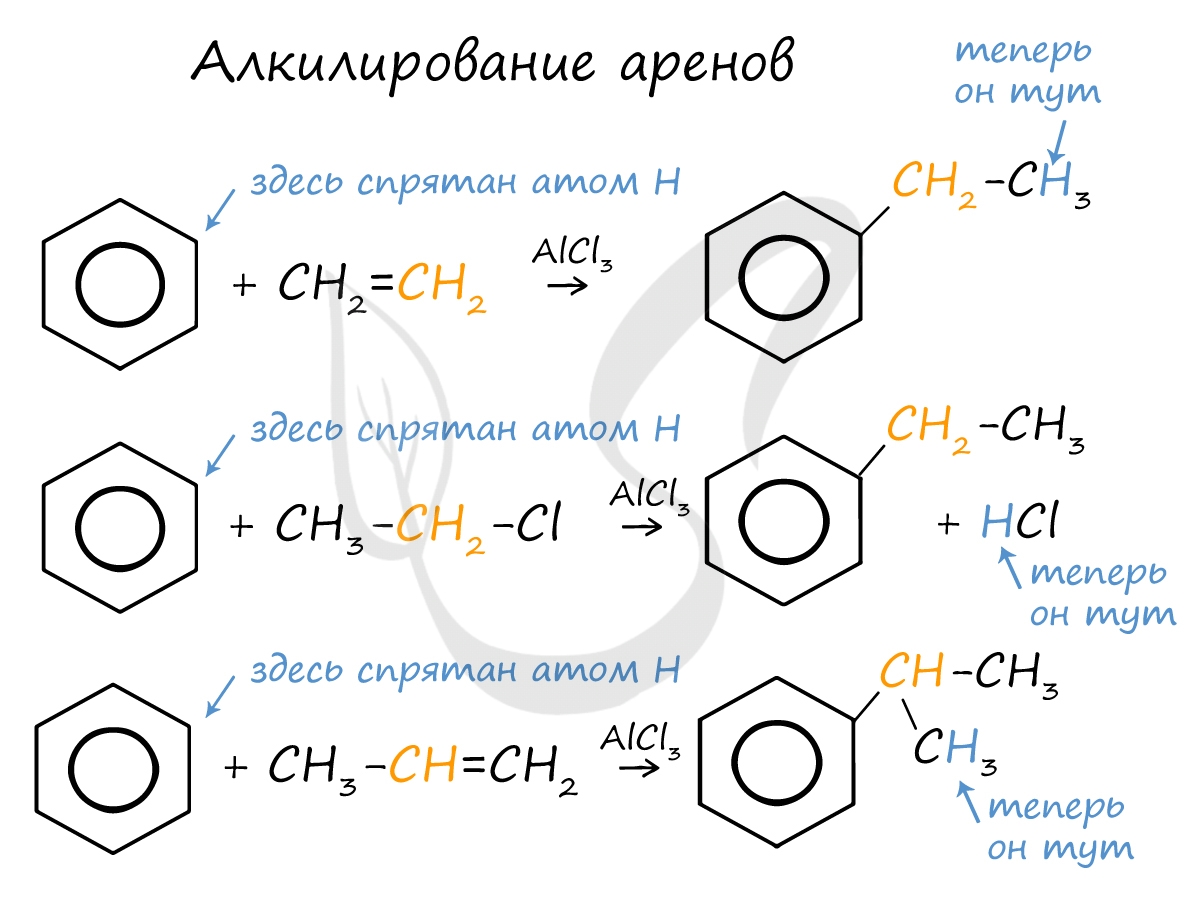
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3. В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
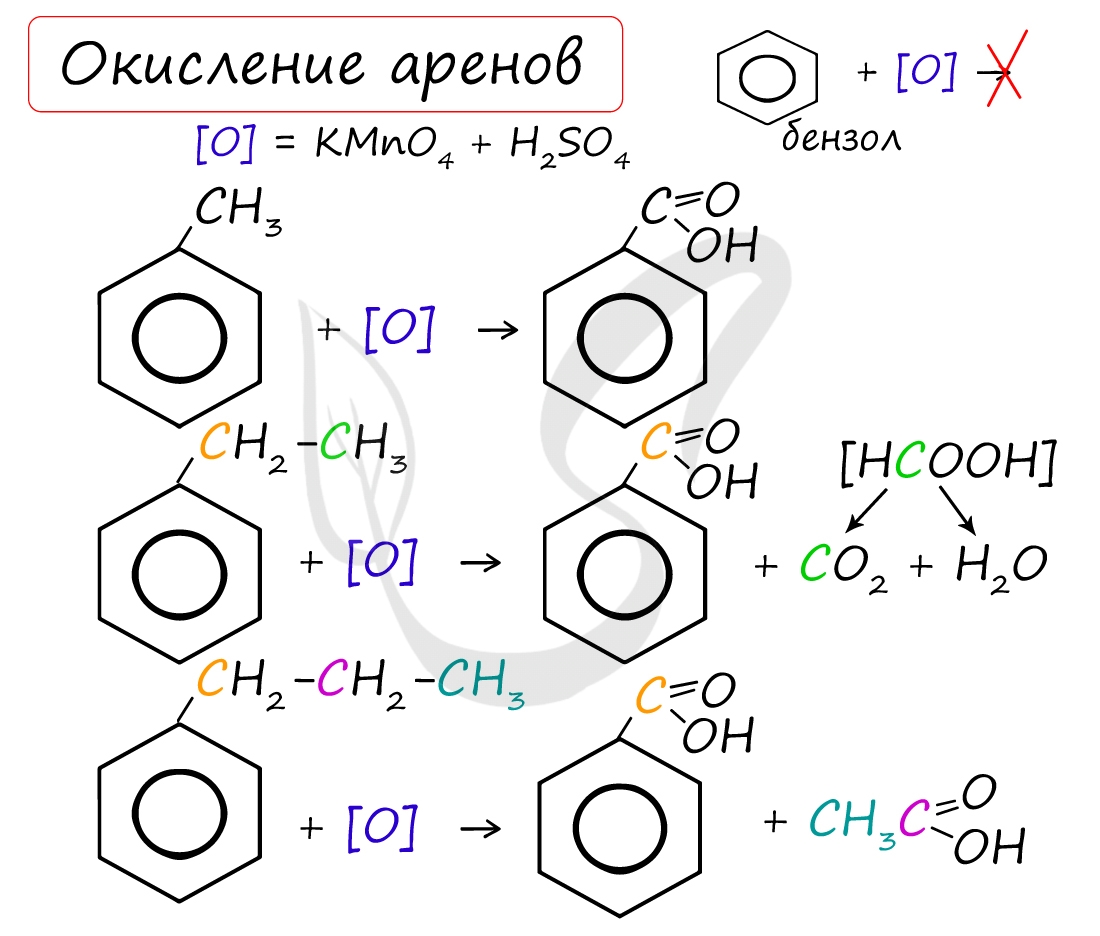
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды. При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
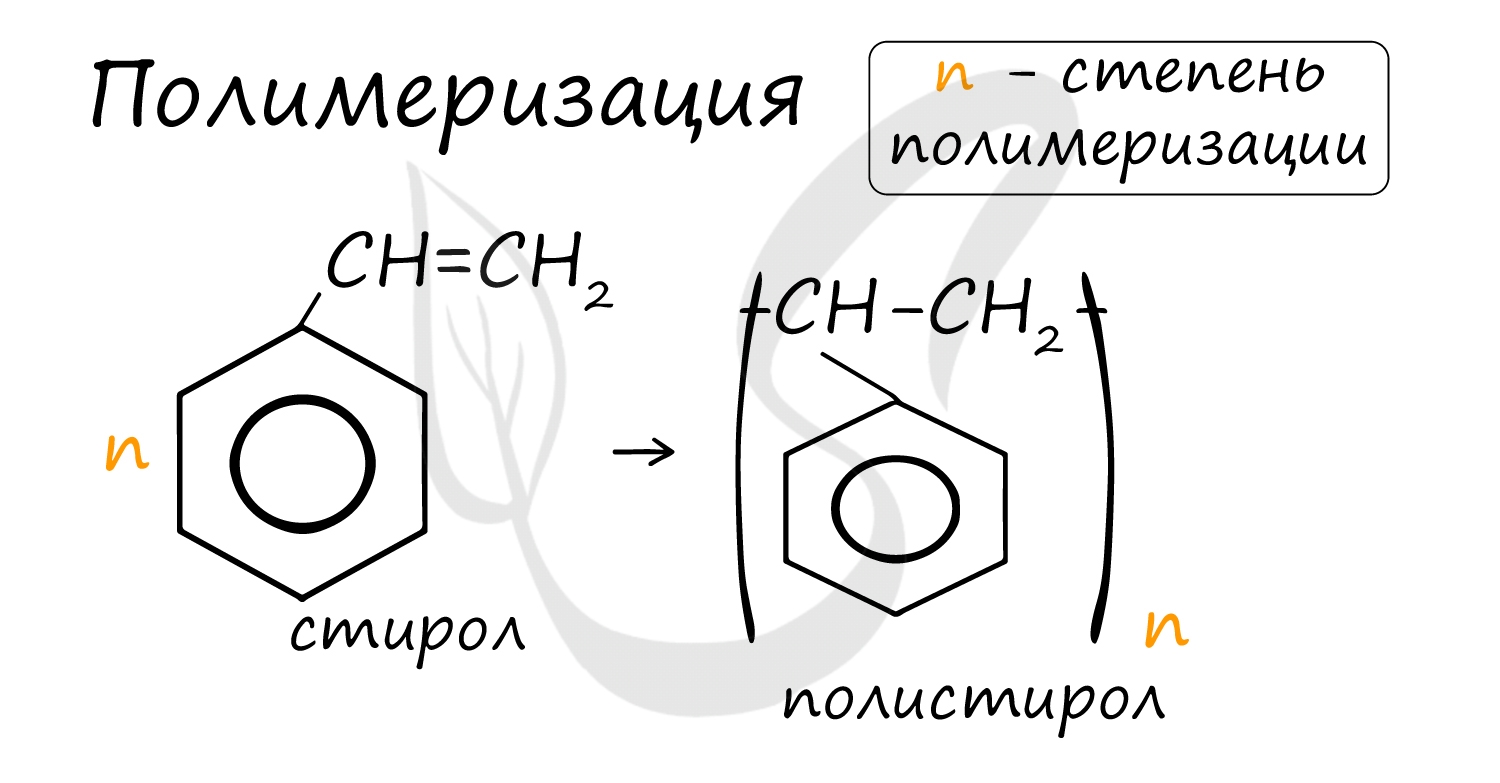
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Алканы выделяют из природных источников (природный и попутный газ, нефть, каменный уголь). Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы - из нефти. Природной смесью твёрдых высокомолекулярных алканов является горный воск - природный битум. Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (80-97%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан. Метан выделяется со дня болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным или рудничным газом. В промышленности 1. Получение алканов из природных источников (нефть, природный газ)
Общие способы получения 1. Синтезом из водяного газа(СО+Н2) получают смесь алканов:
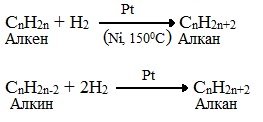
2. Каталитическое гидрирование(+Н2)непредельных углеводородов
При гидрировании циклопропана образуется пропан:
3. Взаимодействие галогеналканов с металлическим натрием(реакция Вюрца) Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами. Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов: Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан:
Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом.
4. Электролиз растворов солей карбоновых кислот(реакция Кольбе)
На примере ацетата натрия В водном растворе ацетат натрия практически полностью диссоциирует: При этом на катод притягиваются катионы натрия Na + и молекулы воды H2O. Разряжаться на катоде будут молекулы воды: На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы. При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан: Суммарное уравнение электролиза водного раствора ацетата натрия: 5. Синтез Гриньяра (реактив Гриньяра – магнийорганическое соединение; например метилмагнийхлорид) Специфические способы получения а) Синтезом на основеводяного газа из оксида углерода (II) и водорода можно получить метан (синтез Фишера-Тропша):
б) Метан можно получить синтезом из простых веществ при нагревании, повышенном давлении в присутствии катализатора (Ni):
в) Гидролиз карбида алюминия (получение метана)
г) Взаимодействие карбида алюминия с сильными кислотами
д) Сплавление солей уксусной кислоты со щелочами(реакция Дюма) – реакция декарбоксилирования (отщепление (элиминирование) молекулы углекислого газа) ЦИКЛОАЛКАНЫ 1. Дегидрогалогенирование дигалогеналканов Реакция Вюрца применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения. При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан (реакция Густавсона):
Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан: 2. Каталитическое гидрирование аренов
Среди продуктов – смесь цис- и трансизомеров. АЛКЕНЫ Общие способы получения 1. Дегидрирование алканов При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алканов Крекинг -это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью. При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
РЕАКЦИИ ЭЛИМИНИРОВНИЯ – реакции отщепления, при которых от двух соседних атомов углерода отщепляются атомы или группы атомов, а между атомами углерода образуется пи-связь. 3. Дегидрогалогенирование моногалогеналканов Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
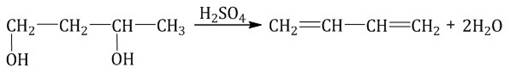
4. Дегидратация спиртов При нагревании спиртов (выше 140 о С) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация - это отщепление молекул воды.
Дегидратация более сложных молекул также протекает по правилу Марковникова.
5. Дегалогенирование галогеналканов Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов. Как правило, для отщепления используют двухвалентные активные металлы - цинк или магний.
АЛКАДИЕНЫ 1. Дегидрирование алканов Отщепление водорода от бутана - это промышленный способ получения дивинила.Реакция протекает при нагревании в присутствии оксида хрома (III):
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Дегидратация двухатомных спиртов (группы –ОН должны располагаться через одну) Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
1. Синтез Лебедева (дегидрирование и одновременная дегидратация) Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева). При этом образуются бутадиен-1,3, вода и водород:
АЛКИНЫ Общие способы получения 1. Дегидрирование алканов При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
2. Дегидрогалогенирование дигалогеналканов Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
3. Алкилирование соединений алкинов с металлами Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
Специфические способы получения 1. Пиролиз метана. Пиролиз метана -это промышленный способ получения ацетилена.
Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) - примерно 0,1-0,01 секунды при температуре 1500 о С. Если процесс проводить дольше, то метан разлагается на углерод и водород 2. Карбидный способ Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2. В кислой среде образуется ацетилен и соответствующая соль: Карбид кальция можно получить, нагревая оксид кальция с углеродом: АРЕНЫ 1. (реакция Вюрца-Фиттига).
Дегидроциклизация алканов Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т.е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды. Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
4. Декарбоксилирование солей бензойной кислоты Реакция Дюма - это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование - это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
6. Тримеризация ацетилена При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол. Читайте также:
|