Что такое аллотропия кратко
Обновлено: 02.07.2024
(от алло.. . и греч. tropos - поворот - свойство) , существованиехимических элементов в виде двух или более простых веществ. Может бытьобусловлена образованием молекул с различным числом атомов (напр., кислород O2 и озон O3) либо кристаллов различных модификаций (напр. , алмази графит, состоящие из атомов углерода) . В последнем примере аллотропия -частный случай полиморфизма.
Аллотропия — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
Примеры
Водород может существовать в двух формах (модификациях) — в виде орто- и пара-водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны) , а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны) .
О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха, озон же пахуч, имеет бледно-фиолетовый цвет, он более бактерициден.
Красный фосфор и белый фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор неядовит, не светится в темноте, сам по себе не воспламеняется.
Множество модификаций углерода, например: Алмаз, графит, фуллерен и карбин.
Аллотро́пия — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам.

Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Содержание
История
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
В начале XX века было признано, что различия в кристаллической структуре простых веществ (например, углерода или фосфора) также являются причиной аллотропии. В 1912 году В. Оствальд отметил, что аллотропия элементов является просто частным случаем полиморфизма кристаллов, и предложил от него отказаться. Однако, по настоящее время они используются параллельно. Аллотропия относится только к простым веществам, независимо от их агрегатного состояния; полиморфизм — только к твёрдому состоянию независимо от того, простое это вещество или сложное. Таким образом, эти термины совпадают для простых твёрдых веществ (кристаллическая сера, фосфор, железо и др.) [1] .
Примеры аллотропии


В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Как правило, большее число аллотропных форм образуют элементы, имеющие переменные значения координационного числа или степени окисления (олово, фосфор). Другим важным фактором является катенация — способность атомов элемента образовывать гомоцепные структуры (например, сера). Склонность к аллотропии более выражена у неметаллов, за исключением галогенов и благородных газов, и полуметаллов.
Принято обозначать различные аллотропические формы одного и того же элемента строчными буквами греческого алфавита; причём форму, существующую при самых низких температурах, обозначают буквой α, следующую — β и т. д.
Неметаллы
Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны.
Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок.
Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется.
Две аллотропные модификации: О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден.
Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера.
Красный цикло-Se8, серый полимер Se и чёрный селен.
Полуметаллы
Бор существует в аморфном и кристаллическом видах. Аморфный бор – порошок бурого цвета. Обладает большей реакционной способностью, чем кристаллический бор. Кристаллический бор – вещество черного цвета. Известно более 10 аллотропных модификаций бора, которые кристаллизуются в ромбической и тетрагональной сингониях. Наиболее устойчивая модификация – β-ромбический бор – состоит из икосаэдров B12, которые образуют слои, объединенные в бесконечную структуру.
Различают две основные аллотропные модификации кремния - аморфную и кристаллическую. Решётка кристаллической модификации кремния - атомная, алмазоподобная. Также выделяют поликристаллический и монокристаллический кремний.
Три основные аллотропные модификации: жёлтый мышьяк (неметалл, состоящий из молекул As4 - структура, аналогичная белому фосфору), серый мышьяк (полуметаллический полимер), чёрный мышьяк (неметаллическая молекулярная структура, аналогичная красному фосфору).
Две аллотропные модификации: α-Ge - полуметалл с алмазоподобной кристаллической решёткой и β-Ge - с металлической структурой, аналогичной β-Sn.
Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма), из которых наиболее устойчива металлическая форма серебристо-белого цвета с синеватым оттенком
Полоний существует в двух аллотропных металлических модификациях. Кристаллы одной из них – низкотемпературной – имеют кубическую решетку (α-Po), а другой – высокотемпературной – ромбическую (β-Po). Фазовый переход из одной формы в другую происходит при 36 °C, однако при обычных условиях полоний находится в высокотемпературной форме вследствие разогрева собственным радиоактивным излучением.
Металлы
Среди металлов, которые встречаются в природе в больших количествах (до U, без Tc и Pm), 28 имеют аллотропные формы при атмосферном давлении: Li, Be, Na, Ca, Sc, Ti, Mn, Fe, Co, Sr, Y, Zr, Sn, La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Yb, Hf, Tl, Th, Pa, U. Также важны аллотропные формы ряда металлов, образующиеся при их технологической обработке: Ti при 882˚C, Fe при 912˚C и 1394˚C, Co при 422˚C, Zr при 863˚C, Sn при 13˚C и U при 668˚C и 776˚C.
Олово существует в трех аллотропных модификациях. Серое олово (α-Sn) мелкокристаллический порошок, полупроводник, имеющий алмазоподобную кристаллическую решётку, существует при температуре ниже 13,2 °С. Белое олово (β-Sn) - пластичный серебристый металл, устойчивый в интервале температур 13,2—161 °С. Высокотемпературное гамма-олово (γ-Sn), имеющее ромбическую структуру, отличается высокой плотностью и хрупкостью, устойчиво между 161 и 232 °С (температура плавления чистого олова).
Энантиотропные и монотропные переходы


Переход одной аллотропной модификации в другую происходит при изменении температуры или давления (или одновременном воздействии обоих факторов) и связан со скачкообразным изменением свойств вещества. Этот процесс бывает обратимым (энантиотропным) и необратимым (монотропным).
Примером энантиотропного перехода может служить превращение ромбической серы в моноклинную α-S (ромб.) ↔ β-S (монокл.) при 95,6 °C. При обычной температуре стабильной является ромбическая модификация серы, которая при нагревании до 95,6 °С при нормальной давлении переходит в моноклинную форму. Последняя при охлаждении ниже 95,6 °С вновь переходит в ромбическую форму.
К монотропному переходу относится превращение белого фосфора P4 под давление 1,25 ГПа и температуре 200 °C в более стабильную модификацию — чёрный фосфор. При возвращении к обычным условиям обратный переход не происходит. Переход из нестабильной формы в стабильную в принципе возможен при любой температуре, а обратный — нет, то есть определенная точка перехода отсутствует. Еще один пример — превращение графита в алмаз при давлении 6 ГПа и температуре 1500 °C в присутствии катализатора (никель, хром, железо и другие металлы). В обоих случаях давление способствует превращению, поскольку образуется вещества с более высокой плотностью, чем исходные.

Явление аллотропии подразумевает возможность создания из одного и того же элемента определенного количества различных веществ. Например, кислород и озон в своем составе содержат только лишь оксиген. Вопрос о том, как это вообще возможно, на протяжении длительного периода времени интересовал многих людей. На сегодняшний момент ученые легко могут объяснить все особенности этого процесса.
Определение понятия
Под аллотропией подразумевается существование нескольких простых веществ, в основе которых присутствует один и тот же единственный химический элемент. Впервые такое явление описал известный шведский химик и минеролог Йенс Берцелиус.
Аллотропия по своей сути имеет довольно много общего с кристаллическим полиморфизмом. В связи с этим у ученых на протяжении длительного периода времена существовали достаточно серьезные споры. Это связанно с тем, что часть специалистов считали, что аллотропия и кристаллический полиморфизм – это одно и то же явление.
В настоящее же время от этой теории большинство ученых отошло. Мировое научное сообщество пришло к выводу о том, что кристаллический полиморфизм может касаться только лишь твердых тел, тогда как аллотропия – газов и жидкостей.
Причины возникновения аллотропии
Далеко не все элементы способны образовывать несколько разных простых веществ. Такая способность напрямую зависит от структуры молекул. Чаще всего подобное явление наблюдается у элементов, которые имеют переменные окислительные степени. Это касается таких групп, как:
Причины аллотропии могут быть нескольких типов. К наиболее вероятным из них ученые относят такие факторы, как:
- Различное количество атомов, необходимых для образования одной молекулы.
- Отличающийся порядок сопряжения атомов в одну молекулу.
- Параллели между спинами электронов.
- Разновидность кристаллической решетки.
Для того чтобы наглядно понять, каким образом может существовать явление аллотропии, необходимо рассмотреть несколько наиболее примечательных примеров, широко встречающихся в природе.
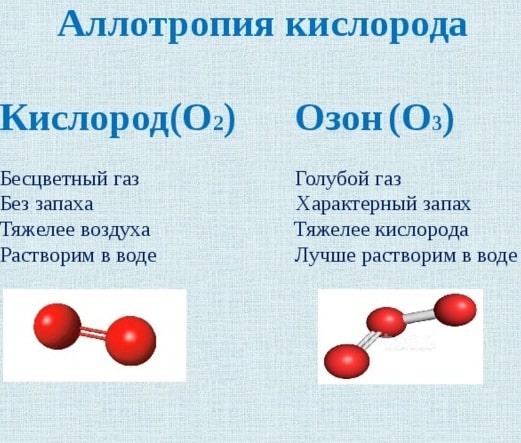
Кислород и озон
Аллотропия кислорода и озона – это вариант того, как различное количество атомов может существенно влиять не только на физические, но и на химические свойства простых веществ. Для того чтобы понять это, необходимо разобраться в особенностях каждого из этих газов:
- Кислород.Он не имеет вкуса и запаха. Масса этого газа в 1,5 раза легче массы озона. Кислород неплохо растворяется в воде. Чем ниже температура окружающей среды, тем быстрее происходит этот процесс. Используется данный газ для осуществления дыхания живыми организмами. Вследствие этого кислород считается жизненно важным химическим веществом для жизнедеятельности на планете.
- Озон.Это газообразное вещество имеет голубоватый цвет. Характерный запах озона легко можно почувствовать на улице после прошедшего дождя. В сравнении с кислородом этот газ более активный. Это связанно с тем, что при его распаде появляется молекула кислорода и один атом оксигена. Последний в свою очередь вступает в связь с другими атомами, образуя, таким образом, новые вещества.
Аллотропия оксигена была исследована из-за своего распространения одной из первых.
Алмаз и графит
Молекула углерода отличается тем, что она имеет постоянное количество атомов. При этом из последних могут образовываться самые разнообразные простые вещества. Это касается, к примеру, алмаза и графита. Их отличия заключаются в следующем:
- Алмаз.Это вещество признано учеными одним из наиболее твердых на Земле. Это связанно с тем, что атомы в нем имеют достаточно прочные ковалентные связи во всех направлениях кристаллической решетки. Таким образом, создается объемная система тетраэрдов.
- Графит.В этом веществе прочные связи в кристаллической решетке образовываются только лишь в горизонтальном направлении. Вследствие этого разломать стержень из графита вдоль очень сложно.
Аллотропия алмаза и графита – один из примеров того, как из одного и того же химического элемента из-за разной кристаллической решетки образуются существенно отличающиеся друг от друга простые вещества.
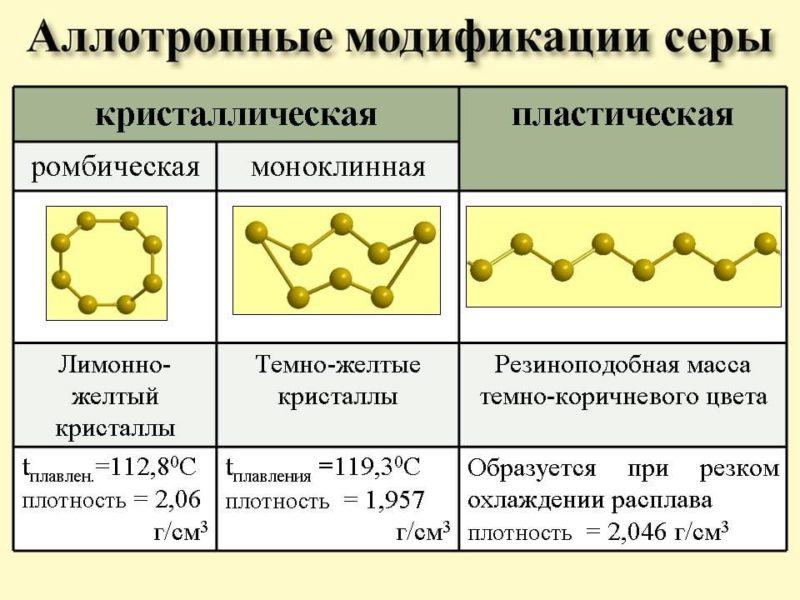
Внутренняя структура молекул серы может быть различной. Вследствие этого происходит образование различных простых веществ, среди которых стоит выделить такие:
- Сера с ромбической структурой молекул.Она считается наиболее устойчивой. В ее состав входит 8 атомов, которые образовывают твердое вещество желтоватого оттенка. Оно неспособно растворяться в воде. К тому же, последняя его даже не смачивает. При этом показатели проводимости тепла и тока у такой серы находятся на низком уровне.
- Сера с моноклинной структурой. Ее атомы образовывают параллелепипеды со скошенными углами. Таким образом, создается вещество, похожее на иглу темно-желтого цвета.
- Сера с пластической структурой. Ее создают посредством расплавления других типов этого вещества и помещения их в воду. Таким образом, у них рушится структура, вследствие чего возникают полимерные цепи разной длины. Они в свою очередь создают резиноподобную пасту светло-коричневого оттенка.
Аллотропия серы – еще один пример влияния внутренней структуры молекул на создание разных по своим свойствам простых веществ.
Фосфор
На сегодняшний момент известно около 11 видов фосфора. Это обусловлено аллотропией, причина которой связана с кристаллической решеткой молекул этого химического элемента. Для того чтобы изменить внутреннее строение, необходимо создать определенные условия.
К примеру, белый фосфор может быть выделен посредством испарения мочи. Такое вещество будет очень активным, вследствие чего при повышении температурных показателей окружающей среды до 40 градусов по Цельсию оно воспламенится из-за реакции с кислородом.
Для получения красного фосфора достаточно всего лишь увеличить давление и температуру в атмосфере двуокиси углерода. Это вещество отличается средней активностью. Вследствие этого оно не светится в темноте. При нагревании красный фосфор преобразовывается в пар. Это можно наблюдать при зажигании спичек.
Аллотропия – это образование нескольких отличающихся друг от друга веществ из одного и того же химического элемента. Наблюдать такое явление можно преимущественно у неметаллов. Его основные причины заключаются, как в разном количестве атомов, что образовывают молекулу, так и в изменениях кристаллической решетки.

Явление аллотропии обусловлено либо различным состоянием молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Читайте также:

