Чем третичная структура белка отличается от вторичной и первичной кратко
Обновлено: 07.07.2024
Приятно видеть, что хабравчане регулярно интересуется другими предметными областями – например, биологией (более конкретно – структурой и функцией биологических макромолекул). Однако некоторые посты (например, этот), вызывают у специалиста просто физическую боль из-за обилия совершенно диких фактологических ошибок. В этом посте мне хочется рассказать о структуре и функции белка. О том, что мы знаем и о том, чего не знаем, а так же об имеющихся в этой области вычислительных задачах, требующих решения и интересных IT-специалистам. Постараюсь рассказывать сжато и тезисно, чтобы информации было больше, а воды – меньше. Всех, интересующихся структурой белков, прошу под кат, там очень много букв.
1. Почему белки важны?
Как сказал Фридрих Энгельс, “Жизнь есть способ существования белковых тел”. В 19 веке еще не знали о роли ДНК в наследовании генетической информации, но утверждение дяди Фридриха в значительной мере справедливо до сих пор – основную работу в наших клетках совершают именно белки. Это и поддержание структуры (формы клеток), и химический катализ, и моторная функция (сокращение мышц, например), и транспорт (скажем, белок гемоглобин переносит кислород из легких в ткани и углекислый газ в обратном направлении) и сложные регуляторные функции по поддержанию постоянства внутренней среды (скажем, белковые гормоны и всякие внутриклеточные регуляторные системы) и многие другие. Словом, если в нашем организме что-то происходит, в это обязательно вовлечены белки (хотя и не только они).
2. Что такое белок?
3. Структура белка
Хорошо, с первичной структурой разобрались, но разве белок работает в развернутом линейном виде? Конечно нет. Тут надо заметить, что со структурной точки зрения есть разные классы белков: глобулярные, мембранные и фибриллярные. Мембранные белки, как следует из названия, живут только в клеточных мембранах, для стабилизации их структуры нужно особое окружение мембраны, мы не будем их рассматривать в этом обзоре. Фибриллярные белки имеют простое регулярное строение, похожи на вытянутые волокна, они не растворимы в воде и выполняют структурные функции (например, из кератина состоят волосы, к фибриллярным белкам относится белок из натурального шёлка). Недавно стали выделять класс разупорядоченных белков – белков, не обладающих постоянной трехмерной структурой, либо приобретающих ее только на короткое время при взаимодействии с другими белками. Наиболее интересный с практической точки зрения класс белков, который мы и будем рассматривать – глобулярные водорастворимые белки, к этому классу относится большинство белков.
Линейная полипептидная цепь в воде способна самопроизвольно сворачиваться в сложную трехмерную структуру (глобулу) и только в таком свернутом виде белки могут выполнять химический катализ и прочую интересную работу. Поэтому нам принципиально важно знать именно трехмерную укладку белка, так как только на этом уровне становится понятно, как белок работает.
Вопрос: откуда вообще мы знаем о трехмерных структурах белка?
Ответ: из эксперимента, это абсолютно надежные данные.
Сейчас есть 3 метода для экспериментального определения структуры белка: ядерно-магнитный резонанс (ЯМР), cryo-EM (электронная микроскопия) и рентгеноструктурный анализ кристаллов белка.

ЯМР позволяет определить структуру белка в растворе, но он работает только для очень маленьких белков (для больших невозможно сделать деконволюцию).
Этот метод был важен для общего доказательства того, что у белка только одна трехмерная структура и что структура белка в кристалле идентична структуре в растворе. Это очень дорогой метод, так как требуется получить белок с изотопными метками.

Cryo-EM заключается в простой заморозке раствора белка и микроскопии. Минус метода – низкое разрешение (видна лишь общая форма молекулы, но не видно, как она устроена внутри), плюс плотность белка близка к плотности воды/растворителя, поэтому сигнал тонет в высоком уровне шума. В этом методе активно применяются компьютерные технологии работы с картинками и статистика для вытягивания сигнала из шума.
Отбираются миллионы картинок молекул белка, проводится разделение на классы в зависимости от ориентации молекулы относительно подложки, усреднение по классам, генерация eigenimages, новый раунд усреднения и так пока не сойдется. Потом из информации из разных классов можно восстановить трехмерный вид молекулы с низким разрешением. Если же есть внутренняя симметрия частиц (например, при cryo-EM анализе вирусов), то можно еще каждую частицу поусреднять в соответствии с операторами симметрии – тогда разрешение будет еще лучше, но хуже, чем в случае рентгеноструктурного анализа.
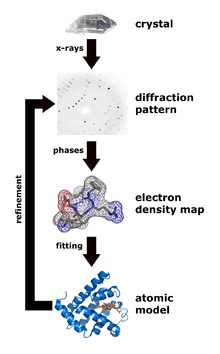
Рентгеноструктурный анализ – основной способ определения структур белка. Главный плюс – потенциально можно получить кристаллы даже очень больших комплексов из многих десятков белков (например, именно так была определена структура рибосомы – Нобелевская премия 2009 года). Минус метода – вначале нужно получить кристалл белка, но далеко не каждый белок хочет кристаллизоваться.
Зато после того, как кристалл получен, по дифракции рентгеновского излучения можно однозначно определить положения всех (упорядоченных) атомов в молекуле белка, этот метод дает самое высокое разрешение и позволяет в лучших случаях видеть позиции отдельных атомов. Было доказано, что структура белка в кристалле однозначно соответствует структуре в растворе.
4. Анализируем структуру
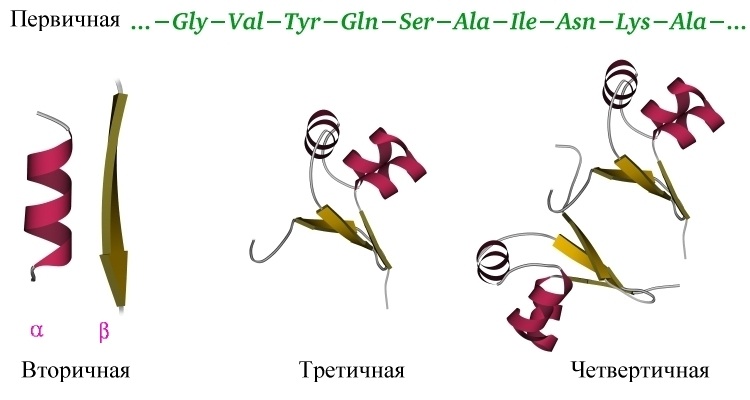
Итак, мы поняли основную идею: белок — линейный полимер, сворачивающийся в водном растворе под действием множества слабых взаимодействий в стабильную и единственную для данного белка трехмерную структуру, и способный в таком виде выполнять свою функцию. Различают несколько уровней организации белковых структур. Выше мы уже познакомились с первичной структурой – линейной последовательностью аминокислот, которую можно выписать в строчку.
Вторичная структура белка определяется взаимодействием атомов основной цепи белка. Как уже было сказано выше, в состав основной цепи белка входят доноры и акцепторы водородной связи, таким образом, основная цепь может приобретать некоторую структуру. Точнее, несколько разных структур (детали все-таки зависят от различающихся боковых групп), так как возможно образование разных альтернативных водородных связей между группами основной цепи. Структуры бывают такие: альфа-спираль, бета-листы (состоящие из нескольких бета-тяжей), которые бывают параллельными и анти-параллельными, бета-поворот. Плюс часть цепи может и не иметь выраженной структуры, например в районе поворота петли белка. Эти типы структур имеют свои устоявшиеся схематичные обозначения – альфа-спираль в виде спирали или цилиндра, бета-тяжи в виде широких стрелок. Вторичную структуру удается достаточно достоверно предсказывать по первичной (стандартом является JPred), альфа-спирали предсказываются наиболее точно, с бета-тяжами бывают накладки.
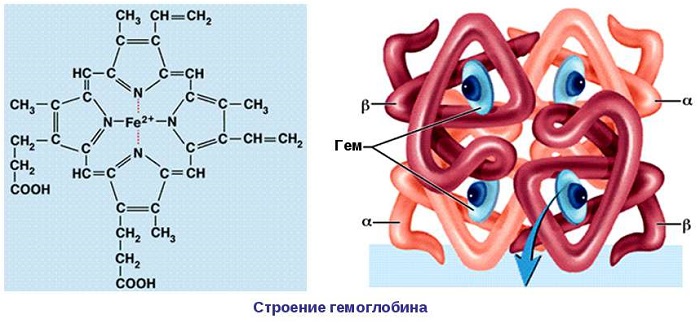
Четвертичная структура белка – да, есть и такая, правда не у всех белков. Многие белки работают сами по себе (мономеры, в данном случае под мономером имеется в виду одиночная свернутая полипептидная цепь, то есть белок целиком), тогда их четвертичная структура равна третичной. Однако достаточно много белков работает только в комплексе, состоящем из нескольких полипептидных цепей (субъединиц или мономеров — димеры, тримеры, тетрамеры, мультимеры), тогда вот такая сборка из нескольких отдельных цепей и называется четвертичной структурой. Самый банальный пример – состоящий из 4 субъединиц гемоглобин, самый красивый на мой взгляд пример – состоящий из 11 одинаковых субъединиц бактериальный белок TRAP.
5. Вычислительные задачи
Белок – сложная система из тысяч атомов, поэтому без использования компьютеров в структуре белка не разобраться. Задач, как решенных на приемлемом уровне, так и совсем не решенных, множество. Перечислю наиболее актуальные:
На уровне вторичной структуры – предсказание той самой вторичной структуры по первичной (JPred)
6. Предсказание структуры белка
Выделил эту вычислительную задачу в отдельный раздел, ибо велика она, фундаментальна и не решается в общем случае.
Экспериментально мы знаем, что если взять белок, полностью развернуть его и бросить в воду, то он свернется обратно в исходное состояние за время от миллисекунд до секунд (это утверждение справедливо по крайней мере для небольших глобулярных белков без всяких патологий). Это значит, что вся информация, необходимая для определения трехмерной структуры белка, в неявном виде содержится в его первичной последовательности, поэтому так хочется научиться предсказывать трехмерную структуру белка по последовательности аминокислот in silico! Однако эта задача в общем случае не решена до сих пор. В чем же дело? Дело в том, что в первичной последовательности отсутствует в явном виде информация, необходимая для построения структуры. Во-первых, нет информации о конформации основной цепи – а она обладает значительной подвижностью, хотя и несколько ограниченной по стерическим причинам. Плюс каждая боковая цепь каждой аминокислоты может находиться в разных конформациях, для длинных боковых групп типа аргинина, это может быть больше десятка конформаций.
Есть инструменты и для моделирования вручную – можно предсказать вторичную структуру и попробовать вручную крутить ее, находя лучшую укладку. Некие гениальные люди даже выпустили игрушку FoldIt, представляющую белок схематично и позволяющую укладывать его, как-бы собирая головоломку (для интересующихся структурой – рекомендую!). Есть абсолютно официальное соревнование для предсказателей белковых структур, называемое CASP. Суть в том, что когда экспериментаторы определяют новую структуру белка, не имеющую аналогов в PDB, они могут не выкладывать ее сразу в PDB, а выставить последовательность этого белка на конкурс предсказаний CASP. Через некоторое время, когда все закончат свои предсказательные модели, экспериментаторы выкладывают свою экспериментально определенную структуру белка и смотрят, насколько хорошо сработали предсказатели. Самое интересное, что игроки FoldIt, не будучи учеными, как-то выиграли CASP у профессионалов моделирования белковых структур и предсказали структуру белка точнее. Однако даже эти успехи не позволяют утверждать, что проблема предсказания структуры белка решается – очень часто модель очень далека от реальной структуры.
Так что, господа программисты, физики и математики, нам еще есть над чем работать.
На этой оптимистичной ноте разрешите откланяться, благодарю всех, кто осилил сей опус.

Как показало изучение свойств белков в растворах, макромолекулы белков имеют форму компактных шаров (глобул) или вытянутых структур – фибрилл. Исследования показали, что в укладке пептидной цепи нет ничего случайного или хаотичного. Она свертывается упорядоченно, для каждого белка определенным образом. Полярные боковые группы аминокислот стремятся расположиться на поверхности глобулы, где могут взаимодействовать с водой, а неполярные группы располагаются внутри.
Для того, чтобы разобраться в замысловатой укладке (архитектонике) белковой макромолекулы, следует рассмотреть в ней несколько уровней организации.
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи.
Она определяется генотипом, т.е. генами организма. В первичной структуре все связи между аминокислотными остатками являются ковалентными и, следовательно, прочными. Разные белки отличаются друг от друга по первичной структуре: кератин имеет одну последовательность аминокислот, пепсин – другую, соматотропин (гормон роста) – третью и т.д. В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером в 1944–1954 гг. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (из 21 и 30 аминокислотных остатков), удерживаемых друг около друга дисульфидными мостиками.
Однако молекула белка в виде цепи аминокислот, последовательно соединенных пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров.
Вторичная структура белка представлена спиралью, в которую закручивается полипептидная цепь. Группы N–H и С=О, входящие в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод.
В то же время из сказанного, очевидно, следует, что, изменив всего лишь одну аминокислоту в каком-либо полипептиде, мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами.
Белки – наиболее важные органические соединения клетки. Их содержание колеблется от 50% до 80% в разных клетках организма .
Строение белков
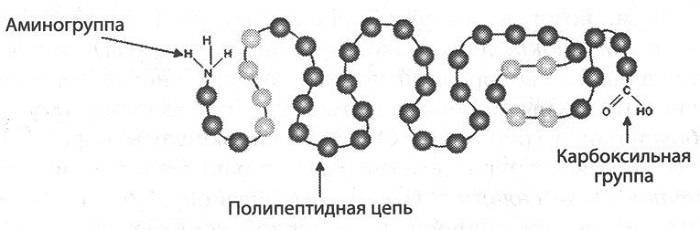
В состав белков, кроме 4 основных химических элементов (углерод, кислорода, водород, азот), могут входит фосфор, сера, железо. Белки – сложные высокомолекулярные соединения, которые составлены из аминокислотных последовательностей. Аминокислоты состоят из двух частей: аминогруппы -NH2 и карбоксильной группы -COOH. Первая несет в себе основные свойства, а вторая – кислотные, что обуславливает активности и амфотерность этих соединений (Амфотерность – проявление кислотных или основных свойств в зависимости от реакции). Аминокислоты отличаются радикалами.

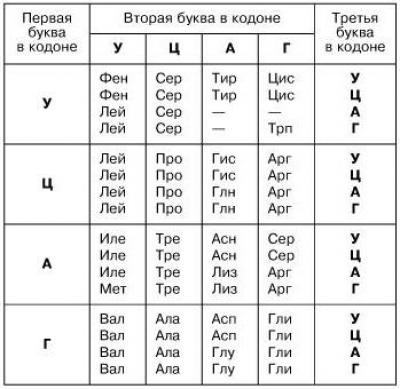
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица аминокислот :
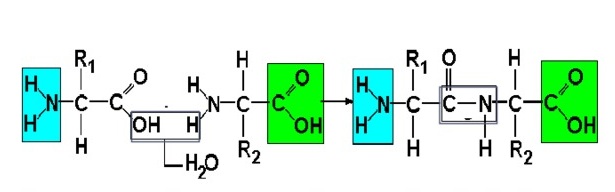
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом – аминогруппа аминокислоты
В состав белка может входить даже несколько аминокислотных цепей. Всего аминокислот насчитывается около 170, однако основное разнообразие задают 20 аминокислот, что связано с тем, что одна аминокислота может кодироваться различными последовательностями кодонов, или другими словами, аминокислота может кодироваться разными триплетами нуклеотидов. Это одно из свойств генетического кода (свойство избыточности).
Некоторые аминокислоты животный организм синтезирует самостоятельно, но, как можно догадаться, не все. Такие аминокислоты называются незаменимыми аминокислотами, их следует употреблять с пищей. Например, лейцин используется не просто как биологическая добавка, что достаточно распространено среди фармакологических компаний, но и применяется при лечении заболеваний печени, а также анемии, она же малокровие.
Классификация белков
Протеины – белки , в состав которых входят только белковые молекулы.
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
- Гликопротеиды (белок + углевод )
- Липопротеиды (белок + липид)
- Нуклеопротеиды (белок + нуклеиновые кислоты )
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много. ДНК была обнаружена именно в форме двойной спирали. В этом виде она наиболее известна.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови гемоглобин состоит из 4х субъединиц четвертичной структуры.
Первичная структура белка – цепь Вторичная структура белка – спираль Четвертичная структура белка – объединение глобул
Денатурация – утрата белковой молекулой своей природной структуры. Это обратимый процесс, похожий на сохранение в игре. Если белок денатурировал, но его природная структура не нарушена, то он восстановится. Причин разрушения белка может быть много: высокая температура, химические повреждения, радиация, обезвоживание и т.д. Так что когда мы варим яйца или мясо, то происходит денатурация белка. Как мы видим, к исходному состояния он уже не возвращается (не ренатурирует). Денатурацию и ренатурацию просто запомнить по похожим словам: денатурация – деградация – разрушение; ренатурация – регенерация – восстановление.
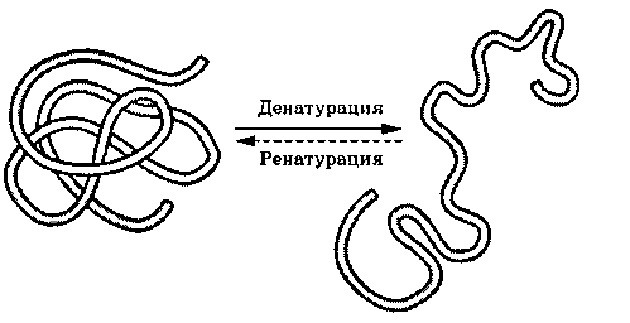
Денатурация и ренатурация
Функции белков
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
Изучая иммунитет , ученики и студенты знакомятся с антителами – специфическими белками крови, которые вырабатываются иммунными клетками лимфоцитами для борьбы с чужеродными организмами или вредными соединениями. Так антитела сражаются за нас, когда мы хватаем где-то микробов, так же эти белки воюют, когда человеку переливают кровь неподходящей группы или пересаживают орган , который его организм отторгает. Переливание крови неподходящей группы может привести к летальному исходу, так как произойдет агглютинация – склеивание эритроцитов.
Некоторые растения и животные вырабатывают яды или токсины для того, чтобы защитить себя от нападения и поедания. Поэтому не следует есть незнакомые ягоды, грибы и ловить где-нибудь в тропиках лягушек. Это может закончиться плачевно.
Кроме оборонительной и атакующей функции во благо защиты организма, есть и латающая. При порезе и кровопотере молекулы белка тромбина объединяются для того, чтобы закрыть поврежденный сосуд, а тем временем, тонкие нити белка фибрина переплетаются на поверхности раны, образуя тоненькую пленочку. Если порез был несерьезным, то кровотечение успешно остановлено.
Некоторые белки являются гормонами. Они отвечают за регуляцию физиологических процессов организма. Наиболее известным примером белкового гормона является инсулин .
Как и углеводы с жирами, белки тоже могут быть расщеплены для получения энергии. Однако, чаще всего, аминокислоты, полученные в результате распада белка, снова используются организмом для построения других белков. Это делает для экономии энергии и биологического материала, ведь в случае повторного использования, не нужно тратиться на синтез новых соединений. При расщеплении 1 г белка высвобождается 17,6 кДж энергии.
A) запасание энергии
B) хранение генетической информации
Г) перенос энергии
Д) входит в состав клеточных стенок и мембран
Е) реализация генетической информации (синтез белка)
2) нуклеиновые кислоты (ДНК, РНК)
Для начала вспомним какие вообще есть классы органических веществ в клетке.
Это белки , жиры , углеводы и нуклеиновые кислоты . Белки , жиры и углеводы являются источниками энергии, но у них есть и более локальные функции:
| Белки | Жиры | Углеводы | Нуклеиновые кислоты |
| Структурная | + | + | |
| Энергетическая | + | + | + |
| Защитная | + | + | |
| Ферментативная | + | ||
| Двигательная | + | ||
| Транспортная | + | ||
| Регуляторная | + | ||
| Рецепторная | + | ||
| Хранение и передача ген .информации | + | ||
| Биосинтез белка | + |
Выберем вначале то,что относится к нуклеиновым кислотам : биосинтез белка и хранение генетической информации .
PS: сигнальная и рецепторная функция — одно и то же.
pазбирался: Ксения Алексеевна | обсудить разбор | оценить

Задание EB21891 Рассмотрите предложенную схему реакции между аминокислотами. Запишите в ответ понятие, обозначающее название химической связи, отмеченной на схеме знаком вопроса.
На данной схеме изображена реакция между двумя аминокислотами, что известно из вопроса. Между ними действуют пептидные связи.
Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
Структура белка необычайно важна для соединений, так как все функции они выполняют, принимая определённую пространственную конфигурацию.
Белки – это природные полимеры, молекулы которых состоят из остатков аминокислот, соединенных амидными (пептидными) связями.
Мономерами для образования макромолекулы служат α-аминокислоты. Это соединения, содержащие аминогруппу у первого атома углерода, не считая углерод карбоксильной группы.
Таких аминокислот известно 20. Из этого количества создаётся всё многообразие белков. Некоторые аминокислоты могут образовываться в организме, их называют заменимыми. Те, которые поступают только с пищей – незаменимые. В зависимости от состава, белки делят на полноценные, содержащие незаменимые аминокислоты, и неполноценные, не содержащие незаменимые аминокислоты.
Состав, строение и функции белков очень сложные, изучает эти вопросы биология. Рассматриваются природные полимеры и в курсе химии. Состав их можно выразить формулой:
В природные полимеры входят химические элементы: углерод, кислород, водород, азот, сера. В состав некоторых соединений включены фосфор, селен железо, медь и прочие элементы.
Первичная структура белка
Последовательно соединенные друг с другом аминокислотные остатки в цепь образуют первичную структуру. Цепь образована пептидной химической связью. Этот уровень организации самый важный. Случайная замена одной аминокислоты вызывает тяжелое генетическое заболевание.
Белковые молекулы образуются в процессе биосинтеза на рибосомах. Здесь реализуется наследственная информация. Последовательность аминокислотных остатков определяется последовательностью нуклеотидов в и-РНК. Зависимость триплетов и аминокислот записана в таблице генетического кода.
Если первичный уровень организации белка задаётся правильно, остальные структуры макромолекула принимает самопроизвольно.
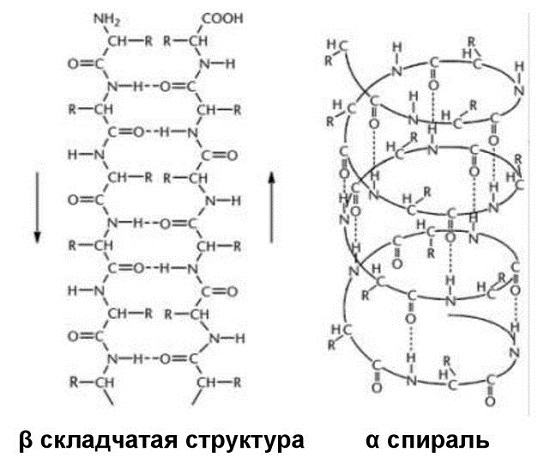
Вторичная структура белка
Свёрнутая в спираль одна или 2 полипептидные цепи образуют вторичную структуру. Её поддерживают водородные связи.
Большинство белковых молекул имеют вторичный уровень.
Третичная структура белка
Упаковка вторичной структуры в клубок образует третичный уровень организации.

Поддерживают данную структуру дисульфидные, солевые, сложноэфирные мостики, силы электростатического взаимодействия.
Четвертичная структура белка
Некоторые белковые единицы формируют сложные агрегаты в пространстве. Несколько упакованных в клубок белков, ориентированных относительно друг друга, создают четвертичную структуру.
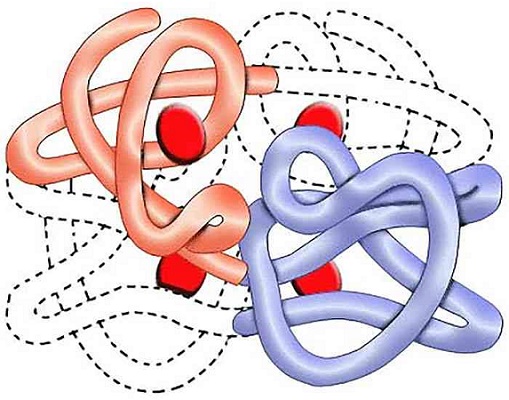
Удерживаются такие агрегаты водородными связями, электростатическими и прочими взаимодействиями.
Денатурация и ренатурация белка
Природные соединения проявляют разные свойства. Одно из важнейших свойств – денатурация белка. Это разрушение пространственной организации белковых молекул. Последовательность соединения аминокислот, а значит и химический состав, не изменяется.
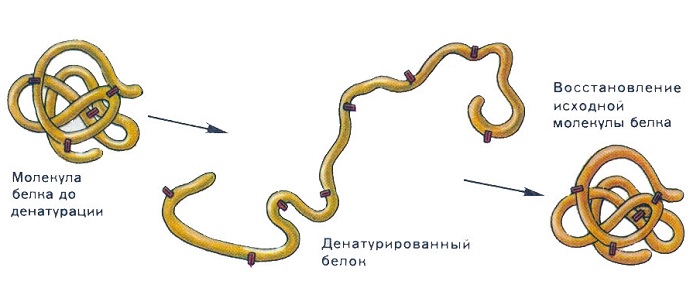
Пространственная конфигурация может разрушаться в результате действия разных факторов:
солей тяжёлых металлов;
механических и иных факторов.
Если первичный уровень организации белка не нарушен, может идти обратная реакция – ренатурация. Это восстановление пространственного строения молекулы. Не все природные полимеры способны к восстановлению пространственной организации.
Иногда денатурация протекает необратимо, хотя первичная структура не разрушается. Функции белки способны выполнять, находясь в определенной пространственной конфигурации.
Протеины – простые белки
К простым белкам относят высокомолекулярные соединения, состоящие только из остатков аминокислот. В них содержатся незаменимые и заменимые аминокислоты.

Протеины применяются в спортивной среде для восполнения белковой массы в организме. Используют протеиновый порошок для приготовления коктейля, в качестве добавки к пище.
Протеиновый порошок получают в результате переработки продуктов животного происхождения: молока, мяса, яиц, рыбы. Организм будет получать протеины, если просто употреблять в пищу указанные продукты. Усвоение их будет идти медленнее.
Протеиды – сложные белки
Сложными называют белки, содержащие небелковые по природе вещества. Так называемые простетические группы.
В соответствии с химическим составом и наличием групп их классифицируют:
гликопротеиды и другие.
В состав протеидов входят элементы: магний, железо, медь и другие. Примером протеидов являются гемоглобин и миоглобин. Они выполняют важнейшие функции, принимают участие в обменных процессах.
Незаменимые аминокислоты — это необходимые для организма аминокислоты, которые не могут быть организмом синтезированы. Для разных видов организмов список незаменимых аминокислот различен. Все белки, синтезируемые организмом, собираются в клетках из 20 базовых аминокислот, незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин; также часто к незаменимым относят гистидин, для детей также незаменимым является аргинин. Невозможность сборки определенного белка организмом приводит к нарушению его нормальной работы, поэтому необходимо поступление незаменимых аминокислот в организм с пищей.
Вопросы и задания
Чем структура белков как биополимеров отличается от структуры полисахаридов?
Различие состоит в мономерах. У белков — аминокислоты, при том, они могут быть разными (в формировании белков принимают участие 20 основных аминокислот. Средний размер белка — около 300 аминокислот), а у полисахаридов звенья остаточных моносахаридов; у полисахаридов строение проще, чем у белков, белки имеют огромное структурное разнообразие.
2. Вопрос
Объясните механизм образования пептидной связи.
Аминокислота — это сложное органическое соединение, молекула которого состоит из радикала (-R), карбоксильной (- СООН) и аминогруппы (- NH2).
Аминогруппа одной кислоты, взаимодействует с карбоксильной группой другой кислоты, в результате выделяется молекула воды и образуется разновидность прочной ковалентной связи которая называется Пептидной. При соединении большого числа аминокислот образуется полипептид.
3. Вопрос
Чем третичная структура белка отличается от первичной и вторичной?
Третичная структура белка является результатом сложной трехмерной укладки в пространстве полипептидной цепи. Цепь поддерживается связями между радикалами аминокислот.
Первичная структура белка образована аминокислотами объединенными через пептидные связи.
Вторичная структура представляет собой закрученную спираль, которая формируется за счет водородных связей между карбо-и аминогруппами аминокислотных остатков полипептидной цепи.
4. Вопрос
Почему происходит денатурация белка? Как она отражается на его свойствах?
Под воздействием внешних сил — изменение температуры, повышение кислотности среды- происходит разрушение связей которые поддерживают в пространстве вторичную, третичную и четвертичную структуру белка. Белок теряет свою способность к выполнению биологической функции, такая потеря свойств называется денатурацией.
Денатурация может обратимой и необратимой.
5. Вопрос
Какие функции белков уникальны, не присущи другим биополимерам клетки?
Только белки осуществляют перенос веществ в крови (липопротеины (перенос жира), гемоглобин (транспорт кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы).
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях.
Высокой специфичностью действия наделены также белки, которые участвуют в таких процессах, как дифференцировка и деление клеток, развитие живых организмов, определяя их биологическую индивидуальность.
Читайте также:

