Чем сложные вещества отличаются от простых приведите примеры простых и сложных веществ кратко
Обновлено: 04.07.2024
В неорганической химии вещества по составу делятся на простые и сложные.
- состоят из атомов одного химического элемента: сера S, углерод С, железо Fe, серебро Ag;
- подразделяют на металлы и неметаллы (включая благородные газы).
Сложные вещества — соединения:
- состоят из атомов двух или более химических элементов: N a 2 O , H C l , C u S O 4 ;
- подразделяют на: оксиды, основания, кислоты и соли.
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
- газообразные: водород H 2 , азот N 2 , фтор F 2 ;
- жидкие: только бром B r 2 ;
- твёрдые: кремний Si, бор B, мышьяк As.
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- обнаруживаются в воздухе, в малых количествах — в воде, горных породах, природных газах;
- не имеют цвета, вкуса и запаха;
- крайне химически инертны;
- используются в источниках света для создания освещения различных цветов (Ne — огненно-красный, Xe— синевато-серый, тусклый, Ar — фиолетово-голубой и др).
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
- Свойства элементов, входящих в соединение, не сохраняются. Например, металл кальций Ca и неметалл хлор C l 2 . Каждому из этих простых веществ присущи свои характеристики. А соль C a C l 2 имеет новые, отличные от характеристик простых веществ, свойства, сходные со свойствами класса солей.
- В ходе химических реакций сложное вещество может быть получено или разложено на составные части.
- Количественный состав сложного соединения всегда одинаков, независимо от места нахождения и способа получения (для веществ молекулярного состава).
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
- газы: N O , C O 2
- жидкости: H 2 O
- твёрдые: C u O , S i O 2
- газы: H 2 S , H C l
- жидкости: H N O 3 , H 2 S O 4
- твёрдые: H 3 P O 4 , H 3 B O 3
- оксиды металлов (оснóвные): K 2 O , CaO;
- оксиды неметаллов (кислотные): N 2 O 5 , S O 3 ;
- амфотерные: ZnO, A l 2 O 3 .
- оснóвные: LiOH, C a ( O H ) 2 ;
- амфотерные: B e ( O H ) 2 , C r ( O H ) 3 .
- кислородсодержащие: H 2 S O 4 , H N O 3 ;
- бескислородные: H J , H 2 S .
- средние: N a 3 ( P O 4 ) 2 , C a C l 2 ;
- кислые: K H C O 3 , N a 2 H P O 4 ;
- оснóвные: Mg(OH)Cl, C u 2 ( O H ) 2 C O 3 ;
- комплексные: K 2 [ B e ( C O 3 ) 2 ] .
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
| Ag — аргент | C — карб, карбон | H — гидр, гидроген | N — нитр | Pb — плюмб, | Si — сил, силик, силиц |
| As — арс, арсен | Cu — купр | Hg — меркур | Ni — никкол | S — сульф | Sn -станн |
| Au — аур | Fe — ферр | Mn — манган | O — окс, оксиген | Sb — стиб | |
| Например, оксид натрия N a 2 O , карбонат кальция C a C O 3 , перманганат калия K M n O 4 | |||||
- Названия простых веществ чаще всего совпадают с русскими названиями соответствующих химических элементов. По необходимости к ним добавляется числовая греческая приставка: моно — 1, ди (латинский) — 2, три — 3, тетра — 4, пента — 5, гекса — 6, гепта — 7, окта — 8, нона (латинский) — 9, дека — 10. Например, (моно) кальций Ca, (моно) медь Cu, дикислород O 2 , трикислород O 3 , тетрафосфор P 4 . Исключение: аллотропные модификации: углерода С — графит, сажа, алмаз; кислорода — озон O3.
- Названия сложных веществ составляют по химической формуле справа налево. Для каждого класса веществ существуют свои правила составления формул и названий:
- формула оксидов: ЭnOm, где n и m — числовые индексы, определяющиеся степенями окисления элементов. Например,
Li+1 и O-2→ L i 2 O ; Al+3 и O-2→ A l 2 O 3 ; N+5 и O-2→ N 2 O 5 .
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид S O 3 , азотный ангидрид N 2 O 5 и др.
- формула оснований: Me+n(OH-)n, где нижний индекс n — количество гидроксид-анионов OH-.
K+1 и OH- → KOH, Mg+2 и OH- → M g ( O H ) 2 .
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
F e ( O H ) 2 — гидроксид железа (II), C r ( O H ) 3 — гидроксид хрома (III).
- формула кислот HnК, где K — кислотный остаток.
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| H A l O 2 метаалюминиевая | метаалюминат |
| H 3 A l O 3 ортоалюминиевая | ортоалюминат |
| H A s O 3 метамышьяковая | метаарсенат |
| H 3 A s O 4 ортомышьяковая | ортоарсенат |
| H 3 B O 3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| H B r O 3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H 2 C O 3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| H C l O 2 хлористая | хлорит |
| H C l O 3 хлорноватая | хлорат |
| H C l O 4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| H M n O 4 марганцовая | перманганат |
| H N O 2 азотистая | нитрит |
| H N O 3 азотная | нитрат |
| H P O 3 метафосфорная | метафосфат |
| H 3 P O 4 ортофосфорная | ортофосфат |
| H 2 S сероводородная | сульфид |
| H 2 S O 3 сернистая | сульфит |
| H 2 S O 4 серная | сульфат |
| H 2 S i O 3 метакремниевая | метасиликат |
| H 3 S i O 4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Названия строятся по схеме: к корню более электроотрицательного элемента добавляется окончание -ид (оксид, гидрид, карбид и т.д.) в именительном падеже + название второго элемента в родительном падеже, при необходимости добавляется числовое значение степени окисления: C S 2 — дисульфид углерода или сульфид углерода (IV), M n F 4 — тетрафторид марганца или фторид марганца (IV).
Для некоторых есть тривиальные названия: N H 3 — аммиак, S i Н 4 — силан, P H 3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
- одноатомные: благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn;
- двухатомные: водород H 2 , кислород O 2 , азот N 2 и галогены: хлор C l 2 , йод J 2 , бром B r 2 ;
- трех и более атомные: озон O 3 , белый фосфор P 4 , кристаллическая (ромбическая и моноклинная) сера S 8 .
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
- неметаллами:
- +кислород O 2 (кроме золота и металлов группы платины) → оксиды: 2 C a + O 2 → 2 C a O ;
- +галогены ( F 2 , C l 2 , B r 2 ) → галогениды (фторид, хлорид, бромид и т.д.): C u + B r 2 → C u B 2 ;
- +азот, фосфор, сера, водород → нитриды, фосфиды, сульфиды, гидриды: 3 C a + N 2 → C a 3 N 2 .
- водой (только щелочные и щелочно-земельные металлы) → гидроксиды: 2 N a + 2 H 2 O → 2 N a O H + H 2 ↑ ;
- кислотами (металлы, стоящие в ряду активности до водорода) → соль: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- растворами солей менее активных металлов: F e + C u S O 4 → F e S O 4 + C u , при следующих условиях:
- соли, вступающие в реакцию и получающиеся в ходе нее, должны быть растворимы;
- металл вытесняет из соли другой металл, если находится левее в ряду активности;
- щелочные и щелочно-земельные металлы в данном случае будут вступать в реакцию с водой, а не с солью.
- оксидами (более активный металл вытесняет менее активный): F e 2 O 3 + 2 A l → A l 2 O 3 + 2 F e .
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
- окислительные свойства наиболее характерны (стремятся присоединять электроны) в реакциях с:
- металлами: O 2 + 2 M g → 2 M g O ; S + 2 N a → N a 2 S ;
- неметаллами:
- кислород O 2 (из галогенов реагирует только фтор): S + O 2 → S O 2 ;
- водород H 2 (кроме кремния, фосфора и бора) : С + 2 H 2 → C 4 ;
- неметалл c меньшей электроотрицательностью: 3 S + 2 P → P 2 S 3 (нагревание без доступа воздуха, сера — окислитель);
- солями (вытесняют менее активные неметаллы): C l 2 + 2 N a B r → 2 N a C l + B r 2 .
- восстановительные свойства (исключение: фтор F — всегда окислитель) в некоторых реакциях с:
- неметаллами, электроотрицательность которых ниже: C + O 2 → C O 2 (углерод — восстановитель);
- сложными веществами — окислителями ( C u O , H N O 3 ) : S + 6 H N O 3 → H 2 S O 4 + 6 N O 2 ↑ + 2 H 2 O .
- и окислительные, и восстановительные свойства проявляют хлор, сера, фосфор, йод и бром в реакциях диспропорционирования:
- C l 2 0 + H 2 O → H C l - 1 + H C l + 1 O ;
- 3 S 0 + 6 N a O H → 2 N a 2 S - 2 + N a 2 S + 6 O 3 + 3 H 2 O .
Химические свойства благородных газов
- плохо растворяются в воде и вступают в реакции с другими веществами только в специально созданных условиях;
- не горят; вытесняют кислород из воздуха, снижая его содержание до критически низких показателей, приводящих к смерти.
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
- оснóвные + кислоты → соли: C a O + 2 H C l → C a C l 2 + H 2 O ;
- кислотные + основания → соли: S O 3 + 2 N a O H → N a 2 S O 4 + H 2 O ;
- амфотерные реагируют и с кислотами, и с основаниями → соли:
Z n O + H 2 S O 4 → Z n S O 4 + H 2 О ,
Z n O + 2 N a O H + H 2 O → N a 2 [ Z n ( O H ) 4 ] .
Все основания реагируют с кислотами (реакция нейтрализации):
- K O H + 2 H C l → K C l + H 2 O ;
- 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O .
1. Щелочи взаимодействуют с:
- неметаллами: 6 K O H + 3 S → K 2 S O 3 + 2 K 2 S + 3 H 2 O ;
- кислотными оксидами: 2 N a O H + N O 2 → N a N O 2 + N a N O 3 + H 2 O .
2. Нерастворимые основания разлагаются при нагревании: C u ( O H ) 2 → C u O + H 2 O .
- + основания (реакция нейтрализации): 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O ;
- + металлы, стоящие левее водорода в ряду активности: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- + основные и амфотерные оксиды: C a O + H 2 S O 4 → C a S O 4 + H 2 O ; Z n O + H 2 S O 4 → Z n S O 4 + H 2 O ;
- + соли: B a C l 2 + H 2 S O 4 → B a S O 4 + 2 H C l .
- + кислоты (сильные): N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l ;
- + щёлочи, если образуется нерастворимое основание: F e C l 3 + 3 N a O H → F e ( O H ) 3 ↓ + 3 N a C l ;
- + металлы: Z n + P b ( N O 3 ) 2 → P b ↓ + Z n ( N O 3 ) 2 ;
- + соли при условии необратимости реакции: N a 2 C O 3 + C a ( N O 3 ) 2 → C a C O 3 ↓ + 2 N a N O 3 .
Простые и сложные вещества различаются видами атомов. Сложные вещества - вода, углекислый газ. Простыми веществами являются металлы (железо, медь, золото, серебро) и неметаллы (сера, фосфор, гранит и многие другие).
Как написать хороший ответ? Как написать хороший ответ?
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.

В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
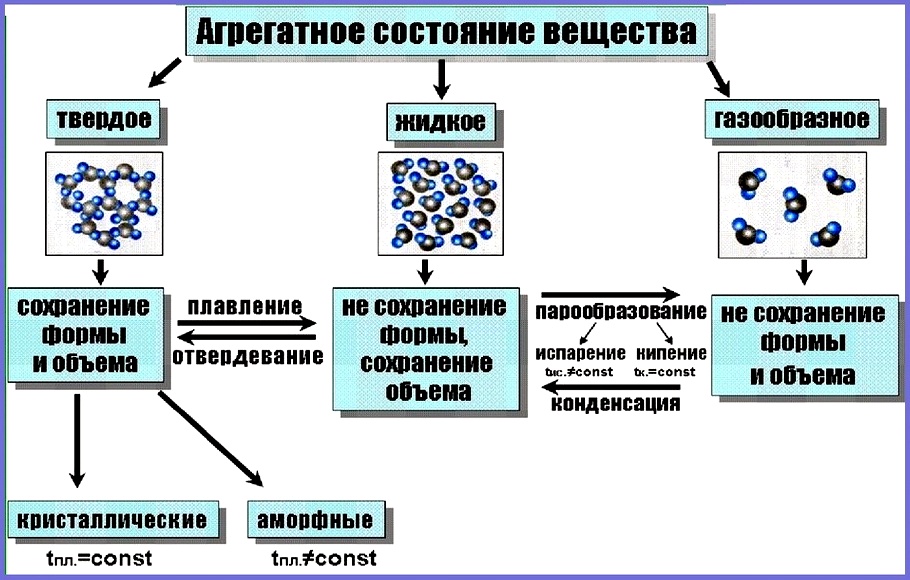
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.

Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
Аллотропия
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями. Примеры аллотропии:
С (углерод) — алмаз, графит, карбин, фуллерен, графин;
О (кислород) — собственно кислород, озон;
Р (фосфор) — белый, красный, черный, фиолетовый;
S (сера) — ромбическая, моноклинная, пластическая;
Si (кремний) — аморфный, кристаллический;
As (мышьяк) — желтый, серый, черный.
Чем сложные вещества отличаются от простых? Приведите примеры простых и сложных веществ.
Если в состав веществ входят атомы одного вида, то такие вещества называют простыми. Это хорошо известные вам металлы (железо, медь, золото, серебро) и неметаллы (сера, фосфор, графит и многие другие).
Вещества, состоящие из частиц, образованных атомами разных видов, называют сложными. Например, вода, углекислый газ.
Ещё по теме
Каково значение регуляции в жизнедеятельности организмов?
Предложи гипотезы, объясняющие, что мешает хвощам и папоротникам вытеснить хвойные деревья на территориях, где обитают и те и другие.
Каких животных называют растительноядными?
Почему организмы, обитающие в наземно-воздушной среде, более многообразны, чем обитающие в водной?
Назовите основные группы растений и охарактеризуйте их.
В чём проявляется поведение?
Сконструируйте установку по разведению микроскопических водорослей. Как вы будете извлекать водоросли из этой установки?
По каким признакам можно отличить живую природу от неживой?
Что такое грибница и плодовое тело гриба?
Жизнь каких животных неразрывно связана как с водой, так и с сушей?
Если материал понравился Вам и оказался для Вас полезным, поделитесь им со своими друзьями!
О сайте
На нашем сайте вы найдете множество полезных калькуляторов, конвертеров, таблиц, а также справочных материалов по основным дисциплинам.
Самый простой способ сделать расчеты в сети — это использовать подходящие онлайн инструменты. Воспользуйтесь поиском, чтобы найти подходящий инструмент на нашем сайте.
На сайте используется технология LaTeX.
Поэтому для корректного отображения формул и выражений
пожалуйста дождитесь полной загрузки страницы.
Читайте также:
- Характерные особенности исполнительной власти как вида государственной деятельности кратко
- Какие процессы происходят в крови организма человека при физической нагрузке кратко
- Роль философии в профессиональной деятельности юриста кратко
- Что такое чистое познание по канту кратко
- Уфа школа 76 педагогический состав

