Чем отличается ионная связь от ковалентной кратко
Обновлено: 08.07.2024
То, что не видно человеческому глазу, всегда вызывает у людей любопытство. Они не только хотят знать больше о таких вещах, но также предполагают определенные моменты, которые могут быть не совсем точными, но удовлетворяют человеческую природу любознательности. Химия — это такая тема, в которой обсуждаются такие аспекты, которые не видны, и такие два термина, используемые в этой теме, — это ковалентные и ионные связи. Оба они противоположны друг другу и имеют разные свойства, которые будут обсуждаться в следующих строках. Облигации — это сущности, которые объединяют две вещи. Чтобы увидеть различия между ними, необходимо дать определение этим двум терминам. Ковалентная связь — это химическая связь, которая создается разделением двух электронных пар между атомами. Ионная связь, с другой стороны, это процесс передачи одного электрона другому атому. Он не создает никаких пар, таких как электроны, и имеет тенденцию передавать их другим атомам. Другое различие между ними заключается в том, что ковалентные связи имеют низкий уровень притяжения друг к другу, в то время как ионные связи имеют высокий уровень привлекательности. Основное различие состоит в том, что в ковалентных связях связь происходит между двумя неметаллами, но в ионных связях полярность имеет место между металлом и неметаллическим веществом. Ионные связи не имеют надлежащей формы из-за их изменяющейся структуры, когда они получают или отдают электрон, но всегда есть хорошая форма в случае ковалентных связей. Ковалентная связь известна как молекулярная связь, а ионная связь известна как электровалентная связь. Из-за их неправильной структуры, ионные связи имеют высокую температуру плавления, но поскольку ковалентные связи имеют правильную структуру, они имеют низкую температуру плавления. То же самое и с температурами кипения этих двух связей. Другое главное различие между этими двумя связями заключается в том, что ковалентная связь может существовать в газообразном или водянистом состоянии при комнатной температуре, в то время как ионные связи всегда находятся в стабильном состоянии. Краткое объяснение обоих этих типов химических связей дано в следующих двух абзацах для лучшего понимания.
Сравнительная таблица
| Ковалентный | Ионный | |
| Формирование | Образуется, когда электроны соединяются в пары | Образуется, когда электроны передаются от одного атома другому. |
| Разновидность | Всегда образуется между двумя неметаллическими веществами | Всегда создается между металлическими и неметаллическими элементами. |
| Состояние | При комнатной температуре это либо газ, либо жидкость. | Всегда твердый при нормальной температуре |
| Полярность | Низкий | Высокий |
Определение ковалентной связи
Ковалентная связь — это химическая связь, которая создается разделением двух электронных пар между атомами. Эти электронные пары известны как связывающие пары из-за распределения и создают равенство между положительными и отрицательными силами между атомами. У них много свойств, таких как определенная структура, которая дает им возможность выглядеть должным образом. У них низкая температура плавления и температура кипения. Эти факторы делают их плохими проводниками электричества. В основном все ковалентные связи можно найти в газе, жидкости и твердом состоянии, но при комнатной температуре они не могут существовать в стабильном состоянии. Поскольку они соединены вместе, на них нет зарядов, и, следовательно, они не символизируют никакой полярности и нерастворимы в воде. Лучшим примером ковалентных связей является соляная кислота и метан.
Определение ионной связи
Ионную связь можно объяснить как процесс передачи одного электрона другому атому. Он не создает никаких пар, таких как электроны, и имеет тенденцию передавать их другим атомам. Обычно в результате этого процесса образуются два заряженных иона, противоположных друг другу. Металл становится положительно заряженным, когда он дает электрон, и становится отрицательным, когда он получает электрон. Он всегда образуется между двумя металлическими и неметаллическими веществами. Поскольку неметаллы прочнее металлов, они могут быстро получить электрон от металлов, чтобы завершить себя. Они обладают отрицательным зарядом среди них, в то время как металлы, которые отдают электроны, имеют положительный заряд. Между различными заряженными частицами существует притяжение, из-за которого происходит это соединение. Лучшими примерами ионных связей являются серная кислота и хлорид натрия. Они не имеют правильной формы и имеют высокие температуры плавления и кипения из-за своей конструкции. Они всегда доступны в твердом виде при комнатной температуре и являются отличными проводниками электричества. Еще одна особенность в том, что они растворимы в воде.
Отличия в двух словах
- Ковалентные связи образуются, когда электроны соединяются вместе в виде пар, а ионные связи образуются, когда электроны передаются от одного атома другому.
- Ковалентные связи всегда образуются между двумя неметаллическими веществами. Ионные связи всегда создаются между некоторыми металлическими и неметаллическими элементами.
- Ковалентная связь при комнатной температуре находится в газообразном или жидком состоянии. Состояние ионной связи всегда твердое при нормальной температуре.
- Ковалентные связи имеют низкие температуры плавления и кипения, в то время как ионные связи имеют более высокие температуры плавления и кипения.
- Ковалентные связи имеют низкую полярность, тогда как ионные связи более склонны к притяжению между электронами.
- Ковалентные связи всегда имеют определенную структуру, в то время как ионные связи не имеют надлежащей формы.
- Лучшим примером ионных связей будет хлорид натрия, а лучшим примером ковалентных связей будет хлористоводородная кислота.
- Ковалентные связи являются плохими проводниками электричества, в то время как ионные связи проводят электричество при плавлении.
- Ионные связи растворимы в воде, но не растворимы в других жидкостях, в то время как ковалентные связи не растворимы в воде, но растворимы в неполярных жидкостях.
Заключение
Химия может быть сложной для понимания темой, и термины, связанные с ней, могут стать головной болью для людей, которые не имеют большого представления о предмете. Облигации являются важным фактором и поэтому были объяснены здесь должным образом, чтобы можно было выработать четкое понимание, и, надеюсь, эта статья помогла бы в этом.
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
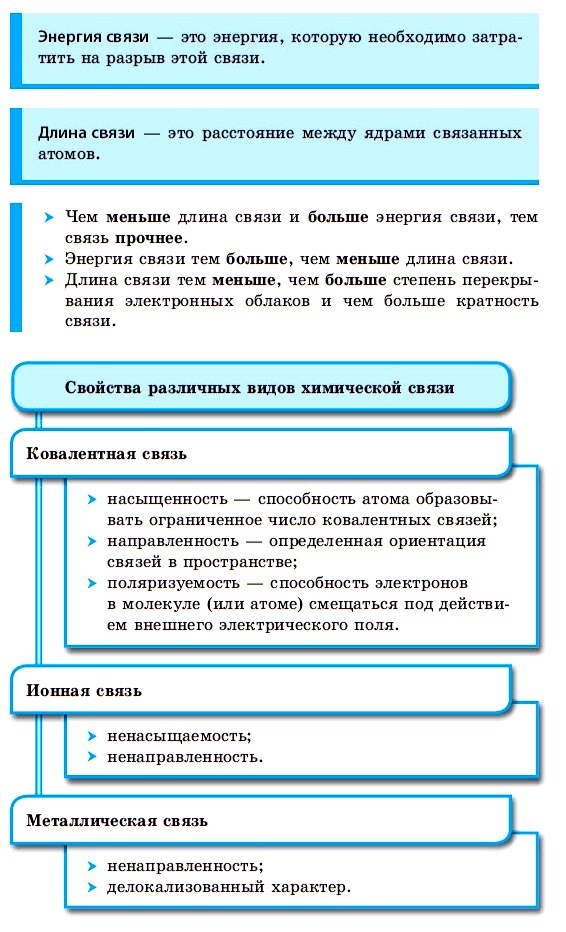
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.

Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.

Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.

При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:

В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.

В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.

Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь

В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.

Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.

■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:


Разница между ионными и ковалентными соединениями - Разница Между
Содержание:
Основное отличие - ионные и ковалентные соединения
Почти все соединения в химии могут быть широко разделены на ионные и ковалентные соединения. Они отличаются друг от друга из-за типа связи между атомами, которые принимают участие в создании молекулы / соединения. Как следует из их имен, ионные соединения состоят из ионных связей, а ковалентные соединения состоят из ковалентных связей. Ионные связи возникают между двумя видами, которые электростатически притягиваются друг к другу, в то время как ковалентные атомы связываются ковалентно через обмен электронами между их внешними оболочками, Это главное отличие между ионными и ковалентными соединениями. Как правило, металлические элементы имеют тенденцию образовывать ионные соединения, а неметаллические элементы заканчивают формировать ковалентные связи.
Какие Ионные Соединения

Что такое ковалентные соединения
Это соединения, образованные ковалентно связанными атомами. Ковалентные связи намного слабее ионных связей, и, следовательно, большинство ковалентных соединений существует в газовой фазе. Как упоминалось выше, атомы должны образовывать соединения для достижения стабильной электронной конфигурации. И третий способ получения этого (помимо раздачи и принятия электронов, как упоминалось в случае ионных связей) - это совместное использование электронов.

Разница между ионными соединениями и ковалентными соединениями
Определение
ионный соединения состоят из ионных связей, где атомы электростатически притягиваются друг к другу.
Ковалентная соединения состоят из ковалентных связей, где электроны распределяются между атомами, участвующими в пласте.
Вовлеченные виды
ионный соединения происходят через взаимодействие между катионами и анионами.
Ковалентная соединения происходят через взаимодействие нейтральных атомов.
Прочность
ионный связи являются наиболее сильным типом химической связи, и поэтому большинство соединений остаются твердыми с очень высокими температурами плавления.
По сравнению, ковалентная связи довольно слабые, и, следовательно, большинство соединений существует в газовой фазе.
Электрическая проводимость
ионный соединения становятся хорошей проводящей средой в жидкой форме.
Ковалентная соединения не являются хорошими электрическими проводниками.
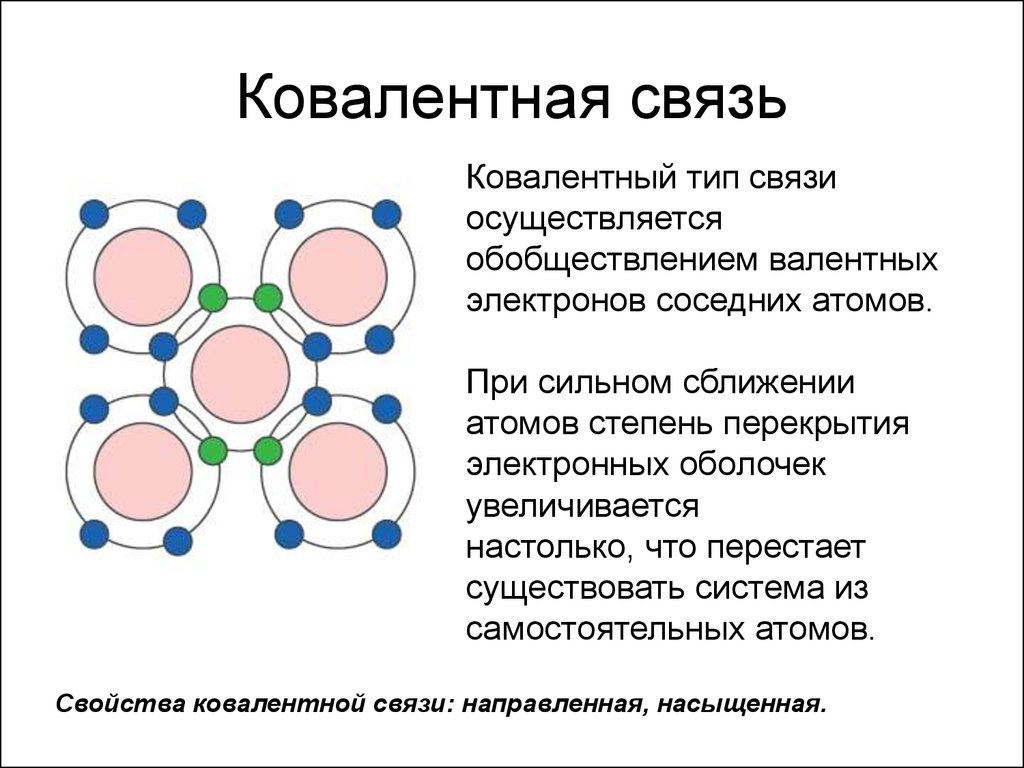
В химии выделяется два основных вида ковалентной связи: полярную и неполярную. Первая образуется между атомами различных неметаллов, вторая между атомами одного и того же химического элемента. Неполярная ковалентная связь характерна доя простых веществ, таких как C12, О2 и другие. Ковалентная связь считается наиболее общим видом химической связи.
Предельным случаем ковалентной полярной связи считается ионная связь. Она возникает между химическими элементами с очень сильно отличающимися показателями электроотрицательности. К примеру, ионная связь наблюдается между атомами щелочных металлов и галогенов. При сближении таких элементов валентные электроны одного атома полностью переходят на второй атом. Как следствие, оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Допустим, в результате взаимодействия атомов натрия и хлора появляются ионы Na+ и Cl- с электростатическим напряжением.
Взаимодействие отрицательных и положительных ионов не зависит от направления, а кулоновские силы не обладают свойством насыщенности.
Ионная связь, как правило, рассматривается через классические законы электростатики. В чистом виде данный вид ковалентной связи встречается только у веществ в парообразном состоянии. Положительные и отрицательные ионы связаны электростатическими силами и располагаются рядами. К каждому иону притягивается такое количество ионов противоположного знака, чтобы их хватило для образования кристаллической решетки. Следует отметить, что в ионном кристале нет молекул. При переходе вещества в жидкое состояние путем плавления или растворения, положительные и отрицательные ионы переходят в полученное вещество.
Необходимо упомянуть, что ионная связь отличается повышенной прочностью. Для разрушения ионного кристалла требуются внушительные затраты энергии. Кроме того, ионные соединения характеризуются высокими температурами плавления.
Ключевым отличием ионной связи является отсутствие свойств направленности и насыщаемости. Ионы создают электрическое поле со сферической симметрией. Такое поле идентично воздействует на каждый ион, поэтому их число и пространственное расположение определяется исключительно размером и величиной заряда.
Читайте также:

