Таблица менделеева для школы
Обновлено: 07.07.2024
Периодическая система элементов Д. И. Менделеева
Таблица Менделеева - это, вероятно, одна из наиболее часто используемых таблиц. Вряд ли найдется хотя бы один человек старше 14 лет, который ни разу не слышал о ней. Это неудивительно, ибо эта таблица - кладезь полезной информации для любого химика. Напомню основное.
- В каждой ячейке данной таблицы указаны название химического элемента, его символ, порядковый номер и приближенное значение атомной массы.
- Порядковый номер элемента совпадает с количеством протонов в ядре атома данного элемента и с количеством электронов в атоме.
- Элементы, расположенные в таблице Менделеева в одной группе (в одном вертикальном ряду) и в одной подгруппе, имеют похожие свойства.
- Свойства элементов в периодах (горизонтальных рядах) изменяются похожим образом. Например, 2-й и 3-й периоды включают 8 элементов, начинаются со щелочного металла, заканчиваются благородным газом.
Последние два пункта - следствия периодического закона , который в современной формулировке звучит так:
Свойства элементов и образуемых ими соединений находятся в периодической зависимости от заряда ядра атома.
Периодический закон Менделеева - один из основных законов химии, а таблица, которую мы обсуждаем, является лишь средством, позволяющим наглядно выразить этот закон.
Я предлагаю вам несколько вариантов таблицы Менделеева:
Классический вариант таблицы Менделеева
Вероятно, именно такой вариант периодической таблицы является для вас наиболее привычным. Нечто подобное мы видим в любом школьном учебнике химии. К сожалению, данный вариант (т. н. короткопериодный) не очень наглядно отражает периодический закон. Возьмите, например, элементы седьмой группы: ярко выраженные неметаллы (F, Cl, Br, I) соседствуют здесь с типичными металлами (Mn, Tc, Re). А ведь мы ожидаем видеть в одной группе элементы с похожими свойствами.
Приходится выделять т. н. главные и побочные подгруппы, прибегать к другим ухищрениям (например, "вырезать" из таблицы лантаноиды и актиноиды). В действительности, правильный вариант таблицы Менделеева выглядит так, а короткопериодная форма - это некоторый компромиссный вариант, который используется в целях экономии места.
| *Лантаноиды |
Длиннопериодная форма таблицы МенделееваИменно нечто подобное и было создано Дмитрием Ивановичем Менделеевым. Именно такой вариант таблицы наиболее наглядно иллюстрирует периодический закон. К сожалению, у длиннопериодной формы есть один недостаток: таблица занимает слишком много места. Именно поэтому многие отдают предпочтение короткопериодной форме.
Таблица Менделеева с выделением s-, p-, d-, f- элементовРазными цветами в данном варианте таблицы Менделеева отмечены s-, p-, d- и f- элементы. Напоминаю, что элемент относится к одному из этих типов, если внешние электроны в атоме данного элемента находятся соответственно на s-, p-, d- или f- подуровне. Например, электронная формула натрия имеет вид: 1s 2 s2s 2 2p 6 3s 1 . Внешний электронный уровень - 3s, следовательно, натрий относится к s-элементам. Электронная формула кислорода: 1s 2 s2s 2 2p 4 . Внешний электронный подуровень - 2p, значит кислород - это р-элемент. Свойства элементов из этих 4 групп отличаются достаточно сильно. Например, среди d-элементов присутствуют только металлы, а большинство неметаллов относятся к p-элементам. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периоды | Группы элементов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Высшие оксиды | R 2 O | RO | R 2 O 3 | RO 2 | R 2 O 5 | RO 3 | R 2 O 7 | RO 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Водородные соед. | RH 4 | RH 3 | H 2 R | HR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| *Лантаноиды |
Таблица Менделеева, в которой отмечены металлы и неметаллыНеметаллы отмечены в этой таблице красным цветом. Обратите внимание: неметаллы сосредоточены в правой верхней части таблицы Менделеева. Все они, кроме водорода и гелия, относятся к p-элементам. Вы не найдете ни одного неметалла среди d-элементов и f-элементов. Именно по этой причине я счел возможным не приводить в данном варианте список лантаноидов и актиноидов - все они относятся к металлам. Иногда особым образом выделяют группу элементов, сочетающих в себе свойства металлов и неметаллов (например, к ним можно отнести германий). Данные элементы называют полуметаллами или металлоидами. | |||||||||
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 | ||||||||||
| Высшие оксиды | R 2 O | RO | R 2 O 3 | RO 2 | R 2 O 5 | RO 3 | R 2 O 7 | RO 4 | ||
| Водородные соед. | RH 4 | RH 3 | H 2 R | HR | ||||||

Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных - серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K - в главной подгруппе, Cu и Ag - в побочной. Свойства натрия и калия весьма похожи - активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) - типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете длиннопериодную форму таблицы Менделеева: "мешанина" из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.
Таблица Менделеева (периодическая система химических элементов) - это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 - 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец - это группа, определяющая основные физико-химические свойства, а строки - это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента - это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
2 элемента (1s 2 )
18 элементов (5s 2 4d 10 5p 6 )
8 элементов (2s 2 2p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
8 элементов (3s 2 3p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
18 элементов (4s 2 3d 10 4p 6 )
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
внешний (n) s-подуровень
внешний (n) р-подуровень
предвнешний (n–1 ) d-подуровень
(n-2)f 1–14 (n-1)d 1–10 ns 1–2
третий снаружи (n–2) f-подуровень
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s 2 p 6 , для гелия s 2 .
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R - обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда "Основы химии", который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.

В современном изложении периодический закон химических элементов звучит так: "Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)."
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
Периодическая система химических элементов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Классический вид таблицы Менделеева
История открытия Периодического закона.
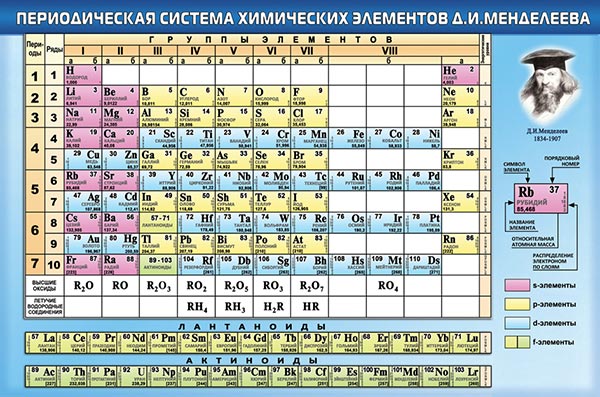
Периодическая таблица химических элементов Д. И. Менделеева в высоком разрешении для качественной печати. Таблицу можно распечатать на листе бумаги формата А4, а так же в большого размера для оформления кабинета Химии.
Чтобы скачать и распечатать картинку — выберите нужный вариант таблицы и нажмите на изображение.
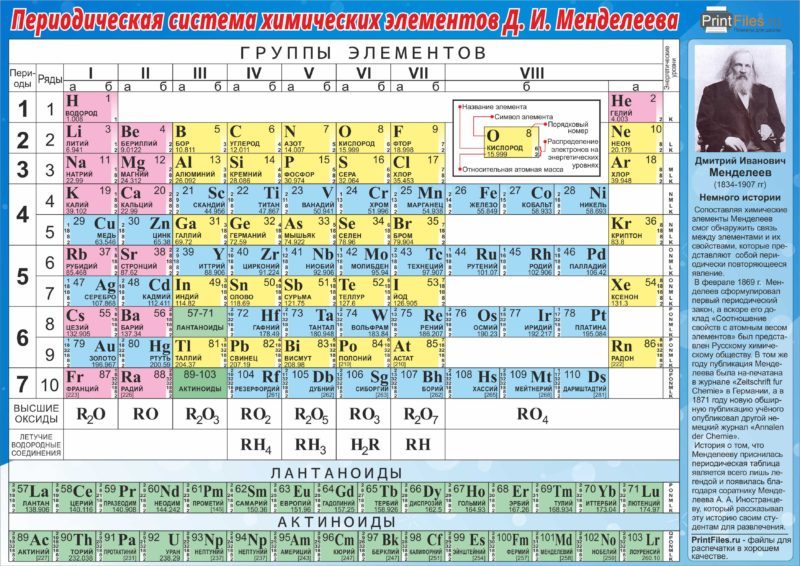
Второй вариант оформления таблицы Менделеева. Картинка в высоком разрешении для печати большого формата:

Посетителям сайта разрешается использовать материалы сайта в некоммерческих целях.
Размещение материалов этого сайта на других ресурсах в интернете без разрешения владельцев запрещено!
Читайте также:




