Опыты по химии в школе
Обновлено: 05.07.2024
Для проведения этого опыта в одной скляночке готовят ~100мл слабо-желтого (3-процентного) раствора хлорида железа(|||), а вдругой столько же 3-процентного раствора роданида калия (другое название - тиоцианид калия). В принципе можно брать любую соль, содержащую роданид, но калий роданид наиболее доступный. Также заранее готовят раствор фторида натрия (калия) и смачивают им небольшую тряпочку.
Для демонстрации этого опыта удобно использовать детский пластмассовый нож, но также можно взять тупой кухонный нож с возможно более широким лезвием. Ваткой, смоченной раствором хлорида железа(|||) протирают ладонь, а нож смачивают раствором роданида калия. При этом надо стремиться к тому, чтобы на ноже и на ладони осталось как можно больше соответствующих растворов. Если теперь провести ножом по ладони, то на пол обильно капают капли "крови". После окончания опыта ладонь протирают тряпочкой, смоченной раствором фторида натрия и тщательно моют руки.
В основе этого опыта лежит взаимодействие ионов Fe3+ с ионами SCN -, при этом образуется кроваво-красное комплексное соединение - роданид железа(|||):
FeCl3 + 3KSCN => 3KCl + Fe(SCN)3
Примечание: роданид калия - очень токсичное вещество, поэтому соблюдайте осторожность при работе с ним.
Примечание 2: если вы собираетесь показать этот опыт родителям, то предупредите их, пожалуйста, о том, что это всего лишь опыт, т. к . при правильном проведении он очень реалистичен.
Дым без огня
Берутся 2 конические колбы с горлышками одного диаметра, одну из них наполняют аммиаком, другую - хлороводородом. Не забудьте, какой газ тяжелее, а какой - легче воздуха! Затем колбы соединяют горлышками и переворачивают, после чего можно наблюдать белый дым образовавшегося хлорида аммония.
Мгновенная кристаллизация
Для проведения этого опыта готовят насыщенный при 80С раствор английской соли (MgSO4*7H2O) и осторожно, не встряхивая, медленно охлаждают его до комнатной температуры.
Затем вносят в раствор несколько крупинок английской соли и наблюдают мгновенное выпадение крупных кристаллов. Этот опыт можно демонстрировать в виде фокуса, предварительно положив затравочные кристаллы на край декоративного флакона с раствором, и затем незаметно смахнув их в раствор "волшебной палочкой" - обычным карандашом
"Заживление раны".
Кожу руки обильно смачивают "йодом" (слабый раствор хлорного железа), якобы для дезинфекции. После этого набирают в тонкую трубочку раствор роданида калия и проводят концом этой трубочки по смоченному месту (для усиления эффекта опыта можно использовать тупой нож). На руке появляется "кровоточащая рана", которую легко смывают затем обычной водой, а руку вытирают насухо полотенцем.
Примечание. Реакцию образования раствора роданида железа (III) можно использовать для получения хорошей имитации крови.
"Золотой дождь."
Существует множество веществ с сильной температурной зависимостью растворимости. Именно на этом явлении и основан данный опыт. Для проведения этого опыта необходимо взвесить равные количества ацетата свинца(||) и йодида калия. Я советую по 0,5г. Далее готовят два раствора. В два химических стакана наливают по 50 мл дистиллированной воды. В один добавляют ~1мл столового уксуса (или ~0,2 мл концентрированной уксусной кислоты) и растворяют ацетат свинца. Кислота добавляется для того, чтобы подавить гидролиз ионов Pb2+. Во втором растворяют KI. Затем оба раствора сливают в колбу из огнеупорного стекла объёмом 150мл. При этом происходит реакция двойного обмена между ацетатом свинца и йодидом калия:
Pb(CH3COO)2 + 2KI => 2KCH3COO + PbI2
После смешивания растворов выпадает жёлтый осадок йодида свинца(||). Смеси растворов в колбе необходимо дать отстояться, чтобы осадок осел полностью. После этого с осадка осторожно сливают жидкость и вместо неё доливают 100мл дистиллированной воды. Теперь раствор необходимо нагреть до кипения и кипятить втечении 2-3мин. Осадок должен раствориться полностью.
Если всё было сделано правильно, то после охлаждения раствора выпадет множество золотистых кристалликов, которые при встряхивании колбы будут парить в толще воды. Размер кристалликов очень сильно зависит от скорости охлаждения: чем медленнее охлаждать, тем более крупными и красивыми будут кристаллики. Для большей их прочности перед кипячением в раствор добавляют немного глицерина (~0,5мл на 100 мл раствора).
Фараоновы змеи.
Вы поджигаете небольшую палочку, вспыхивает слегка заметный огонёк и из палочки, извиваясь, начинает выползать чёрно-зелёная пористая масса, по форме напоминающая змею.
Это одна из разновидностей опыта, известного под названием "Фараоновы змеи". Далее будет описана наиболее безопасная разновидность этого опыта, т. к. существует несколько вариаций, но почти во всех используются высокотоксичные соединения ртути. Для того, чтобы провести этот опыт вам понадобятся три довольно доступных вещества: нитрат калия, дихромат калия и сахар. Вот состав смеси:
Все компоненты смеси тщательно растирают в ступке и смешивают. Далее небольшими порциями (буквально по несколько капель) добавляют воду. После каждой новой порции воды смесь тщательно перемешивают. Увлажнение необходимо прекратить тогда, когда смесь будет иметь консистенцию творога. Теперь у вас довольно легко получится скатать из неё палочки диаметром ~5-8мм и длиной около 5см.
Лучше всего проводить этот опыт на керамической плитке или на листе железа.
Примечание1: Этот опыт получится ещё интересней, если из смеси сформировать не палочки, а шарики диаметром ~1-2см. Но поджигать их необходимо с трёх сторон сразу, тогда получится не змея, а настоящий дракон.
Примечание2: Пористая масса, которая составляет "змею", - это большей частью токсичный оксид хрома(|||), так что прорводите этот опыт очень осторожно и обязательно вымойте руки после его проведения
Обугливание сахара
В химический стакан ёмкостью 150мл насыпьте 40гр растёртого в порошок сахара и слегка смочите его 3-4мл воды. Теперь в полученную массу добавьте 20-25мл концентрированной серной кислоты и размешайте смесь стеклянной палочкой. Палочку не вынимайте. Через несколько минут смесь потемнеет, температура повысится, и из стакана начнёт "выростать" чёрная пенообразная масса. Это пористый уголь, появление которого объясняется дегитратацией сахара серной кислотой:
C12H22O11 => 12C + 11H2O
Кроме этого происходит восстановление серной кислоты углём:
2H2SO4 + C => CO2 + 2SO2 + 2H2O
Получение "золота".
Готовят равные объемы 3%-ного раствора иодида калия и 4%-ного раствора ацетата свинца. Перед опытом растворы доводят до кипения и горячими сливают вместе в колбу. При остывании в осадок выпадает иодид свинца, который хорошо растворим в горячей воде, но весьма мало в холодной (менее 0.1%). Осадок образуется в виде тонких блестящих на свету чешуек золотистого цвета. Размеры их зависят от скорости охлаждения, чем медленнее охлаждается раствор, тем крупнее кристаллы.
Несгораемый платок.
Небольшой платочек погружают в раствор силиката натрия (смешивают силикатный клей с водой в отношении 1:10), хорошо смачивают и отжимают. Затем платочек берут за уголок пинцетом, погружают в стакан с ацетоном (можно брать этиловый спирт, денатурат, бензин и другие легко воспламеняющиеся жидкости), вынимают и тут же поджигают над пламенем спиртовки или с помощью лучинки. Ацетон быстро сгорает, а платочек остается невредимым ( дело в том, что ацетон имеет настолько малую теплоту сгорания, что тепла едва хватает на то, чтобы просушить платок, поэтому платочек можно просто слегка смочить водой). После опыта платочек начисто отстирывают в теплой воде и его снова можно использовать по назначению
Окрашивание пламени
Для выполнения опыта необходимо приготовить несколько кусочков фильтровальной бумаги. Бумагу помещают в насыщенный раствор хлората калия, вымачивают некоторое время, затем достают и сушат. При поджигании приготовленных таким образом высушенных листков наблюдается пламя белого цвета. Для получения окрашенного пламени необходимо к раствору хлората калия добавить нитрат стронция(красное пламя), бария(зеленое пламя) или меди(голубое пламя).
Аммиачный фонтан
Для опыта необходимы две колбы, соединенные следующим образом: на одну из них, широкогорлую, одевается пробка с отверстием для стеклянной трубки и пипетки; другая колба, более узкая соединяется со стеклянной трубкой с помощью подходящей пробки. В узкую колбу наливают воду так, чтобы уровень жидкости доходил до стеклянной трубки. В пипетку набирают несколько капель раствора фенолфталеина, а широкую колбу наполняют аммиаком. После этого прибор собирают, как указано выше, надежно закрепляя колбу с водой внизу. С помощью пипетки несколько капель жидкости добавляют в широкогорлую колбу и наблюдают красивый фонтан жидкости, окрашивающейся в розовый цвет при выходе из трубки.
Кристаллический дождик.
Оборудывание: пробирка, спиртовка, 10% расстворы иодида калия (KI) и нитрата свинца II (Pb(NO3)2).
В пробику налейте 5мл KI (иодида калия) и прилейте 4мл Pb(NO3)2, при их смешивании выпадает желтый осадок иодида свинца (PbI2). Хорошо прогрейте пробирку на спиртовке, затем резко охладите под краном или влажной тряпкой. На солнце или при свете настольной лампы можно наблюдать кристаллический дождик в пробирке
Взрыв с серной кислотой и марганцовкой.
Всем известно, что "марганцонвка" довольно сильный окислитель. Но ангидрид марганцевой кислоты - Mn2O7, куда сильнее. Это соединение вызывает воспламенение, а порой и взрыв, при соприкосновении с различными органическими и другими веществами, ведь температура при которой высший оксид марганца разлагается на свободный кислород и низшие оксида марганца чуть выше 50 гадусов.
Оборудывание: марганцовокислый калий (марганцовка KMnO4), концентрированная серная кислота (H2SO4), вата. Насыпьте маленькую горочку марганцовки. Полейте ее серной кислотой. Если кинуть ватку на горку то происходит хлопок и смесь воспламеняется. Опыт следует ставить только на открытом воздухе, т. к. при хлопке происходит большой разброс пачкающего продукта. Произошла реакция: 2Mn2O7+C6H10O5=6CO2+5H2O+4MnO2
Выделение и возгорание фосфина.
Фосфин (PH3) ядовитый газ, светится в темноте легко воспламеняется.
Оборудование: красный фосфор (можно обводнившийся), пробирка, металлический натрий, спиртовка.
На дно пробирки киньте 0,5 гр влажного красного фосфора (очень хорошо если фосфор обводнившийся). Туда же опустите маленький кубик (0,4 см3) металлического натрия. Начните греть пробирку на спиртовке и вскоре из пробирки вырвется пламя. Это возгорелся фосфин образовавшийся при гидролизе фосфида натрия.
Люминофоры на основе борной кислоты.
Когда мы посмотрим на светящуюся в темноте игрушку или часы, мы смело можем сказать - фосфор. Хотя это далеко не фосфор, и содержания фосфора там совсем нет. Это – люминофоры, вещества, возбуждающиеся при свете. Для приготовления таких люминофоров, чтобы светились несколько часов, понадобится много компонентов. В домашней лаборатории можно приготовить люминофоры, которые будут светиться всего несколько секунд, но и это, тоже неплохо.
Оборудывание: керамическая чашечка для выпаривания или алюминиевый стаканчик от электролитического конденсатора, борная кислота (H2BO3), какой-нибудь компонент (см.ниже), газовая плита или штатив с кольцом и спиртовая горелка, фотовспышка.
В чашечку для выпаривания, или на худой конец, в маленькую консервную банку положите 2 гр порошковой борной кислоты (продается в аптеке) и такое-же количество компонента; прилейте чуть-чуть воды, чтоб при размешивании получилась густая кашица. Затем начинайте греть. Сначала смесь начнет кипеть, потом получится густая стекловидная масса. После ее образования, снимите сосуд с огня и поставьте остывать. Как только смесь остынет, при облучении получившегося продукта фотовспышкой, можно наблюдать свечение (в абсолютной темноте).
Взятие пробы на алкоголь
Юному химику потребуется газовая промывалка, если ее нет, нужно собрать ее аналог, используя подходящие колбу и стеклянные трубки. Выходящую из промывалки трубку с помощью пробки соединяют с трубкой большего диаметра, в котоую помещается кристаллический хромат калия. Промывалку наполняют 0.1% раствором этанола в воде и начинают продувать воздух ( можно - ртом, можно - с помощью целлофанового пакета из соображений безопасности). В трубке с хроматом калия наблюдается возникновение зеленой окраски (Cr III), хорошо заметной на желтом фоне. Нетрудно заметить, что глубина и степень распространения окраски пропорциональны концентрации алкоголя. Таким образом, потренировавшись, можно заняться тестированием родных и знакомых.
Примечание: ставить подобные опыты на себе не рекомендуется
Получение фенолформальдегидной смолы
В пробирку помещают 10 капель жидкого фенола и 8 капель 40% формальдегида. Смесь нагревают на водяной бане до растворения фенола. Через 3 минуты в пробирку добавляют 5 капель концентрированной соляной кислоты и помещают ее в стакан с холодной водой. После образования в сосуде двух четких фаз следует слить воду и вылить полимер из пробирки. В течение нескольких минут образовавшаяся новолачная смола затвердевает.
Пламя-художник
На белом листе плотной бумаги делается надпись или рисунок 10-20% раствором серной кислоты. После высушивания надпись или рисунок на бумаге незаметны. Если теперь лист подержать над пламенем (oсторожно !) горелки, то через некоторое время на бумаге появляется надпись или рисунок черного цвета. Вместо пламени спиртовки можно использовать настольную электрическую лампу или утюг, нагрев которыми осуществляется более равномерно и исключает воспламенение бумаги.
"Вода" зажигает костер
На асбестовую сетку ставится небольшая фарфоровая чашечка (можно часовое стекло) с небольшим количеством смеси перманганата калия с серной кислотой. На фарфоровую чашечку и вокруг нее накладывают сухие лучинки, имитирующие костер. Для зажигания полученного костра смачивают кусок ваты "водой" (этиловым спиртом) и выжимают над ним так, чтобы капли попали в чашечку. Спирт (можно брать денатурат) воспламеняется, поджигая затем лучинки
В химический стакан наливают 30-50 мл воды, добавляют несколько капель раствора иода в иодиде калия и 1-2 мл разбавленной соляной кислоты HCl. Прибавляют около 0,5 мл раствора крахмала. Жидкость моментально окрасится в синий цвет (образуется комплексное соединение крахмала с иодом). Если стакан нагреть, жидкость обесцвечивается, а при охлаждении снова окрасится (комплексное соединение крахмала с иодом восстанавливается).
Из тонкой цинковой пластинки вырезают фигуру человека, хорошо ее очищают и опускают в стакан с раствором хлорида олова SnCl 2 . Начинается реакция, в результате которой цинк вытесняет из раствора олово: Zn+SnCl 2 =ZnCl 2 +Sn.
Цинковая фигурка начинает покрываться блестящими иглами.
В семь больших пробирок, помещенных в демонстрационный штатив с белым фоном, сливаем попарно растворы:
1- хлорид железа (III) и роданид калия (красный цвет);
2- раствор хромата калия подкисляем H2SO4 (оранжевый цвет);
3- нитрат свинца и иодид калия (желтый цвет);
4- сульфат никеля (II) и гидроксид натрия (зеленый цвет);
5- сульфат меди (II) и гидроксид натрия (голубой цвет);
6- сульфат меди (II) и раствор аммиака (синий цвет);
7- хлорид кобальта (II) и роданида калия (фиолетовый цвет).
1. FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl
2. 2K 2 CrO 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
3. Pb(NO 3 ) 2 + 2KJ = PbJ 2 + 2KNO 3
4. NiSO 4 + 2NaOH = Ni(OH) 2 + Na 2 SO 4
5. CuSO 4 + 2NaOH = Cu(OH) 2 + 2Na 2 SO 4
6. CuSO 4 + 4NH 3 = [Cu(NH 3 ) 4 ]SO 4
7. CoCl 2 + 2KCNS= Co(CNS) 2 + 2KCl
Примечание.
Опыт очень простой, но эффективный, благодаря яркости веществ, получаемых в ходе реакции. Учащиеся могут вспомнить как составляются уравнения химических реакций. Для опыта можно привлечь учащихся.
Фейерверк в жидкости.
В мерный цилиндр наливаем 50 мл этилового спирта. Через пипетку, которая опущена до дна цилиндра, вводим 40 мл концентрированной серной кислоты. Таким образом, в цилиндре образуется два слоя жидкости с хорошо заметной границей : верхний слой - спирт, нижний – серная кислота В цилиндр бросаем немного мелких кристалликов перманганата калия. Дойдя до границы раздела, кристаллики начинают вспыхивать – вот нам и фейерверк. Появление вспышек связано с тем, что при соприкосновении с серной кислотой на поверхности кристалликов соли образуется марганцевый ангидрид Mn 2 O 7 – сильнейший окислитель, который поджигает небольшое количество спирта:
2KMnO 4 + H 2S O 4 = Mn 2 O 7 + K 2 SO 4 + H 2 O.
Mn 2 O 7 – зеленовато-бурая жидкость, неустойчива и при соприкосновении с горючими веществами поджигает их.
10 г двухромовокислого калия смешиваем с 40 мл концентрированной соляной кислоты и добавляем 15-20 мл воды. Смесь немного нагреваем, и кристаллы соли перейдут в раствор. После растворения двухромовокислого калия раствор охлаждаем водой. Выпадают очень красивые красные кристаллы в виде призм, представляющие собой калиевую соль хлорхромовокислой кислоты KCrO3Cl, согласно уравнению реакции:
K2Cr2O7+ 2HCl = 2KCrO3Cl + H2O.
Буран в стакане.
В химический стакан ёмкостью 150мл насыпьте 40гр растёртого в порошок сахара и слегка смочите его 3-4мл воды. Теперь в полученную массу добавьте 20-25мл концентрированной серной кислоты и размешайте смесь стеклянной палочкой. Палочку не вынимайте. Через несколько минут смесь потемнеет, температура повысится, и из стакана начнёт "выростать" чёрная пенообразная масса. Это пористый уголь, появление которого объясняется дегитратацией сахара серной кислотой:
C 12 H 22 O 11 = 12 C + 11H 2 O
Кроме этого происходит восстановление серной кислоты углём: 2H 2 SO 4 + C = CO 2 + 2SO 2 + 2H 2 O
На белом листе плотной бумаги делается надпись или рисунок 10-20% раствором серной кислоты. После высушивания надпись или рисунок на бумаге незаметны. Если теперь лист подержать над пламенем (oсторожно !) горелки, то через некоторое время на бумаге появляется надпись или рисунок черного цвета. Вместо пламени спиртовки можно использовать настольную электрическую лампу или утюг, нагрев которыми осуществляется более равномерно и исключает воспламенение бумаги.
"Вода" зажигает костер
На асбестовую сетку ставится небольшая фарфоровая чашечка (можно часовое стекло) с небольшим количеством смеси перманганата калия с серной кислотой. На фарфоровую чашечку и вокруг нее накладывают сухие лучинки, имитирующие костер. Для зажигания полученного костра смачивают кусок ваты "водой" (этиловым спиртом) и выжимают над ним так, чтобы капли попали в чашечку. Спирт (можно брать денатурат) воспламеняется, поджигая затем лучинки
В бутылочку из-под вина (лучше шампанского) кладут несколько кусочков мрамора или мела, приливают разведенной соляной кислоты и закрывают пробкой (не слишком туго). В целях предосторожности бутылочку заворачивают в полотенце. Через несколько минут происходит выстрел, и пробка взлетает почти до потолка. В результате взаимодействия соляной кислоты с мрамором или мелом образуется углекислый газ, который и выталкивает пробку: СаСО 3 +2НСl=CaCl 2 +CO 2 +H 2 O.
NaHCO 3 +CH 3 COOH=CH 3 COONa+CO 2 +H 2 O.
Большую толстостенную склянку емкостью в 1 л (тонкостенная может быть раздавлена) заполняют хлороводородом и плотно закрывают пробкой со стеклянной трубкой, один конец которой (внутри склянки) несколько оттянут. На другой конец надевают резиновую трубку с зажимом. Для проведения опыта переворачивают склянку вверх дном, опускают конец трубки до половины в бутыль с водой, подкрашенной синим лакмусом, и убирают зажим. В склянке образуется разреженной пространство, вода с силой врывается в сосуд и бьет из трубки фонтаном. Раствор из синего становится красным.
1. Если смешать в колбе при комнатной температуре два бесцветных газа – аммиак и хлороводород, - то сейчас же появится густой белый дым. Он представляет собой мельчайшие кристаллики хлорида аммония:
NH 3 +HCl=NH 4 Cl.
Дым вскоре осядет на стенке сосуда в виде белого налета.
2. Хлорид кремния (IV) SiCl 4 – это жидкость, отличающаяся большой летучестью. Достаточно открыть колбу, в которой он находится, чтобы появился белый дым. Испаряясь, хлорид кремния (IV) реагирует с влагой воздуха:
SiCl 4 +4H 2 O=H 4 SiO 4 +4HCl.
В результате этой реакции образуется дым, состоящий из твердых частичек кремниевой кислоты H 4 SiO 4 . Благодаря этому свойству хлорид кремния (IV) применяют в военном деле в качестве дымообразователя.
Приготавливают в стакане на 300 мл насыщенный раствор нитрата свинца Pb(NO 3 ) 2 и опускают в него кристалл хлорида аммония NH 4 Cl. Постепенно в стакане начинают расти кристаллы, напоминающие собой растения, покрытые инеем: Pb(NO 3 ) 2 +2NH 4 Cl=2NH 4 NO 3 +PbCl 2 .
В литровую стеклянную банку до половины наливают воды и кладут клубень картофеля. Он остается на дне. Добавляют насыщенный раствор хлорида натрия NaCl, и клубень всплывает. Если долить чистой воды, то он снова опустится на дно. Обычно картофель в воде тонет, но при добавлении насыщенного раствора хлорида натрия, плотность которого выше плотности картофеля, клубень всплывает. При доливании чистой воды раствор разбавляют, плотность его снова изменяется и клубень опускается на дно
В фарфоровой чашке зажигают спирт. Он горит почти бесцветным пламенем. Когда горение окончится, в эту же чашу наливают 5 мл спирта и 0,5 мл насыщенного раствора борной кислоты H 3 BO 3 и поджигают. Спирт горит красивым зеленым пламенем. Это объясняется тем, что борная кислота образует со спиртом сложный эфир, окрашивающий пламя в зеленый цвет:
3С 2 H 5 OH + H 3 BO 3 = 3H 2 O + (C 2 H 5 O) 3 B.
Для опыта готовят слабый раствор соляной кислоты HCl, в который опускают яйцо. По плотности оно тяжелее раствора соляной кислоты, поэтому и опускается на дно. В растворе начинается реакция между веществом скорлупы, углекислым кальцием CaCO 3 и соляной кислотой, в результате чего образуется углекислый газ, пузырьки которого пристают к скорлупе и подымают яйцо вверх. На поверхности пузырьки срываются и уходят в воздух, а яйцо снова погружается на дно, а потом опять поднимается. Так яйцо ныряет, пока не растворится скорлупа.
Приготавливают насыщенный раствор калийной селитры KNO 3 , опускают в него на 5-7 минут лист газетной бумаги. По истечении указанного времени его вынимают из раствора и сушат. Затем вносят в пламя горелки, он не горит, а тлеет.
В пробирку помещают обезжиренный кусочек меди и приливают немного раствора нитрата серебра AgNO 3 (1:10). Через несколько часов на поверхности меди появляется лес иглообразных ярко блестящих кристаллов серебра: Cu+2AgNO 3 =Cu(NO 3 ) 2 +2Ag.
Рисунок на стекле
Замечательным свойством плавиковой кислоты является ее способность взаимодействовать с оксидом кремния SiO 2 , входящей в состав стекол, с образованием газообразного фторида кремния SiF 4 и воды:
SiO 2 +4HF=SiF 4 +2H 2 O.
На этом свойстве плавиковой кислоты основано применение ее для вытравливания на стекле надписей, рисунков, а также для придания матовой поверхности стеклянным предметам. Для получения рисунка на стекле последнее покрывают слоем воска или парафина, на которые HF не действует, затем счищают воск в тех местах, где должен получиться рисунок, и подвергают обнаженные места в течение некоторого времени действию плавиковой кислоты (под тягой!).
Небольшой платочек погружают в раствор силиката натрия (смешивают силикатный клей с водой в отношении 1:10), хорошо смачивают и отжимают. Затем платочек берут за уголок пинцетом, погружают в стакан с ацетоном (можно брать этиловый спирт, денатурат, бензин и другие легко воспламеняющиеся жидкости), вынимают и тут же поджигают над пламенем спиртовки или с помощью лучинки. Ацетон быстро сгорает, а платочек остается невредимым ( дело в том, что ацетон имеет настолько малую теплоту сгорания, что тепла едва хватает на то, чтобы просушить платок, поэтому платочек можно просто слегка смочить водой). После опыта платочек начисто отстирывают в теплой воде и его снова можно использовать по назначению
Вы поджигаете небольшую палочку, вспыхивает слегка заметный огонёк и из палочки, извиваясь, начинает выползать чёрно-зелёная пористая масса, по форме напоминающая змею.
Это одна из разновидностей опыта, известного под названием "Фараоновы змеи". Далее будет описана наиболее безопасная разновидность этого опыта, т. к. существует несколько вариаций, но почти во всех используются высокотоксичные соединения ртути. Для того, чтобы провести этот опыт вам понадобятся три довольно доступных вещества: нитрат калия, дихромат калия и сахар. Вот состав смеси:
KNO 3 --------------5гр
K 2 Cr 2 O 7 ----------10гр
C 12 H 22 O 11 -------10гр
Все компоненты смеси тщательно растирают в ступке и смешивают. Далее небольшими порциями (буквально по несколько капель) добавляют воду. После каждой новой порции воды смесь тщательно перемешивают. Увлажнение необходимо прекратить тогда, когда смесь будет иметь консистенцию творога. Теперь у вас довольно легко получится скатать из неё палочки диаметром ~5-8мм и длиной около 5см.
Лучше всего проводить этот опыт на керамической плитке или на листе железа.
Любому начинающему химику известна выдающаяся роль воды в химии. Вода - самый простой, доступный и универсальный растворитель. Однако мало кто знает о том, что вода может выступать и в качестве катализатора твердофазной реакции. Это реакция алюминия с иодом.
Для проведения опыта в фарфоровый тигель насыпают по щепотке тонко измельченных порошков алюминия и иода. Вся посуда и инструменты должны быть сухими! Смесь осторожно перемешивают подходящими шпателем или стеклянной палочкой. Затем с добавляют в реакционную смесь каплю воды с помощью пипетки. Наблюдается бурная реакция, сопровождаемая выделением паров ибытка иода.
Примечание: порошок алюминия должен быть очень тонким, почти пылью, в противном случае реакционная смесь может "плюнуть" прямо Вам в лицо раскаленной алюминиевой крошкой. В любом случае, опыт лучше проводить в очках.
Вспышка оксида меди и алюминия.
Оборудование: порошковый оксид меди II (CuO), алюминиевая пудра (продается в строительных магазинах как "серебрянка"), металлический лист, спиртовка, спички.
На металлический лист насыпьте смесь состоящей из равного по объему количества алюминиевой пудры и оксида меди II. Если у вас нет оксида меди, то его можно получить при сливании горячих растворов медного купороса (сульфата меди II) и гидроксида натрия (едкого натра), далее осадок фильтруется и сушится.
Начните греть лист на газу или на спиртовке. Через некоторое время вставьте в горочку спичку, так что-бы головка слегка торчала. Затем поднесите горящую лучинку к спичке, так что-бы она могла возгореться. При возгорании спички произойдет слабый хлопок с яркой вспышкой.
Произошла реакция: 3CuO+2Al=Al 2 O 3 +3Cu
Начинается бурная реакция с выделением искр, буроватого дыма и сильным разогревом – почти полная картина вулканической деятельности!
Большинство реакций, применяемых в школьной и лабораторной практике, протекают в растворах. В этой связи интересным будет рассмотрение одной из самых красивых твердофазных реакций. В фарфоровую ступку насыпают по щепотке твердых солей - нитрата кобальта и роданида аммония (NH 4 NCS). При растирании смеси пестиком появляется красивая фиолетовая окраска, обусловленная образованием тиоцианата кобальта.
Данную реакцию можно проводить и в растворе и использовать для открытия ионов Co(II).
Кожу руки обильно смачивают "йодом" (слабый раствор хлорного железа), якобы для дезинфекции. После этого набирают в тонкую трубочку раствор роданида калия и проводят концом этой трубочки по смоченному месту (для усиления эффекта опыта можно использовать тупой нож). На руке появляется "кровоточащая рана", которую легко смывают затем обычной водой, а руку вытирают насухо полотенцем.
Примечание. Реакцию образования раствора роданида железа (III) можно использовать для получения хорошей имитации крови.
Опыт прост как ящик и может быть поставлен даже на кухне. Хорошо подходит для иллюстрации некоторых свойств углекислого газа, на которых основано его применение в огнетушителях. Внутри высокого цилиндра или стакана укрeпляют свечу так, чтобы пламя ее было на 3-4см ниже края сосуда. На дно стакана насыпают равномерно столовую ложку соды. Свечу зажигают, и убеждаются, что она горит. Затем на дно стакана выливают столовую ложку уксуса (или любой другой кислоты). Свеча гаснет. Опыт окончен.
Человек наблюдательный может извлечь отсюда следующие факты: а)углекислый газ образуется по реакции соды с кислотой; б)он тяжелее воздуха; в) он не поддерживает горения. Для сомневающихся опыт можно усложнить, поместив еще одну свечу в сосуд, ее фитиль должен быть выше стенок. Эта свеча не погаснет никогда.
Существует множество веществ с сильной температурной зависимостью растворимости. Именно на этом явлении и основан данный опыт. Для проведения этого опыта необходимо взвесить равные количества ацетата свинца(||) и йодида калия. Я советую по 0,5г. Далее готовят два раствора. В два химических стакана наливают по 50 мл дистиллированной воды. В один добавляют ~1мл столового уксуса (или ~0,2 мл концентрированной уксусной кислоты) и растворяют ацетат свинца. Кислота добавляется для того, чтобы подавить гидролиз ионов Pb2+. Во втором растворяют KI. Затем оба раствора сливают в колбу из огнеупорного стекла объёмом 150мл. При этом происходит реакция двойного обмена между ацетатом свинца и йодидом калия:
Pb(CH 3 COO) 2 + 2KI = 2KCH 3 COO + PbI 2
После смешивания растворов выпадает жёлтый осадок йодида свинца(||). Смеси растворов в колбе необходимо дать отстояться, чтобы осадок осел полностью. После этого с осадка осторожно сливают жидкость и вместо неё доливают 100мл дистиллированной воды. Теперь раствор необходимо нагреть до кипения и кипятить втечении 2-3мин. Осадок должен раствориться полностью.
Если всё было сделано правильно, то после охлаждения раствора выпадет множество золотистых кристалликов, которые при встряхивании колбы будут парить в толще воды. Размер кристалликов очень сильно зависит от скорости охлаждения: чем медленнее охлаждать, тем более крупными и красивыми будут кристаллики. Для большей их прочности перед кипячением в раствор добавляют немного глицерина (~0,5мл на 100 мл раствора).
Для проведения этого опыта готовят насыщенный при 80С раствор английской соли (MgSO 4 *7H 2 O) и осторожно, не встряхивая, медленно охлаждают его до комнатной температуры.
Затем вносят в раствор несколько крупинок английской соли и наблюдают мгновенное выпадение крупных кристаллов. Этот опыт можно демонстрировать в виде фокуса, предварительно положив затравочные кристаллы на край декоративного флакона с раствором, и затем незаметно смахнув их в раствор "волшебной палочкой" - обычным карандашом .
Выделение и возгорание фосфина.
Фосфин (PH3) ядовитый газ, светится в темноте легко воспламеняется.
Оборудование: красный фосфор (можно обводнившийся), пробирка, металлический натрий, спиртовка.
На дно пробирки киньте 0,5 гр влажного красного фосфора (очень хорошо если фосфор обводнившийся). Туда же опустите маленький кубик (0,4 см3) металлического натрия. Начните греть пробирку на спиртовке и вскоре из пробирки вырвется пламя. Это возгорелся фосфин образовавшийся при гидролизе фосфида натрия.
Вспышка с фиолетовым дымом.
Некоторые вещества очень красиво реагируют между собой, но их нужно заставить прореагировать. Иногда это можно сделать при помощи катализатора (ускорителя реакции). Таким катализатором вполне может быть вода.
В ступке разотрите до порошка 2 гр. кристаллического йода. На металлическом или керамическом листе в горочку смешайте его с 3г алюминиевой, магниевой или цинковой пудры. Далее при помощи пипетки капните туда 1-2 капли воды. Пройзойдет сильное шипение с выделение красивого фиолетового дыма йода. Произошла реакция:3I 2 +AL=2ALI 3 Опыт следует проводить на открытом воздухе или под вытяжкой, так-как через некоторое время йод осядет и образует пятна.
Вода зажигает бумагу.
В фарфоровой чашке смешивают пероксид натрия с мелкими
кусочками ильтровальной бумаги.На приготовленную смесь капают несколько капель воды.Бумага воспламеняется.
Na 2 O 2 +2H 2 O=H 2 O 2 +2NaOH
2H 2 O 2 =2H 2 O+O 2
Волшебная палочка.
Для опыта в фарфоровую чашку помещают заранее приготовленную кашицу из перманганата калия и концентрированной серной кислоты. Стеклянную палочку погружают в свежеприготовленную окислительную смесь.Быстро подносят палочку к влажному фитилю спиртовки,фитиль воспламеняется.
Химические водоросли.
В стакан наливают раствор силиката натрия и на дно бросают кристаллы хлоридов кальция, марганца(II),кобальта(II),никеля(II) и других металлов.Через некоторое время в стакане начинают расти кристаллы соответствующих труднорастворимых силикатов, напоминающие водоросли.
Самая интересная часть школьной химии — лабораторные — начинается в 9-10 классах. К сожалению, к этому времени многие ученики уже успевают разочароваться в предмете, запускают его и, как следствие, не могут разобраться в элементарных понятиях.
Предупреждение: в некоторых опытах в результате химических реакций происходит процесс горения веществ. Будьте очень аккуратны! Соблюдайте технику безопасности!
Не допускайте ребенка до экспериментов одного и на всякий случай приготовьте огнетушитель.
Светящийся помидор
Теперь комнату на Хэллоуин можно будет украшать не только тыквами, но и другими овощами. А главное, что в темноте они будут светиться разными цветами.
Нам понадобится
• помидор (или другой овощ)
• шприц 3 мл с иголкой (30 рублей)
• 30% перекись водорода или раствор гидроперита (блистеры гидроперита продаются в аптеке, один блистер — около 50 рублей). Из 10 растолчённых таблеток, залитых 50 мл кипятка, получится нужный раствор.
Пропорции: белизна : сера : перекись — 2:1:1
Как проводить опыт
Ждем, пока раствор расслоится.
Набираем жидкость в шприц и обкалываем выбранный овощ.
После вводим в центр овоща перекись.
Выключаем свет и вуаля: обычный овощ стал фонариком
Предупреждение: обработанный овощ лучше не есть после эксперимента.
Чему учит опыт
Это хороший пример окислительно-восстановительной реакции — одного из главных механизмов взаимодействия веществ в химии.
Превращение воды в кровь
Продолжаем тему страшилок, которую дети очень любят. Предлагаем вам оригинальный способ сделать кровь для грима.
Этот опыт достаточно зрелищный, поэтому его можно проводить как шоу. Но сначала надо потренироваться в одиночестве.
Нам понадобится
• индикатор лакмус (купить можно в магазине для химиков или садоводов, например, здесь, 12 мл за 400 рублей): несколько капель
• кислота (уксусная или лимонная): 1 ст. л.
• загуститель: немного крахмала или муки: 1 ст. л.
Как проводить опыт
В кислой среде фенолфталеин становится красным, поэтому, если в раствор кислоты капнуть немного индикатора, то он резко изменит цвет.
Насыщенность цвета можно регулировать количеством индикатора. Но кровь — это не просто красная вода. Она еще и густая.
Поэтому предварительно смесь лучше загустить мукой.
Есть и другой вариант — дороже, но интересней.
Нам потребуются
• Хлорид железа (234 рубля/кг) — можно купить на сайте химических реактивов
• Роданид калия (326 рублей/кг)
Пропорции: хлорид : роданид — 1 : 3
Как проводить опыт
Протираем то место, где должна быть кровь, хлоридом железа, а сверху наносим роданид. Вещества реагируют и получается роданид железа.
Отличный способ объяснить ребенку, что одна из причин красного цвета крови — наличие в ее составе железа.
Чему учит опыт
Пример второго важного механизма взаимодействия — обмен. Элементы просто поменяются местами, а их форма не изменится (как было в предыдущем опыте). В итоге получим хлорид калия и роданид железа. Фишка в том, что у солей железа много разных цветов, поэтому желтые вещества станут красными.
Пенный джин
Этот эксперимент может не только порадовать ребенка, но и стать частью фокусов на детском празднике. Ведь джину так интересно загадывать желания!
Нам понадобится
• раствор перекиси водорода (несколько пузырьков из аптеки)
• пена для ванны или мыло: примерно полбутылочки
• йодистый калий (купить в аптеке, 100 таблеток по 200 мкг — стоимость 127 рублей)
Пропорции: йодистый калий : перекись — 2 : 3
Как проводить опыт
В мыльный раствор мы присыпаем йодистый калий.
Потом добавляем перекись.
Спустя уже несколько секунд начнется реакция, и пена полезет из емкости с утроенной силой.
Чему учит опыт
Тут снова происходит окислительно-восстановительная реакция.
Дело в том, что в результате реакции может измениться агрегатное состояние компонентов.
То есть в начале было твердое и жидкое, а в конце — жидкое и газ. Так и здесь: мы получим растворенную в воде и мыле щелочь, улетевшие кислород и йод. Йод даст фиолетовую окраску, а газ кислород даст пену.
Цветное пламя
Мало кто помнит, но цвет пламени зависит от того, что горит. Ведь само пламя — это продукты горения, то есть те газы, на которые разложилось исходное вещество. Что происходит, если горит дерево или природный газ, все знают. Но что будет, если загорится соль металла?
Как получить цветной огонь
1) Для желтого огня нам потребуются соли натрия. Например, поваренная соль (хлорид натрия) или пищевая сода (гидрокарбонат натрия)
2) Зеленое пламя дают соединения меди. Для этого можно взять медную проволоку (купить можно, например в Хоббимаркете: 290 рублей / 10 м)
3) Синим пламенем горит спирт. Раствор спирта тоже подойдет.
4) Красное пламя дают соли кальция, которые содержатся в накипи.
Как проводить опыт
Любое из указанных веществ кладем на ложечку и аккуратно вносим в пламя спички или свечки. Не волнуйтесь, пламя не потухнет, а только поменяет цвет.
Чему учит опыт
Что такое горение? Горение — это то же окисление. Кислород из воздуха окисляет металлы, и получаются их оксиды.
Как мы уже поняли, у разных соединений металлов — разные цвета. Поэтому мы и видим разноцветное пламя.
Фараонова змея
Это очень известный эффектный химический опыт. Он также связан с последствиями горения. Но на этот раз гореть будут органические соединения.
Нам понадобятся
• просеянный песок (горстка)
• 95% спирт или крепкий алкоголь (водка, абсент)
Пропорции: сахар : сода — 1 : 1 — столько, чтобы заполнилась ямка в песке.
Как проводить опыт
Из песка делаем горку и пропитываем ее спиртом.
На вершине горки делаем углубление, куда засыпаем смесь сахара и соды.
Поджигаем спирт и наслаждаемся эффектом.
Чему учит опыт
Этот опыт похож на предыдущие: снова окислительно-восстановительная реакция с выделением газа. Песок и сахар сгорели в сажу, которую надул углекислый газ.
Ледяные пузыри
От горячего логично перейти к холодному. Мы предлагаем вам показать ребенку процесс роста кристаллов. Обычно кристаллы из набора юного химика нужно растить несколько дней. Но есть и более быстрый способ.
Итак, надуваем мыльный пузырь и сажаем его на лед или снег. И наблюдаем процесс образования снежинок!
В итоге мыльный пузырь заледенеет и треснет.
Вулканчик
Все хорошо знают опыт с вулканчиком, который поджигают. Но мало кто знает, что вода может вызвать возгорание. В этом опыте мы это и покажем.
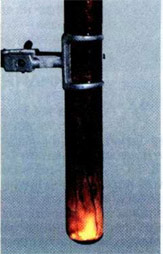
Горение алюминия в броме
Если в пробирку из термостойкого стекла поместить несколько миллилитров брома и аккуратно опустить в него кусочек алюминиевой фольги, то через некоторое время (необходимое для того, чтобы бром проник через оксидную плёнку) начнётся бурная реакция. От выделяющегося тепла алюминий плавится и в виде маленького огненного шарика катается по поверхности брома (плотность жидкого алюминия меньше плотности брома), быстро уменьшаясь в размерах. Пробирка наполняется парами брома и белым дымом, состоящим из мельчайших кристаллов бромида алюминия:
Также интересно наблюдать реакцию алюминия с иодом. Смешаем в фарфоровой чашечке небольшое количество порошкообразного иода с алюминиевой пудрой. Пока реакции не заметно: в отсутствие воды она протекает крайне медленно. Пользуясь длинной пипеткой, капнем на смесь несколько капель воды, играющей роль инициатора, и реакция пойдёт энергично - с образованием пламени и выделением фиолетовых паров иода.
Химические опыты с порохом: как взрывается порох!

Пороха
Дымный, или чёрный, порох представляет собой смесь калийной селитры (нитрата калия - KNO3), серы (S) и угля (C). Он воспламеняется при температуре около 300 °С. Порох может взрываться и от удара. В его состав входят окислитель (селитра) и восстановитель (уголь). Сера также является восстановителем, но главная её функция — связывать калий в прочное соединение. При горении пороха протекает реакция:
2KNO3+ЗС+S→ K2S+N2+3СО2,
- в результате которой выделяется большой объём газообразных веществ. С этим и связано использование пороха в военном деле: образующиеся при взрыве и расширяющиеся от тепла реакции газы выталкивают пулю из оружейного ствола. В образовании сульфида калия легко убедиться, понюхав ствол ружья. Он пахнет сероводородом — продуктом гидролиза сульфида калия.
Химические опыты с селитрой: огненная надпись
Эффектный химический опыт можно провести, имея калийную селитру. Напомню, что селитры - это сложные вещества - соли азотной кислоты. В данном случае нам понадобится калиевая селитра. Её химическая формула KNO3. На листе бумаги нарисуйте контур, рисунок (для большего эффекта пусть линии не пересекаются!). Приготовьте концентрированный раствор нитрата калия. Для сведений: в 15 мл горячей воды растворяется 20 г KNO3. Затем с помощью кисти пропитываем бумагу по нарисованному контуру, при этом не оставляем пропусков и промежутков. дадим бумаге высохнуть. Теперь надо коснуться горящей лучинкой какой-нибудь точки на контуре. Тотчас же появится "искра", которая будет медленно двигаться по контуру рисунка, пока не замкнёт его полностью. Вот что происходит: Калиевая селитра разлагается по уравнению:
Здесь KNO2 +O2 - соль азотистой кислоты. От выделяющегося кислорода бумага обугливается и сгорает. Для большего эффекта опыт можно проводить в тёмном помещении.
Химические опыт растворения стекла в плавиковой кислоте

Стекло растворяется
в плавиковой кислоте
Действительно, стекло легко растворяется. Стекло - это очень вязкая жидкость. В том, что стекло может растворяться, можно убедиться, проделав следующую химическую реакцию. Плавиковая кислота - это кислота, образованная растворением фтороводорода (HF) в воде. Её ещё называют фтороводородная кислота. Для большей наглядности возьмём тонкое спекло, на которое прицепим грузик. Стекло с грузиком опустим в раствор плавиковой кислоты. Когда стекло растворится в кислоте, грузик упадёт на дно колбы.
Химические опыты с выделением дыма

Химические реакции с
выделением дыма
(хлорид аммония)
Проведём красивый опыт по получению густого белого дыма. Для этого нам нужно приготовить смесь поташа (карбонат калия К2CO3) раствором аммиака (нашатырный спирт). Смешаем реагенты: поташ и нашатырный спирт. К полученной смеси добавим раствор соляной кислоты. Реакция начнётся уже в момент, когда колба с соляной кислотой будет близко поднесена к колбе, в которой содержится аммиак. Аккуратно прилейте соляную кислоту к раствору аммиака и наблюдайте образование густого белого пара хлорида аммония, химическая формула которого NH4Cl. Химическая реакция между аммиаком и соляной кислотой протекает следующим образом:
Химические опыты: свечение растворов

Реакция свечения раствора
Как отмечено выше - свечение растворов - признак химической реакции. Проведём ещё один эффектный опыт, при котором у нас раствор будет светиться. Для реакции нам необходим раствор люминол, раствор перекиси водорода H2O2 и кристаллики красная кровяной кровяной соли K3[Fe(CN)6]. Люминол - сложное органическое вещество, формула которого C8H7N3O2. Люминол хорошо растворяется в некоторых органических растворителях, при этом в воде не растворяется. Свечение происходит при реакции люминола с некоторыми окислителями в щелочной среде.
Итак, начнём: прилейте раствор перекиси водорода к люминолу, затем к полученному раствору добавьте горсть кристалликов красной кровяной соли. Для большего эффекта попробуйте проводить опыт в темном помещении! Как только кристаллики кровяной красной соли коснуться раствора, сразу будет заметно холодное голубое свечение, что свидетельствует о течении реакции. Свечение при химической реакции называется хемилюминисценцией
Ещё один химический опыт со светящимися растворами:
Для него нам потребуется: гидрохинон (раньше использовался в фототехнике), карбонат калия K2CO3 (ещё известен под названием "поташ"), аптечный раствор формалина (формальдегида) и перекись водорода. Растворите 1 гр гидрохинона и 5 гр карбоната калия K2CO3 в 40 мл аптечного формалина (водный раствор формальдегида). Перелейте эту реакционную смесь в большую колбу или бутылку емкостью не менее литра. В небольшом сосуде приготовьте 15 мл концентрированного раствора перекиси водорода. Можно использовать таблетки гидроперита - соединение перекиси водорода с мочевиной (мочевина не помешает опыту). Для большего эффекта зайдите в темную комнату, когда глаза привыкнут к темноте, слейте раствор пероксида водорода в большой сосуд с гидрохиноном. Смесь начнет вспениваться (поэтому и надо взять большой сосуд) и появится отчетливое оранжевое свечение!
Химические реакции, при которых появляется свечение происходят не только при окислении. Иногда свечение возникает при кристаллизации. Самый простой способ его наблюдения - поваренная соль. Растворите поваренную соль в воде, причем соли возьмите столько, чтобы на дне стакана оставались нерастворившиеся кристаллы. Полученный насыщенный раствор перелейте в другой стакан и по каплям добавляйте к этому раствору концентрированную соляную кислоту. Соль начнет кристаллизоваться, при этом в растворе будут проскальзывать искры. Наиболее красиво, если опыт ставить в темноте!

Бихромат аммония
Химические опыты с хромом и его соединениями
Разноцветный хром. Окраска солей хрома может легко переходить из фиолетовой в зелёную и наоборот. Проведём реакцию: растворим в воде несколько фиолетовых кристалликов хлорида хрома CrCl3*6Н2О. При кипячении фиолетовый раствор этой соли становится зелёным. При выпаривании зелёного раствора образуется зелёный порошок того же состава, что и исходная соль. А если насытить охлаждённый до 0 °С зелёный раствор хлорида хрома хлороводородом (HCl), цвет его вновь станет фиолетовым. Как объяснить наблюдаемое явление? Это редкий в неорганической химии пример изомерии — существования веществ, имеющих одинаковый состав, но разные строение и свойства. В фиолетовой соли атом хрома связан с шестью молекулами воды, а атомы хлора являются противоионами: [Cr(Н2О)6]Cl3, а в зелёном хлориде хрома они меняются местами: [Cr(Н2О)4Cl2]Cl*2Н2О. В кислой среде бихроматы являются сильными окислителями. Продукты их восстановления — ионы Cr3+:

Хромат калия (жёлтый)
бихромат - (красный)
Химические опыты: восстановительные свойства железа

Хлорид железа III
Данный тип химической реакции относится к окислительно-восстановительным реакциям. Для проведения реакции нам потребуется разбавленный (5%-й) водные растворы хлорида железа(III) FeCl3 и такой же раствор иодида калия KI. Итак, в одну колбу наливают раствор хлорида железа(III). Затем добавляем к ней несколько капель раствора иодида калия. Наблюдаем изменение окраски раствора. Жидкость приобретёт красно-бурый цвет. В растворе будут протекать следующие химические реакции:

Хлорид железа II
Ещё один химический опыт с соединениями железа. Для него нам понадобятся разбавленные (10–15%-й) водные растворы сульфата железа(II) FeSO4 и тиоцианата аммония NH4NCS, бромная вода Br2. Начнём. В одну колбу наливаем раствор сульфата железа(II). Туда же добавляют 3–5 капель раствора тиоцианата аммония. Замечаем, что нет никаких признаков химических реакций. Конечно, катионы железа(II) не образуют с тиоцианат-ионами окрашенных комплексов. Теперь в эту колбу добавляем бромную воду. А вот теперь ионы железа "выдали себя" и окрасили раствор в кроваво-красный цвет. так реагируют ион (III) -валентного железа на тиоцианат-ионы. Вот, что происходило в колбе:
Химический опыт по обезвоживанию сахара серной кислотой

Обезвоживание сахара
серной кислотой
Концентрированная серная кислота обезвоживает сахар. Сахар - это сложное органическое вещество, формула которого C12H22O11. Вот, как это происходит. Сахарную пудру помещают в высокий стеклянный стакан, чуть смачивают водой. Затем к влажному сахару приливают немного концентрированной серной кислоты. осторожно и быстро перемешивают стеклянной палочкой. Палочку так и оставляют в середине стакана со смесью. Через 1 - 2 минуты сахар начинает чернеть, вспучиваться и в виде объёмной, рыхлой массы чёрного цвета подниматься, забирая с собой стеклянную палочку. Cмесь в стакане сильно разогревается и немного дымиться. При этой химической реакции серная кислота не только отбирает у сахара воду, но и частично превращает его в уголь.
Выделяющаяся вода при такой химической реакции в основном поглощается серной кислотой (серная кислота "жадно" поглощает воду) с образованием гидратов, - отсюда сильное выделение тепла. А углекислый газ CO2, который получается при окислении сахара, и сернистый газ SO2 поднимают обугливающуюся смесь вверх.
Химическая опыт с исчезновением алюминиевой ложки
Раствор нитрата ртути
Проведём ещё одну забавную химическую реакцию: для этого нам потребуется алюминиевая ложка и нитрат ртути (Hg(NO3)2). Итак, возьмём ложку, очистим её мелкозернистой наждачной бумагой, затем обезжирим ацетоном. Окуните ложку на несколько секунд в раствор нитрата ртути (Hg(NO3)2). (помните, что соединения ртути ядовиты!). Как только поверхность алюминиевой ложки в растворе ртути станет серого цвета, ложку надо вынуть, обмыть кипячёной водой высушить (промокая, но не вытирая). Через несколько секунд металлическая ложка будет превращаться в белые пушистые хлопья, и вскоре от неё останется лишь сероватая кучка пепла. Произошло вот что:
В растворе в начале реакции на поверхности ложки появляется тонкий слой амальгамы алюминия (сплав алюминия и ртути). Затем амальгама превращается в белые пушистые хлопья гидроксида алюминия (Al(OH)3). Израсходованный в реакции металл пополняется новыми порциями алюминия, растворённого в ртути. И, наконец, вместо блестящей ложки на бумаге остаётся белый порошок Al(OH)3 и мельчайшие капельки ртути. Если после раствора нитрата ртути (Hg(NO3)2) алюминиевую ложку сразу погрузить в дистиллированную воду, то на её поверхности появятся пузырьки газа и чешуйки белого цвета (произойдёт выделение водорода и гидроксида алюминия).

Перейти на английский
Chemical experiments
Читайте также:

