Давление газа краткое содержание 7 класс физика
Обновлено: 08.07.2024
Расстояния между молeкулами газа значительно больше. Двигаясь хаотично, молекулы сталкиваются между собой и ударяют о стенки, занимаемого им сосуда. Давление газа на стенки сосуда и вызывается этими ударами молекул газа.
Для газа характерно одинаковое давление по всем направлениям, оно является следствием беспорядочного движения огромного числа молекул.
Давление газа на внутренние поверхности (дно, крышку, стенки) сосуда, в который он помещён, одинаково по всем направлениям .
Все воздушные шары приобретают форму, в которой давление равномерно растягивает стенки шара. Сфера (шар) — форма, в которой давление на поверхность имеет наименьшее значение и равномерно по всем направлениям.
Сжатые газы проще транспортировать. Плотность сжатых газов больше, давление намного больше. Поэтому используют прочные сосуды — стальные баллоны.
1. При уменьшении объёма газа его давление увеличивается, а при увеличении объёма — давление уменьшается (при условии, что масса и температура газа остаются неизменными).
2. Давление газа в закрытом сосуде тем больше, чем выше температура газа (при условии, что масса газа и объём не изменяются).
Известно, что все вещества состоят из молекул, между которыми есть расстояния. Межмолекулярные расстояния в газах настолько велики, что молекулы газа практически не взаимодействуют друг с другом, поэтому газы обладают способностью занимать весь предоставленный объем. Например, стальной баллон для хранения газов, камера автомобильной шины или волейбольный мяч. При этом газ оказывает давление на стенки, дно и крышку баллона, камеры или любого другого тела, в котором он находится. Чем же определяется давление газов?

Для молекул веществ характерно беспорядочное движение. В отличие от твердых тел, в которых молекулы могут совершать только колебательное движение около точек равновесия, молекулы газов движутся беспорядочно в самых разных направлениях. При своем движении они сталкиваются друг с другом, а также со стенками сосуда, в котором находится газ. Молекул огромное количество, и число их ударов о стенки очень велико. Хотя сила удара отдельной молекулы мала, но действие всех молекул на стенки сосуда значительно, оно и создает давление газа.
Итак, давление газа на стенки сосуда (и на помещенное в газ тело) вызывается ударами молекул газа.
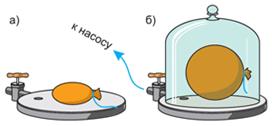
Рассмотрим следующий опыт.
Как объяснить результат этого опыта?
В нашем опыте первоначально плотность воздуха внутри воздушного шарика и снаружи была одинакова, следовательно, и число ударов молекул о стенки шарика с обеих сторон было равным по величине. Как только мы откачали воздух, число молекул снаружи шарика стало меньше, уменьшилось и число ударов о стенки, а значит, и давление воздуха приобрело меньшее значение. Но внутри воздушного шарика число молекул не изменяется. Следовательно, давление воздуха изнутри шарика будет больше, чем снаружи, и шарик увеличивается по всему объему равномерно. Этот опыт доказывает, что газ оказывает давление по всем направлениям одинаково из-за непрерывного беспорядочного движения его молекул.

Возьмем стеклянную трубку, один конец которой затянут резиновой пленкой и в трубку вставлен поршень. В трубке есть определенная масса воздуха. При вдвигании поршня мы заметим, что резиновая пленка выгибается наружу, а при выдвигании поршня – прогибается внутрь. Почему? При сжатии объем воздуха в шаре уменьшается, плотность воздуха становится больше, число ударов молекул о стенки сосуда увеличивается. Резиновая пленка выгибается до тех пор, пока сила давления воздуха в трубке не уравновесится силой упругости резиновой пленки. Если же поршень выдвигаем, то объем воздуха увеличивается, давление на стенки сосуда уменьшается и резиновая пленка прогибается внутрь.
Итак, при уменьшении объема газа его давление увеличивается, а при увеличении объема давление уменьшается при условии, что масса и температура газа остаются неизменными.

Давайте подумаем, зависит ли давление газа от его температуры? При нагревании скорость движения молекул увеличивается. Двигаясь быстрее, молекулы чаще ударяются о стенки сосуда. Надо учесть, что и сила удара при этом будет больше. Значит, давление газа тем больше, чем выше его температура, при условии, что масса и объем газа остаются неизменными.
Из этих опытов можно сделать общий вывод, что давление газа тем больше, чем чаще и сильнее молекулы ударяют о стенки сосуда.
Зависимость давления газа от объема и температуры нужно учитывать при хранении и транспортировке газов. Давление сжатого газа велико, поэтому его заключают в специальные, очень прочные баллоны. В таких баллонах, например, содержат сжатый воздух в подводных лодках, кислород, используемый при сварке металлов, газ, используемый в быту для приготовления пищи. Нельзя нагревать баллоны с газом, нельзя их ронять, изменение давления газа может привести к их взрыву.
Давление газа на стенки сосуда, на помещенное в газ тело определяется ударами молекул газа. Причина давления газа – непрерывное и беспорядочное движение молекул во всех направлениях, столкновения со стенками сосуда и поверхностью помещенных в газ тел.
Давление газа зависит:
1.от массы газа (чем больше масса газа, тем больше число молекул и больше ударов о стенки сосуда, тем больше давление газа на стенки сосуда);
2.от рода газа (масса молекул разных газов различна, чем больше масса молекулы, тем больше сила удара молекулы о стенки сосуда, больше давление);
3.от объема газа (чем меньше объем, тем больше плотность газа, тем больше давление);
4.от температуры газа (чем выше температура, тем больше скорость движения и сила удара молекул, тем больше давление газа).

Недавно мы рассмотрели такую величину, как давление на примере твердых тел. Но, оказывается, давление может создаваться и газами. На этом уроке мы рассмотрим, каким образом возникает давление газа и от чего зависит это давление.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Давление газа"
Давление газа
«Вызывает изумление
В этой теме речь пойдёт о том, каким образом могут оказывать давление газы.
В газах молекулы расположены друг от друга на большом расстоянии, поэтому, силы взаимного притяжения между молекулами практически отсутствуют. Известно также, что газы легко сжимаются. Молекулы газа двигаются беспорядочно, занимая весь предоставленный им объём. Молекулы сталкиваются не только друг с другом, но и ударяются о стенки сосуда. Именно эти удары и создают давление. Сила удара одной молекулы ничтожно мала, но ведь количество молекул даже в маленьком сосуде очень велико.

Рассмотрим классический опыт: возьмем завязанный шарик с небольшим количеством воздуха и накроем его стеклянным сосудом. Если выкачать из сосуда воздух, то объём воздушного шарика увеличится. Почему же это произошло? Дело в том, что изначально по шарику ударяли молекулы воздуха внутри сосуда, противодействуя ударам молекул внутри шарика. Таким образом, оболочка шарика сохраняла свой объём. Но когда воздух был откачен из сосуда, во много раз уменьшилось количество молекул воздуха внутри него. Ударов по шарику снаружи стало гораздо меньше, но вот количество молекул внутри шарика не изменилось. Это позволило газу внутри шарика расширяться до тех пор, пока давление газа внутри не стало равно давлению газа снаружи. Из этого можно сделать вывод, что при увеличении объёма, давление газа уменьшается. Но если мы вновь наполним сосуд воздухом, то шарик снова сдуется. Значит, при уменьшении объёма, давление увеличивается.
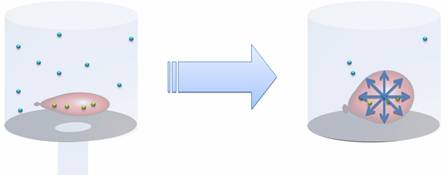
Следует понимать, что эти утверждения верны только в том случае, если речь идет о неизменной массе газа, находящейся при неизменной температуре. Также следует отметить: когда воздух был откачен из сосуда, форма шарика действительно стала шарообразной (а не вытянутой, как это было изначально). Это значит, что газ давит на оболочку шарика (или стенки сосуда) одинаково по всем направлениям. Это объясняется беспорядочным движением молекул. Они двигаются в случайных направлениях, но их число настолько велико, что можно с уверенностью сказать, что во всех направлениях летит одинаковое число молекул. В результате этого на каждый маленький кусочек площади поверхности шарика приходится одинаковое число ударов, то есть, создается одинаковое давление.
Проведем еще один опыт: возьмем цилиндр с подвижным поршнем и поместим туда некоторое количество газа.
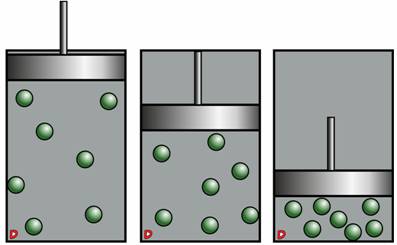
Если поршень будет двигаться, то можно изменять объём газа, при этом сохраняя его массу. Таким образом, плотность газа увеличиться, то есть на единицу объёма будет приходиться большее число молекул газа. В этом случае, они значительно чаще будут ударяться о стенки сосуда. То есть, таким способом можно увеличить давление. Это еще раз доказывает, что при уменьшении объёма газа постоянной массы и температуры, давление увеличивается, а при увеличении объёма – давление уменьшается.
Если плотно закрыть пластиковую бутылку и сжать её, то можно почувствовать значительное сопротивление – молекулы газа будут давить на стенки бутылки изнутри, не давая вам сжать её.
Поставим опыт: Не будем изменять ни массу газа, ни его объём, а просто нагреем газ в плотно закрытом сосуде. В этом случае давление газа увеличится. Это объясняется тем, что при увеличении температуры, молекулы газа начинают двигаться быстрее, а, следовательно, будут чаще ударяться о стенки сосуда. То есть, при увеличении температуры газа постоянной массы и объёма, давление газа увеличивается, и, наоборот, при уменьшении температуры, давление газа уменьшается. Если слегка заткнуть стеклянную бутылку пробкой и нагреть бутылку, то пробка выскочит из горлышка под давлением газа.
Зависимость давления газа от температуры нередко используется людьми. Например, чтобы поместить большое количество газа в сравнительно небольшой объём, газ охлаждают и закачивают в баллон. После того, как газ вновь нагревается, в баллоне создается очень высокое давление. Именно поэтому на таких баллонах, как правило, пишут предупреждения о том, чтобы баллон ни в коем случае не нагревали и не ударяли (это может привести к взрыву – настолько в баллоне высокое давление).

Примеров давления газа можно привести очень много: это и накачанный мяч, и накачанные шины автомобиля, и атмосферное давление.
Упражнение 1. Из баллона медленно выпустили половину газа и снова закрыли его. Как изменится давление в баллоне?
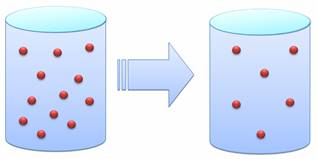
Поскольку молекул газа внутри баллона стало вдвое меньше, они вдвое меньше стали ударяться о стенки баллона. Следовательно, давление уменьшилось вдвое.
Упражнение 2. Одинаковые массы одного и того же газа находятся в двух баллонах: зеленом и синем. Известно, что температура и в том, и в другом баллоне одинакова. В каком баллоне давление будет больше?

По условию задачи, в обоих баллонах одинаковые условия. Из рисунка явно видно, что синий баллон больше зеленого. Поэтому давление в нем будет меньше, поскольку молекулы газа меньше будут ударяться о его стенки.
Упражнение 3. Воздушный шарик завязали и облили его ледяной водой. Из-за этого шарик немного сжался. Можете ли вы объяснить, почему это произошло?
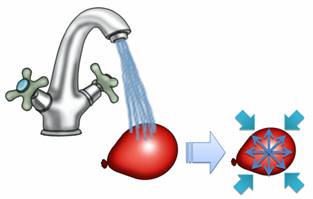
Из-за понижения температуры, давление внутри шарика уменьшилось. В результате внешнее давление сжимало шарик до тех пор, пока внутреннее давление вновь ни стало равным внешнему.
Основные выводы:
– Давление газа – это давление, которое создается в результате ударов молекул о стенки сосуда (или о какое-то другое тело).
– Давление газа одинаково по всем направлениям.
– При неизменной массе и температуре, давление газа тем больше, чем меньше его объём. И, наоборот, давление газа тем меньше, чем больше объём.
– При постоянной массе и объёме, давление можно изменить, изменяя температуру. При нагревании газа, его давление будет увеличиваться, а при охлаждении – наоборот, уменьшаться.
Из курса физики 7 класса известно, что газ — это состояние вещества, при котором молекулы имеют достаточную скорость и энергию, чтобы преодолевать силы взаимного притяжения и удаляться друг от друга, заполняя весь предоставленный объём. Важнейшей характеристикой газа является давление. Рассмотрим эту тему подробнее, приведём формулу давления газа.

Давление в газах
Как известно из механики, давление — это мера распределения силы по некоторой площади. Она равна отношению величины силы, действующей на тело, к площади, на которой распределено действие.
Молекулы газа, заполняя предоставленный объём сосуда, непрерывно сталкиваются друг с другом и со стенками. Силы соударений отдельных молекул сливаются в одну общую силу. При этом из-за хаотичности движения молекул в любой точке газа есть молекулы, движущиеся во всех направлениях. А значит, эта сила есть в любой точке газа, и действует она также во всех направлениях. Причём, чем большую область мы будем рассматривать, тем больше в ней будет молекул, и тем большая сила будет действовать на границы этой области.
Получается, что в любой точке газа соударения молекул создают некоторую силу, пропорциональную площади, причём отношение этих двух величин постоянно. Это и есть давление газа.

Рис. 1. Удары молекул о стенки сосуда.
Связь температуры и давления
Итак, давление газа создаётся хаотически движущимися молекулами в результате постоянных соударений. Следовательно, чем больше средняя скорость движения молекул, тем больше будет давление газа. А мера средней скорости молекул — это температура. Значит, если газ содержится в некотором постоянном объёме, то его давление будет пропорционально температуре. Данный закон был установлен в конце XVIII в. Ж. Шарлем и получил его имя.
Закон Шарля гласит, что отношение давления газа к его абсолютной температуре при неизменном объёме остаётся постоянным:
- $p$ — давление газа;
- $T$ — абсолютная температура газа.
Закон Шарля — это один из газовых законов молекулярно-кинетической теории (МКТ), связывающих макроскопические газовые параметры: давление, температуру и объём. Закон Шарля описывает ситуацию, когда объём газа постоянен.

Рис. 2. Газовые законы.
Основное уравнение МКТ
Поскольку давление газа обуславливается хаотическим движением молекул, то его величина может быть определена, исходя из концентрации молекул, массы и средней скорости молекулы:
- $p$ — давление газа;
- $n$ — число молекул в единице объёма (концентрация);
- $m_0$ — масса молекулы;
- $ v_^2$ — среднеквадратичная скорость молекулы.
Данное соотношение называется основным уравнением МКТ. Оно связывает средние параметры одной молекулы с давлением газа. Температура в эту формулу не входит, однако она неявно присутствует в ней в виде среднеквадратичной скорости, которая пропорциональна температуре.

Рис. 3. Молекулярно-кинетическая теория.
Что мы узнали?
Давление газа обуславливается постоянными ударами молекул газа о стенки сосуда и между собой. Давление при постоянном объёме растёт при росте температуры. Величина давления может быть определена с помощью основного уравнения МКТ.
Учитель физики, информатики и вычислительной техники. Победитель конкурса лучших учителей Российской Федерации в рамках Приоритетного Национального Проекта "Образование".
Читайте также:

