Условия протекания ферментативных реакций сообщение
Обновлено: 02.07.2024
Биохимические реакции протекают только при участии ферментов, т. е. катализаторов, являющихся по своему составу и строению белками. Как из курса неорганической, так и из курса органической химии известны вещества, проявляющие каталитическое действие. Такие вещества, называемые катализаторами, есть во всех классах веществ – простые вещества (как металлы, так и неметаллы), кислоты, основания, оксиды, соли. Особенно широко применяются катализаторы в органической химии, так как для органических веществ характерна относительно низкая реакционная способность. Переходя на новую ступень химии – биохимию, мы встречаемся и с новым классом катализаторов – ферментами. Бесконечное разнообразие структуры белковых молекул оказывается предпосылкой биосинтеза специальных белков, пригодных в качестве катализаторов для всех осуществляющихся в природе биохимических процессов.
Ферментативному катализу присущи характерные особенности всех каталитических процессов, но обнаруживаются и принципиально важные отличия. К общим закономерностям относятся следующие:
· Ферменты увеличивают скорость реакции, но не смещают химическое равновесие;
· Ферменты ускоряют те реакции, которые могут самопроизвольно протекать в данных условиях;
· Несамопроизвольная реакция, сопряженная с самопроизвольной, также протекает при участии ферментов
· Скорость ферментативной реакции зависит от температуры и концентраций реактантов (субстрата и фермента).
К специфическим особенностям ферментативных реакций относятся следующие:
· Ферменты отличаются более высокой, чем обычные катализаторы, избирательностью к субстратам. Часто фермент ускоряет только одну биохимическую реакцию или достаточно узкую группу родственных реакций;
· Ферменты действуют стереоспецифически, ускоряя синтез только одного из возможных пространственных изомеров.
· Ферменты проявляют активность в ограниченном интервале температуры – ниже температуры денатурации данного белка;
· Активность фермента зависит от рН среды; у каждого фермента есть оптимальное значение рН, при котором активность максимальна.
· Многие ферменты действуют только при активировании коферментами – низкомолекулярными молекулами и ионами.
· Ферменты могут находиться в растворенном состоянии или быть встроенными в клеточные мембраны.
· Активность фермента может зависеть от концентрации продукта реакции.
Ферменты присутствуют в клетках в крайне малых концентрациях. Определение их в тканевых экстрактах или жидкостях – сложная задача. Поэтому разработаны особые подходы к определению каталитической активности ферментов. Измеряют скорость реакции, идущей под действием имеющегося фермента. Результат выражают в единицах активности фермента. Затем сравнивают относительные количества фермента в разных экстрактах. Единицы активности выражают в мкмоль (10 –6 ), нмоль (10 –9 ) или пмоль (10 –12 ) израсходованного субстрата или образовавшегося продукта в единицу времени (минуту). Международные единицы активности обозначаются mU, nU и pU.
К ферментативному катализу приложимы основные положения теории скоростей химических реакций. Для протекания реакции необходимо сближение (столкновение) молекул фермента (встречаются обозначения F, Е, Enz) и субстрата (S) достаточное для образования связей. Для того, чтобы столкновение оказалось продуктивным (активным), молекулы должны иметь энергию, достаточную для преодоления энергетического барьера. Как известно, этот барьер называется энергией активации. На отдельных стадиях ферментативной реакции фермент выступает как обычный реактант, реагируя в молярном отношении 1:1. Ферментативные процессы часто представляют специальными схемами. Например, реакция переноса группы
при участии фермента изображается следующим образом:
В качестве еще одного примера написания схемы ферментативной реакции возьмем реакцию изомеризации
С участием фермента реакция записывается так:
S Enz изо-S
Стрелки создают картину циклического процесса, в который вовлекаются молекулы субстрата S и выходят молекулы продукта, часто обозначаемого как P.

Фермент представляет собой сложную молекулу, состоящую из сотен аминокислотных остатков и тысяч атомов. В связывании с субстратом может участвовать только небольшая группа атомов в такой молекуле. Эта группа называется активным центром. Э. Фишер предложил модель взаимодействия Enz–S как соответствие ключа и замка. Только при наличии такого соответствия может осуществиться превращение субстрата. Становится понятной избирательность действия фермента. Эта модель не потеряла своего значения, но позднее была предложена модель индуцированного соответствия (Кошланд), в которой учитывается гибкость молекулы фермента. При сближении молекул фермента и субстрата происходят конформационные изменения фермента, придающие окончательную конфигурацию реакционному центру. Молекулы, аналогичные субстрату, тоже могут вызывать конформационные изменения фермента, но при этом появляются различия в конформациях, при которых не возникает работающий активный центр.
Лекция 11
Биохимические реакции протекают только при участии ферментов, т. е. катализаторов, являющихся по своему составу и строению белками. Как из курса неорганической, так и из курса органической химии известны вещества, проявляющие каталитическое действие. Такие вещества, называемые катализаторами, есть во всех классах веществ – простые вещества (как металлы, так и неметаллы), кислоты, основания, оксиды, соли. Особенно широко применяются катализаторы в органической химии, так как для органических веществ характерна относительно низкая реакционная способность. Переходя на новую ступень химии – биохимию, мы встречаемся и с новым классом катализаторов – ферментами. Бесконечное разнообразие структуры белковых молекул оказывается предпосылкой биосинтеза специальных белков, пригодных в качестве катализаторов для всех осуществляющихся в природе биохимических процессов.
Ферментативному катализу присущи характерные особенности всех каталитических процессов, но обнаруживаются и принципиально важные отличия. К общим закономерностям относятся следующие:
· Ферменты увеличивают скорость реакции, но не смещают химическое равновесие;
· Ферменты ускоряют те реакции, которые могут самопроизвольно протекать в данных условиях;
· Несамопроизвольная реакция, сопряженная с самопроизвольной, также протекает при участии ферментов
· Скорость ферментативной реакции зависит от температуры и концентраций реактантов (субстрата и фермента).
К специфическим особенностям ферментативных реакций относятся следующие:
· Ферменты отличаются более высокой, чем обычные катализаторы, избирательностью к субстратам. Часто фермент ускоряет только одну биохимическую реакцию или достаточно узкую группу родственных реакций;
· Ферменты действуют стереоспецифически, ускоряя синтез только одного из возможных пространственных изомеров.
· Ферменты проявляют активность в ограниченном интервале температуры – ниже температуры денатурации данного белка;
· Активность фермента зависит от рН среды; у каждого фермента есть оптимальное значение рН, при котором активность максимальна.
· Многие ферменты действуют только при активировании коферментами – низкомолекулярными молекулами и ионами.
· Ферменты могут находиться в растворенном состоянии или быть встроенными в клеточные мембраны.
· Активность фермента может зависеть от концентрации продукта реакции.
Ферменты присутствуют в клетках в крайне малых концентрациях. Определение их в тканевых экстрактах или жидкостях – сложная задача. Поэтому разработаны особые подходы к определению каталитической активности ферментов. Измеряют скорость реакции, идущей под действием имеющегося фермента. Результат выражают в единицах активности фермента. Затем сравнивают относительные количества фермента в разных экстрактах. Единицы активности выражают в мкмоль (10 –6 ), нмоль (10 –9 ) или пмоль (10 –12 ) израсходованного субстрата или образовавшегося продукта в единицу времени (минуту). Международные единицы активности обозначаются mU, nU и pU.
К ферментативному катализу приложимы основные положения теории скоростей химических реакций. Для протекания реакции необходимо сближение (столкновение) молекул фермента (встречаются обозначения F, Е, Enz) и субстрата (S) достаточное для образования связей. Для того, чтобы столкновение оказалось продуктивным (активным), молекулы должны иметь энергию, достаточную для преодоления энергетического барьера. Как известно, этот барьер называется энергией активации. На отдельных стадиях ферментативной реакции фермент выступает как обычный реактант, реагируя в молярном отношении 1:1. Ферментативные процессы часто представляют специальными схемами. Например, реакция переноса группы
при участии фермента изображается следующим образом:
В качестве еще одного примера написания схемы ферментативной реакции возьмем реакцию изомеризации
С участием фермента реакция записывается так:
S Enz изо-S
Стрелки создают картину циклического процесса, в который вовлекаются молекулы субстрата S и выходят молекулы продукта, часто обозначаемого как P.
Фермент представляет собой сложную молекулу, состоящую из сотен аминокислотных остатков и тысяч атомов. В связывании с субстратом может участвовать только небольшая группа атомов в такой молекуле. Эта группа называется активным центром. Э. Фишер предложил модель взаимодействия Enz–S как соответствие ключа и замка. Только при наличии такого соответствия может осуществиться превращение субстрата. Становится понятной избирательность действия фермента. Эта модель не потеряла своего значения, но позднее была предложена модель индуцированного соответствия (Кошланд), в которой учитывается гибкость молекулы фермента. При сближении молекул фермента и субстрата происходят конформационные изменения фермента, придающие окончательную конфигурацию реакционному центру. Молекулы, аналогичные субстрату, тоже могут вызывать конформационные изменения фермента, но при этом появляются различия в конформациях, при которых не возникает работающий активный центр.
Общее понятие, характеристика классов и исследование свойств ферментов как белков, выполняющих роль катализаторов в живых организмах. Реакционная и субстратная специфичность ферментов. Процесс ферментативного катализа и кинетика ферментативных реакций.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 13.12.2011 |
| Размер файла | 16,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Ферменты и ферментные реакции
Реакционная и субстратная специфичность
Кинетика ферментативных реакций
свойство реакция катализ фермент
Ферменты
Ферментативная активность
Каталитическое действие фермента, т. е. его активность, определяют в стандартных условиях по увеличению скорости (фиолетовый цвет на схеме) каталитической реакции (оранжевый цвет) по сравнению с некаталитической (желтый цвет). Обычно скорость реакции указывают как изменение концентрации субстрата или продукта за единицу времени (моль/(л·с)) . Так как каталитическая активность не зависит от объема раствора, в котором протекает реакция, активность фермента выражают в каталах; 1 кат -- это количество фермента, которое превращает 1 моль субстрата за 1 с. Другой единицей активности является международная единица (E) -- количество фермента, превращающего 1 мкмоль субстрата в 1 мин (1 E = 16,7 нкат).
Реакционная и субстратная специфичность
Действие большинства ферментов высоко специфично. Понятие специфичности относится не только к типам каталитических реакций (реакционная специфичность), но и к природе соединений - субстратов (субстратная специфичность). В качестве примера на схеме приведены ферменты, расщепляющие химическую связь. Высокоспецифичные ферменты (тип А -- верхняя строка таблицы) катализируют расщепление только одного типа связи в субстратах определенной структуры. Ферменты типа Б (средняя строка) обладают ограниченной реакционной специфичностью, но широкой субстратной специфичностью. Ферменты типа В (с низкой реакционной и низкой субстратной специфичностями; нижняя строка) встречаются редко.
Классы ферментов
Ферментативный катализ
Ферменты -- высокоэффективные катализаторы. Они повышают скорость катализируемой реакции в 10 12 раз и более. Для понимания механизма ферментативного катализа полезно прежде всего рассмотреть протекание некаталитической реакции.
Некаталитическая реакция (в отсутствие фермента)
В качестве примера рассмотрим реакцию типа А + В > С + D. Вещества A и Вв растворе окружены оболочкой из молекул воды (гидратной оболочкой) и под действием теплового движения перемещаются случайным образом. Они могут вступать в реакцию друг с другом только в том случае, когда сталкиваются в благоприятной ориентации, что маловероятно и происходит редко.
Для образования продуктов C + D комплекс A--В, возникший в результате соударения молекул, должен образовать переходное состояние, для чего требуется, как правило, значительная энергия активации Ea. Поскольку получить эту энергию может только небольшая часть комплексов A--В, достижение переходного состояния -- еще более редкий случай, чем возникновение комплекса. В растворе большая часть анергии активации расходуется на преодоление гидратных оболочек между A и В, сближение реагентов и другие химические процессы, в которых эти реагенты участвуют. В результате в отсутствие катализатора образование продуктов происходит крайне редко и скорость реакции v незначительна, даже когда реакция термодинамически допустима, т. е. ДG E + В.
Определение V и Кm
В принципе V и Кm можно определить по графику зависимости v от [A] (рис. слева). Так как v асимптотически достигает V с возрастанием концентрации субстрата [A], то затруднительно получить надежную величину V и Кm (рис. слева) путем экстраполяции.
Для удобства расчетов уравнение Михаэлиса-Ментен можно преобразовать так, чтобы экспериментальные точки лежали на прямой. При одном из таких графических преобразований в так называемом графике Иди-Хофсти(pиc. справа) строят график зависимости v от v/[A]. В этом случае точка пересечения прямой, полученной путем наилучшей линейной аппроксимации экспериментальных точек, с осью ординат соответствует V, а тангенс угла наклона равен -Km. Такой графический подход дня определения V и Кm также не оптимален. В настоящее время данные ферментативной кинетики обрабатывают быстрее и более объективно с помощью вычислительной техники.
Многие соединения могут влиять на обмен веществ, модулируя активность соответствующих ферментов. Особенно важные функции при этом выполняют ингибиторы ферментов. Ингибиторами ферментов являются многие лекарственные вещества природного или синтетического происхождения. Метаболиты также могут быть ингибиторами ферментов в процессах регуляции.
Типы ингибирования
Большинство ингибиторов ферментов действуют обратимо, т. е. не вносят в молекулу фермента каких-либо изменений после своей диссоциации. Однако существуют также необратимые ингибиторы ферментов, которые необратимо модифицируют целевой фермент. Принцип действия ингибитора, тип его ингибирования определяют путем сравнения кинетики реакции в присутствии ингибиторам без него (см. схему Б). Различают конкурентное (А, слева) и неконкурентное (А, справа) ингибирование. В регуляции обмена веществ важную роль играет аллостерическое ингибирование (А, 6).
Так называемые аналоги субстрата (2) имеют свойства, подобные свойствам субстрата целевого фермента. Они обратимо блокируют часть молекул имеющегося в наличии фермента, но не могут далее превращаться в продукт. Поэтому для достижения половины максимальной скорости реакции необходимы более высокие концентрации субстрата: в присутствии такого ингибитора константа МихаэлисаKm растет (Б). Субстрат в высоких концентрациях вытесняет ингибитор с фермента. Поэтому максимальная скорость V при этом типе торможения не претерпевает изменений. Так как субстрат и ингибитор конкурируют за место связывания на ферменте, данный тип торможения называют конкурентным. Аналоги переходного состояния (3) также действуют как конкурентные ингибиторы.
Если ингибитор реагирует с функционально важной группой фермента, не препятствуя связыванию субстрата, такое ингибирование называется неконкурентным (на схеме справа). В этом случае Km остается неизменной, напротив уменьшается концентрация функционально активного фермента [Е] t и, следовательно, максимальная скорость реакции V. Неконкурентные ингибиторы действуют как правило необратимо, поскольку они модифицируют функциональные группы целевого фермента (4).
В случае так называемых "суицидныхсубстратов" (5) речь идет о субстратных аналогах, содержащих дополнительно реакционную группу. Вначале они связываются обратимо, а затем образуют ковалентное соединение с активным центром фермента. Поэтому ингибирование такими соединениями проявляется как неконкурентное. Известным примером такого ингибитора является антибиотик пенициллин.
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра (6). Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Кинетика ингибирования
Конкурентное ингибирование легко можно отличить от неконкурентного при использовании графика Иди-Хофсти. Как уже упоминалось, конкурентные ингибиторы влияют только на Km, но не на V. Полученные в отсутствие и в присутствии ингибитора прямые на графике пересекаются на оси ординат. Прямые для неконкурентного ингибирования имеют одинаковый наклон (Кmне изменяется), однако по мере увеличения концентрации ингибитора отрезки, отсекаемые этими прямыми на оси ординат, становятся все короче. Для аллостерических ферментов нельзя применять график Иди-Хофсти, имеющий в этом случае нелинейный характер (здесь не приведен).
Ферментативный анализ
Ферменты играют важную роль в биохимическом анализе. В биологических материалах, например в жидкостях организма, с помощью определения каталитической активности можно обнаружить ферменты в ничтожно малых концентрациях. Ферменты можно использовать как реагенты для определения концентраций метаболитов, например уровня глюкозы в крови (схема В). В большинстве ферментативных анализов применяется фотометрия.
Основы спектрофотометрии
Многие молекулы поглощают свет в видимой или ультрафиолетовой области спектра. Это свойство можно использовать для определения концентраций. Величина поглощения зависит от типа и концентрации вещества, а также от длины волны используемого света. Поэтому применяют монохроматический свет, т. е. свет определенной длины волны, который можно выделить из белого света с помощью монохроматора. Монохроматический свет интенсивности I0 проходит через прямоугольную ячейку из стекла или кварца (кювету), в которой находится раствор поглощающего вещества. Интенсивность I выходящего света, ослабленного поглощением, измеряется с помощью детектора. Поглощение света (А) раствора (оптическая плотность) определяется как отрицательный логарифм отношения I / I0. Закон Ламберта-Берагласит, что А пропорциональна концентрации (с) вещества и толщине (d) слоя раствора. Коэффициент экстинкции е зависит, как было указано выше, от типа вещества и длины волны.
Определение активности лактатдегидрогеназы
Определение активности лактатдегидрогеназы [ЛДГ (LDH)] основано на том факте, что восстановленный кофермент НАДН + H + поглощает свет при 340 нм, в то время как у НАД + (NAD + ) при этой длине волны поглощение отсутствует. Спектры поглощения (т. е. графики зависимости А от длины волны) субстрата и кофермента в ЛДГ-реакции показаны на рис. Б1.
Различия в поглощении НАД + и НАДН между 300 и 400 нм обусловлены изменениями никотинамидного кольца при окислении или восстановлении.
Для определения активности в кювету помещают, прежде всего растворы лактата и НАД + и регистрируют поглощение при постоянной длине волны 340 нм. Некаталитическая реакция протекает с очень низкой скоростью. Поэтому измеряемые количества НАДН образуются только после добавления ЛДГ. Так как скорость увеличения поглощения ДA/Дt по закону Ламберта-Бера пропорциональна скорости реакции Дc/Дt , активность ЛДГ можно рассчитать с помощью коэффициента экстинкции е при 340 нм или путем сравнения со стандартным раствором.
Ферментативное определение глюкозы
Большинство биомолекул не поглощают свет в видимой или ультрафиолетовой областях спектра. Кроме того, они обычно присутствуют в смеси с другими соединениями, которые также дают аналогичные химические реакции.
Обе трудности можно преодолеть с помощью подходящего фермента для избирательного превращения определяемого метаболита в окрашенное вещество, которое далее определяют по интенсивности поглощения света.
Обычный метод определения глюкозы в крови основан на двух последовательных реакциях:
1) образование глюконолактона и пероксида водорода H2O2 под действием фермента глюкозооксидазы ;
2) окисление бесцветного вещества пероксидом водорода в окрашенное зеленое соединение в реакции, катализируемой пероксидазой.
Когда вся имеющаяся в пробе глюкоза израсходована, количество образованного окрашенного вещества можно определить по светопоглощению, которое прямо пропорционально первоначальному содержанию глюкозы.
Подобные документы
Ускорение химических реакций с помощью катализаторов. Особенности ферментов (энзимов) как высокоспецифичных белков, выполняющих функции биологических катализаторов. Строение ферментов, их специфичность и классификация. Этапы ферментативного катализа.
презентация [3,4 M], добавлен 20.11.2014
Классификация ферментов, их функции. Соглашения о наименовании ферментов, структура и механизм их действия. Описание кинетики односубстратных ферментативных реакций. Модели "ключ-замок", индуцированного соответствия. Модификации, кофакторы ферментов.
презентация [294,1 K], добавлен 17.10.2012
Характеристика ферментов, органических катализаторов белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Условия действия, получение и применение ферментов. Болезни, связанные с нарушением выработки ферментов.
презентация [2,6 M], добавлен 19.10.2013
Общая характеристика и основные типы ферментов. Химические свойства ферментов и катализируемых ими реакций. Селективность и эффективность ферментов. Зависимость от температуры и от среды раствора. Активный центр фермента. Скорость ферментативных реакций.
презентация [1,8 M], добавлен 06.10.2014
Определение ферментов как специфических белков, присутствующих во всех живых клетках биологических катализаторов. Пространственность структурной молекулы ферментов, процесс биосинтеза оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы.
контрольная работа [13,5 K], добавлен 27.01.2011
Кинетические исследования ферментативных реакций для определения ферментов и сравнения их скоростей. Образование из фермента и субстрата фермент-субстратного комплекса за счет сил физической природы. Факультативные организмы, автотрофы и гетеротрофы.
контрольная работа [858,4 K], добавлен 26.07.2009
Ферменты: биохимическое строение и физиологическая роль. Анализ методики определения активности ферментов и ферментативного спектра в жидкостях организма. Основные ферменты в моче в норме и при патологии. Ферментный спектр мочи при заболеваниях почек.
Протекание ферментативной реакции по ок-сигеназному пути приводит к истощению клеточного пула молекул рибулозодифосфата и, как следствие этого, понижению активности восстановительного пентозофосфатного цикла в клетке. Помимо существования в основной форме в биологических реакциях и под действием различных физико-химических факторов возникают продукты неполного восстановления 02, более реакционно способные и обладающие высокой токсичностью для клетки. [1]
Для протекания ферментативной реакции требуется очень небольшое количество фермента. [2]
Кинетика предстационарного протекания ферментативных реакций в том приближении, в котором она была изложена ( условие избытка одного из реагентов и небольшая глубина превращения субстрата), изучалась в основном струевыми методами. [3]
Оптимальная реакция среды для протекания ферментативных реакций находится в пределах рН 5 - 4 - 7, хотя для некоторых ферментов она может быть иной. [4]
Высокая реакционная способность сопряженных полииновых систем способствует протеканию ферментативных реакций тиилирования . В зависимости от условий могут образовываться соединения, содержащие один или два ос-связанных тиофеновых цикла. [5]
Кофактор ( Cofactor) Низкомолекулярное вещество, необходимое для протекания определенной ферментативной реакции . [6]
Однако иногда структура агликонной части полисахарида оказывается весьма существенной для протекания ферментативной реакции . Так, R-фермент катализирует гидролиз а-1 6-связей разветвлений лишь в тех случаях, когда точки ветвлений разделены между со бой по крайней мере пятью глюкозидными остатками137, как, например, в амилопектине. Фермент не оказывает действия на гликоген. [7]
Все современные теории биохимических процессов основываются на представлениях о закономерностях протекания ферментативных реакций . Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратного комплекса. На первой стадии ферментативного катализа между субстратом ( органическим веществом) и ферментом возникает соединение с ковалентной или иного типа связью. Во второй фазе субстрат под действием фермента претерпевает изменение, делающее его более доступным для соответствующей химической реакции. В третьей фазе происходит химическая реакция ( на поверхности фермента) и, наконец, в четвертой фазе образовавшиеся продукты реакции освобождаются из фермент-продуктивного комплекса. [8]
Указанные критерии могут быть весьма полезны при интерпретации кинетических данных, описывающих протекание различных сопряженных ферментативных реакций . [9]
Для ферментативных реакций Q10 изменяется в пределах от I до 2, что обусловлено белковой природой ферментов, особенностями протекания ферментативной реакции и внутренней среды организма. Влияние температуры на скорость ферментативной реакции очень многообразно. Она может прежде всего влиять на стабильность фермента, ускоряя денатурацию ферментативного белка, что связано с инактивацией фермента; на сродство фермента к субстрату; скорость распада фермент-субстратного комплекса, всегда образующегося при ферментативной реакции; на сродство фермента к активаторам и ингибиторам, если они имеются в системе. Повышение температуры, с одной стороны, ускоряет саму ферментативную ( каталитическую) реакцию; с другой стороны, ускоряется инактивация фермента. Таким образом, с повышением температуры при ферментативных реакциях, как и вообще при химических процессах, растет реакционная способность, истинная каталитическая активность. Но ферменты представляют собой белки, которые необратимо денатурируют при увеличении температуры выше 50 С, причем скорость денатурации при нагревании увеличивается во много раз быстрее, чем скорость любого химического превращения. Поэтому процесс инактивации, связанный с уменьшением концентрации фермента в системе, обусловливает при дальнейшем повышении температуры замедление реакции. [10]
Из рассмотрения полученного равенства очевидно, что оно будет выполняться лишь в случае k2 k3r что формально соответствует двухстадийной схеме протекания ферментативной реакции . [12]
По-видимому, самым убедительным способом доказательства механизма двухтактного замещения является выделение замещенной формы фермента из реакционной смеси в условиях, соответствующих протеканию ферментативной реакции , однако в отсутствие второго субстрата. Если удается это осуществить и показать, что выделенный белок содержит группировку субстрата, подлежащую переносу, но не остаточную группировку цонорного субстрата, доказательство может считаться достаточно строгим. Если, помимо того, можно показать, что выделенное промежуточное производное фермента достаточно быстро реагирует с соответствующим вторым субстратом, образуя второй продукт, и, возможно, с первым продуктом, образуя исходный субстрат, доказательство может считаться полным. Все это настолько ясно, что не требует дальнейших разъяснений. Этот метод, однако, применим, далеко не всегда, так как не всегда удается найти заместитель, который давал бы с ферментом продукт, достаточно стабильный для целей выделения. [13]
Очевидно, что эта величина совладает в пределах ошибки эксперимента с величиной kKaT / Km ( Kai) k2 / Ks ( 1, 15 0 08) 105 ЛН-сек 1, определенной в стационарном режиме Протекания ферментативной реакции . [14]
Очевидно, что эта величина совпадает в пределах ошибки эксперимента с величиной & кат / Лт ( каж) &2 / / С8 ( 1 15 0 08) - 105 М - - сек 1, определенной в стационарном режиме протекания ферментативной реакции . [15]
Роль ферментов в организме
Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов — все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма — дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. — обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значительной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-либо его дефект могут привести к серьезным отрицательным последствиям для организма.
Каталитические свойства ферментов
История открытия ферментов
Местонахождение ферментов в организме
В клетке часть ферментов находится в цитоплазме, но в основном ферменты связаны с определенными клеточными структурами, где и проявляют свое действие. В ядре, например, находятся ферменты, ответственные за репликацию — синтез ДНК (ДНК-полимеразы), за ее транскрипцию — образование РНК (РНК-полимеразы). В митохондриях присутствуют ферменты, ответственные за накопление энергии, в лизосомах — большинство гидролитических ферментов, участвующих в распаде нуклеиновых кислот и белков.
Условия действия ферментов
Все реакции с участием ферментов протекают в основном в нейтральной, слабощелочной или слабокислой среде. Однако максимальная активность каждого отдельного фермента проявляется при строго определенных значениях pH. Для действия большинства ферментов теплокровных животных наиболее благоприятной температурой является 37-40 o С. У растений при температуре ниже 0 o С действие ферментов полностью не прекращается, хотя жизнедеятельность растений при этом резко снижается. Ферментативные процессы, как правило, не могут протекать при температуре выше 70 o С, так как ферменты, как и всякие белки подвержены тепловой денатурации (разрушению структуры).
Размеры ферментов и их строение
Молекулярная масса ферментов, как и всех остальных белков, лежит в пределах 10 тыс. — 1 млн. (но может быть и больше). Они могут состоять из одной или нескольких полипептидных цепей и могут быть представлены сложными белками. В состав последних наряду с белковым компонентом (апоферментом) входят низкомолекулярные соединения — коферменты (кофакторы, коэнзимы), в том числе ионы металлов, нуклеотиды, витамины и их производные. Некоторые ферменты образуются в форме неактивных предшественников (проферментов) и становятся активными после тех или иных изменений в структуре молекулы, например, после отщепления от нее небольшого фрагмента. К их числу относятся пищеварительные ферменты трипсин и химотрипсин, которые синтезируются клетками поджелудочной железы в форме неактивных предшественников (трипсиногена и химотрипсиногена) и обретают активность в тонком кишечнике в составе поджелудочного сока. Многие ферменты образуют так называемые ферментные комплексы. Такие комплексы, например, встроены в мембраны клеток или клеточных органелл и участвуют в транспорте веществ.
Подвергающееся превращению вещество (субстрат) связывается с определенным участком фермента, его активным центром, который формируется боковыми цепями аминокислот, находящимися часто в значительно удаленных друг от друга участках полипептидной цепи. Например, активный центр молекулы химотрипсина образуют остатки гистидина, находящегося в полипептидной цепи в положении 57, серина в положении 195 и аспарагиновой кислоты в положении 102 (всего в молекуле химотрипсина 245 аминокислот). Таким образом, сложная укладка полипептидной цепи в молекуле белка — ферменте обеспечивает возможность нескольким боковым цепям аминокислот оказаться в строго определенном месте и на определенном расстоянии друг от друга. Коферменты также входят в состав активного центра (белковая часть и небелковый компонент в отдельности ферментативной активностью не обладают и приобретают свойства фермента, лишь соединившись вместе).
Протекание процессов с участием ферментов
Большинство ферментов отличается высокой специфичностью (избирательностью) действия, когда превращение каждого реагирующего вещества (субстрата) в продукт реакции осуществляется специальным ферментом. При этом действие фермента может быть строго ограничено одним субстратом. Например, фермент уреаза, участвующий в распаде мочевины до аммиака и углекислого газа, не реагирует на сходную по строению метилмочевину. Многие ферменты действуют на несколько родственных по структуре соединений или на один тип химической связи (например, расщепляющие фосфодиэфирную связь фермент фосфатазы).
Фермент осуществляет свое действие через образование фермент-субстративного комплекса, который затем распадается с образованием продуктов ферментативной реакции и освобождением фермента. A результате образования фермент-субстратного комплекса субстрат изменяет свою конфигурацию; при этом преобразуемая фермент-химическая связь ослабляется и реакция протекает с меньшей начальной затратой энергии и, следовательно, с намного большей скоростью. Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Многие ферментативные реакции в зависимости от концентрации в среде субстрата и продукта реакции могут протекать как в прямом, так и в обратном направлении (избыток субстрата сдвигает реакцию в сторону образования продукта, в то время как при чрезмерном накоплении последнего будет происходить синтез субстрата). Это означает, что ферментативные реакции могут быть обратимыми. Например, карбоангидраза крови превращает поступающий из тканей углекислый газ в угольную кислоту (H2CO3), а в легких, напротив, катализирует превращение угольной кислоты в воду и углекислый газ, который удаляется при выдохе. Однако следует помнить, что ферменты, как и другие катализаторы, не могут сдвигать термодинамическое равновесие химической реакции, а лишь значительно ускоряют достижение этого равновесия.
Номенклатура названий ферментов
В клетках организма протекает несколько тысяч различных реакций обмена веществ и, следовательно, имеется столько же ферментов. Aля того, чтобы привести такое многообразие в систему, было принято международное соглашение о классификации ферментов. A соответствии с этой системой все ферменты a зависимости от типа катализируемых ими реакций были поделены на шесть основных классов, каждый из которых включает ряд подклассов. Кроме того, каждый фермент получил четырехзначный кодовый номер (шифр) и название, указывающее на реакцию, которую yтот фермент катализирует. Ферменты, катализирующие одну и ту же реакцию у организмов разных видов, могут существенно различаться между собой по своей белковой структуре, но в номенклатуре имеют общее название и один кодовый номер.
Болезни, связанные с нарушением выработки ферментов
Отсутствие или снижение активности какого-либо фермента (нередко и избыточная активность) у человека приводит к развитию заболеваний (энзимопатий) или гибели организма. Так, передаваемое по наследству заболевание детей — галактоземия (приводит к умственной отсталости) — развивается вследствие нарушения синтеза фермента, ответственного за превращение галактозы в легко усваиваемую глюкозу. Причиной другого наследственного заболевания — фенилкетонурии, сопровождающегося расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение аминокислоты фенилаланина в тирозин. Определение активности многих ферментов a крови, моче, спинно-мозговой, семенной и других жидкостях организма используется для диагностики ряда заболеваний. С помощью такого анализа сыворотки крови возможно обнаружение на ранней стадии инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и других заболеваний.
Использование ферментов человеком
Обнаружена способность некоторых форм рибонуклеиновых кислот (рибозимов) катализировать отдельные реакции, то есть выступать в качестве ферментов. Возможно, в ходе эволюции органического мира рибозимы служили биокатализаторами до того, как ферментативная функция перешла к белкам, более приспособленным к выполнению этой задачи.
ФЕРМЕНТЫ, органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и называются катализаторами. Ферменты (от лат. fermentum – брожение, закваска) иногда называют энзимами (от греч. en – внутри, zyme – закваска). Все живые клетки содержат очень большой набор ферментов, от каталитической активности которых зависит функционирование клеток. Практически каждая из множества разнообразных реакций, протекающих в клетке, требует участия специфического фермента. Изучением химических свойств ферментов и катализируемых ими реакций занимается особая, очень важная область биохимии – энзимология.
Многие ферменты находятся в клетке в свободном состоянии, будучи просто растворены в цитоплазме; другие связаны со сложными высокоорганизованными структурами. Есть и ферменты, в норме находящиеся вне клетки; так, ферменты, катализирующие расщепление крахмала и белков, секретируются поджелудочной железой в кишечник. Секретируют ферменты и многие микроорганизмы.
Первые данные о ферментах были получены при изучении процессов брожения и пищеварения. Большой вклад в исследование брожения внес Л.Пастер, однако он полагал, что соответствующие реакции могут осуществлять только живые клетки. В начале 20 в. Э.Бухнер показал, что сбраживание сахарозы с образованием диоксида углерода и этилового спирта может катализироваться бесклеточным дрожжевым экстрактом. Это важное открытие послужило стимулом к выделению и изучению клеточных ферментов. В 1926 Дж.Самнер из Корнеллского университета (США) выделил уреазу; это был первый фермент, полученный в практически чистом виде. С тех пор обнаружено и выделено более 700 ферментов, но в живых организмах их существует гораздо больше. Идентификация, выделение и изучение свойств отдельных ферментов занимают центральное место в современной энзимологии.
Ферменты как белки.
Все ферменты являются белками, простыми или сложными (т.е. содержащими наряду с белковым компонентом небелковую часть).
Ферменты – крупные молекулы, их молекулярные массы лежат в диапазоне от 10 000 до более 1 000 000 дальтон (Да). Для сравнения укажем мол. массы известных веществ: глюкоза – 180, диоксид углерода – 44, аминокислоты – от 75 до 204 Да. Ферменты, катализирующие одинаковые химические реакции, но выделенные из клеток разных типов, различаются по свойствам и составу, однако обычно обладают определенным сходством структуры.
Не все белки, присутствующие в живых организмах, являются ферментами. Так, иную функцию выполняют структурные белки, многие специфические белки крови, белковые гормоны и т.д.
Коферменты и субстраты.
Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами). Роль коферментов играют большинство витаминов и многие минеральные вещества; именно поэтому они должны поступать в организм с пищей. Витамины РР (никотиновая кислота, или ниацин) и рибофлавин, например, входят в состав коферментов, необходимых для функционирования дегидрогеназ. Цинк – кофермент карбоангидразы, фермента, катализирующего высвобождение из крови диоксида углерода, который удаляется из организма вместе с выдыхаемым воздухом. Железо и медь служат компонентами дыхательного фермента цитохромоксидазы.
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента. Этот процесс представляют следующим образом:
Продукт тоже можно считать субстратом, поскольку все ферментативные реакции в той или иной степени обратимы. Правда, обычно равновесие сдвинуто в сторону образования продукта, и обратную реакцию бывает трудно зафиксировать.
Механизм действия ферментов.
Скорость ферментативной реакции зависит от концентрации субстрата [S] и количества присутствующего фермента. Эти величины определяют, сколько молекул фермента соединится с субстратом, и именно от содержания фермент-субстратного комплекса зависит скорость реакции, катализируемой данным ферментом. В большинстве ситуаций, представляющих интерес для биохимиков, концентрация фермента очень мала, а субстрат присутствует в избытке. Кроме того, биохимики исследуют процессы, достигшие стационарного состояния, при котором образование фермент-субстратного комплекса уравновешивается его превращением в продукт. В этих условиях зависимость скорости (v) ферментативного превращения субстрата от его концентрации [S] описывается уравнением Михаэлиса – Ментен:
где KM – константа Михаэлиса, характеризующая активность фермента, V – максимальная скорость реакции при данной суммарной концентрации фермента. Из этого уравнения следует, что при малых [S] скорость реакции возрастает пропорционально концентрации субстрата. Однако при достаточно большом увеличении последней эта пропорциональность исчезает: скорость реакции перестает зависеть от [S] – наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом.
Ферментативные реакции и энергия.
Высвобождение энергии при метаболизме питательных веществ, например при окислении шестиуглеродного сахара глюкозы с образованием диоксида углерода и воды, происходит в результате последовательных согласованных ферментативных реакций. В животных клетках в превращениях глюкозы в пировиноградную кислоту (пируват) или молочную кислоту (лактат) участвуют 10 разных ферментов. Этот процесс называется гликолизом. Первая реакция – фосфорилирование глюкозы – требует участия АТФ. На превращение каждой молекулы глюкозы в две молекулы пировиноградной кислоты расходуются две молекулы АТФ, но при этом на промежуточных этапах из аденозиндифосфата (АДФ) образуются 4 молекулы АТФ, так что весь процесс в целом дает 2 молекулы АТФ.
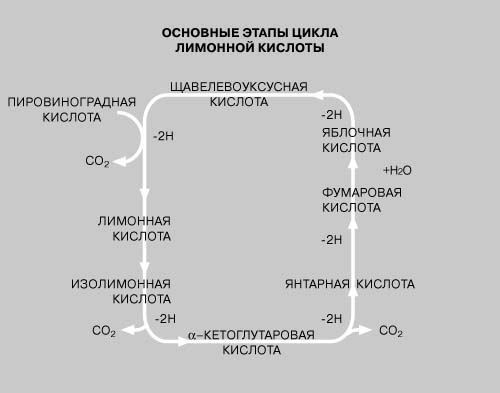
Далее пировиноградная кислота окисляется до диоксида углерода и воды при участии ферментов, ассоциированных с митохондриями. Эти превращения образуют цикл, называемый циклом трикарбоновых кислот, или циклом лимонной кислоты. См. также МЕТАБОЛИЗМ.
Окисление одного вещества всегда сопряжено с восстановлением другого: первое отдает атом водорода, а второе его присоединяет. Катализируют эти процессы дегидрогеназы, обеспечивающие перенос атомов водорода от субстратов к коферментам. В цикле трикарбоновых кислот одни специфические дегидрогеназы окисляют субстраты с образованием восстановленной формы кофермента (никотинамиддинуклеотида, обозначаемого НАД), а другие окисляют восстановленный кофермент (НАДЧН), восстанавливая другие дыхательные ферменты, в том числе цитохромы (железосодержащие гемопротеины), в которых атом железа попеременно то окисляется, то восстанавливается. В конечном итоге восстановленная форма цитохромоксидазы, одного из ключевых железосодержащих ферментов, окисляется кислородом, попадающим в наш организм с вдыхаемым воздухом. Когда происходит горение сахара (окисление кислородом воздуха), входящие в его состав атомы углерода непосредственно взаимодействуют с кислородом, образуя диоксид углерода. В отличие от горения, при окислении сахара в организме кислород окисляет собственно железо цитохромоксидазы, но в конечном итоге его окислительный потенциал используется для полного окисления сахаров в ходе многоступенчатого процесса, опосредуемого ферментами.
На отдельных этапах окисления энергия, заключенная в питательных веществах, высвобождается в основном маленькими порциями и может запасаться в фосфатных связях АТФ. В этом принимают участие замечательные ферменты, которые сопрягают окислительные реакции (дающие энергию) с реакциями образования АТФ (запасающими энергию). Этот процесс сопряжения известен как окислительное фосфорилирование. Не будь сопряженных ферментативных реакций, жизнь в известных нам формах была бы невозможна.
Ферменты выполняют и множество других функций. Они катализируют разнообразные реакции синтеза, включая образование тканевых белков, жиров и углеводов. Для синтеза всего огромного множества химических соединений, обнаруженных в сложных организмах, используются целые ферментные системы. Для этого нужна энергия, и во всех случаях ее источником служат фосфорилированные соединения, такие, как АТФ.
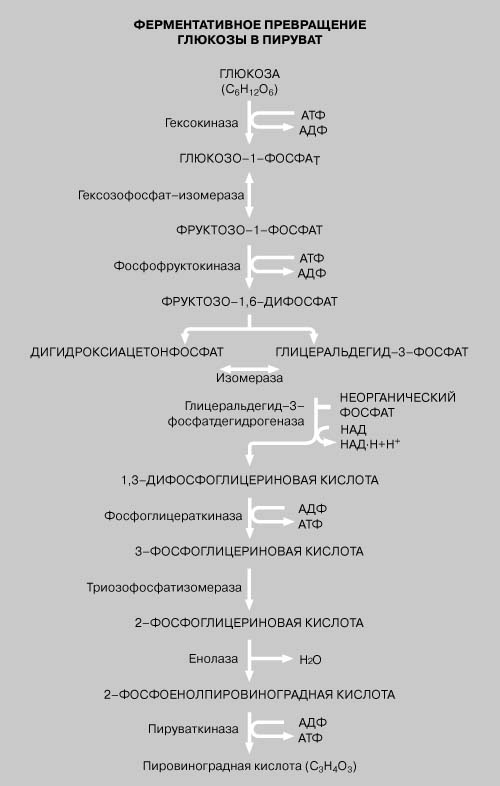
Ферменты и пищеварение.
Ферменты – необходимые участники процесса пищеварения. Только низкомолекулярные соединения могут проходить через стенку кишечника и попадать в кровоток, поэтому компоненты пищи должны быть предварительно расщеплены до небольших молекул. Это происходит в ходе ферментативного гидролиза (расщепления) белков до аминокислот, крахмала до сахаров, жиров до жирных кислот и глицерина. Гидролиз белков катализирует фермент пепсин, содержащийся в желудке. Ряд высокоэффективных пищеварительных ферментов секретирует в кишечник поджелудочная железа. Это трипсин и химотрипсин, гидролизующие белки; липаза, расщепляющая жиры; амилаза, катализирующая расщепление крахмала. Пепсин, трипсин и химотрипсин секретируются в неактивной форме, в виде т.н. зимогенов (проферментов), и переходят в активное состояние только в желудке и кишечнике. Это объясняет, почему указанные ферменты не разрушают клетки поджелудочной железы и желудка. Стенки желудка и кишечника защищает от пищеварительных ферментов и слой слизи. Некоторые важные пищеварительные ферменты секретируются клетками тонкого кишечника.
Большая часть энергии, запасенной в растительной пище, такой, как трава или сено, сосредоточена в целлюлозе, которую расщепляет фермент целлюлаза. В организме травоядных животных этот фермент не синтезируется, и жвачные, например крупный рогатый скот и овцы, могут питаться содержащей целлюлозу пищей только потому, что целлюлазу вырабатывают микроорганизмы, заселяющие первый отдел желудка – рубец. С помощью микроорганизмов происходит переваривание пищи и у термитов.
Ферменты находят применение в пищевой, фармацевтической, химической и текстильной промышленности. В качестве примера можно привести растительный фермент, получаемый из папайи и используемый для размягчения мяса. Ферменты добавляют также в стиральные порошки.
Ферменты в медицине и сельском хозяйстве.
Осознание ключевой роли ферментов во всех клеточных процессах привело к широкому их применению в медицине и сельском хозяйстве. Нормальное функционирование любого растительного и животного организма зависит от эффективной работы ферментов. В основе действия многих токсичных веществ (ядов) лежит их способность ингибировать ферменты; таким же эффектом обладает и ряд лекарственных препаратов. Нередко действие лекарственного препарата или токсичного вещества можно проследить по его избирательному влиянию на работу определенного фермента в организме в целом или в той или иной ткани. Например, мощные фосфорорганические инсектициды и нервно-паралитические газы, разработанные в военных целях, оказывают свой губительный эффект, блокируя работу ферментов – в первую очередь холинэстеразы, играющей важную роль в передаче нервного импульса.
Чтобы лучше понять механизм действия лекарственных препаратов на ферментные системы, полезно рассмотреть, как работают некоторые ингибиторы ферментов. Многие ингибиторы связываются с активным центром фермента – тем самым, с которым взаимодействует субстрат. У таких ингибиторов наиболее важные структурные особенности близки к структурным особенностям субстрата, и если в реакционной среде присутствуют и субстрат и ингибитор, между ними наблюдается конкуренция за связывание с ферментом; при этом чем больше концентрация субстрата, тем успешнее он конкурирует с ингибитором. Ингибиторы другого типа индуцируют в молекуле фермента конформационные изменения, в которые вовлекаются важные в функциональном отношении химические группы. Изучение механизма действия ингибиторов помогает химикам создавать новые лекарственные препараты.
| НЕКОТОРЫЕ ФЕРМЕНТЫ И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ | |||
| Тип химической реакции | Фермент | Источник | Катализируемая реакция 1) |
| Гидролиз | Трипсин | Тонкий кишечник | Белки + H2O ® Разные полипептиды |
| Гидролиз | b-Амилаза | Пшеница, ячмень, батат и т.д. | Крахмал + H2O ® Гидролизат крахмала + Мальтоза |
| Гидролиз | Тромбин | Кровь | Фибриноген + H2O ® Фибрин + 2 Полипептида |
| Гидролиз | Липазы | Кишечник, семена с большимсодержанием жиров,микроорганизмы | Жиры + H2O ® Жирные кислоты + Глицерин |
| Гидролиз | Щелочная фосфатаза | Почти все клетки | Органические фосфаты + H2O ® Дефосфорилированный продукт + Неорганический фосфат |
| Гидролиз | Уреаза | Некоторые растительные клетки и микроорганизмы | Мочевина + H2O ® Аммиак + Диоксид углерода |
| Фосфоролиз | Фосфорилаза | Ткани животных и растений,содержащие полисахариды | Полисахарид (крахмал или гликоген из n молекул глюкозы) + Неорганический фосфат Глюкозо-1-фосфат +Полисахарид (n–1 глюкозных единиц) |
| Декарбоксилирование | Декарбоксилаза | Дрожжи, некоторые растенияи микроорганизмы | Пировиноградная кислота ® Ацетальдегид + Диоксид углерода |
| Конденсация | Альдолаза | Все животные клетки; многиерастения и микроорганизмы | 2 Триозофосфат Гексозодифосфат |
| Конденсация | Оксалоацетат-трансаце-тилаза | То же | Щавелевоуксусная кислота + Ацетил-кофермент А Лимонная кислота + Кофермент А |
| Изомеризация | Фосфогексозоизомераза | То же | Глюкозо-6-фосфат Фруктозо-6-фосфат |
| Гидратация | Фумараза | То же | Фумаровая кислота + H2O Яблочная кислота |
| Гидратация | Карбоангидраза | Разные ткани животных; зеленые листья | Диоксид углерода + H2O Угольная кислота |
| Фосфорилирование | Пируваткиназа | Почти все (или все) клетки | АТФ + Пировиноградная кислота Фосфоенолпировиноградная кислота + АДФ |
| Перенос фосфатной группы | Фосфоглюкомутаза | Все животные клетки; многиерастения и микроорганизмы | Глюкозо-1-фосфат Глюкозо-6- фосфат |
| Переаминирование | Трансаминаза | Большинство клеток | Аспарагиновая кислота + Пировино-градная кислота Щавелевоуксусная кислота + Аланин |
| Синтез, сопряженный сгидролизом АТФ | Глутаминсинтетаза | То же | Глутаминовая кислота + Аммиак + АТФ Глутамин + АДФ + Неорганический фосфат |
| Окисление-восстановление | Цитохромоксидаза | Все животные клетки, многиерастения и микроорганизмы | O2 + Восстановленный цитохром c ® Окисленный цитохром c + H2O |
| Окисление-восстановление | Оксидаза аскорбиновойкислоты | Многие растительные клетки | Аскорбиновая кислота + O2 ® Дегидроаскорбиновая кислота + Пероксид водорода |
| Окисление-восстановление | Цитохром c редуктаза | Все животные клетки; многиерастения и микроорганизмы | НАД·Н (восстановленный кофермент) + Окисленный цитохром c ® Восстановленный цитохром c + НАД (окисленный кофермент) |
| Окисление-восстановление | Лактатдегидрогеназа | Большинство животных кле-ток; некоторые растенияи микроорганизмы | Молочная кислота + НАД (окисленный кофермент) Пировиноградная кислота + НАД·Н (восстановленный кофермент) |
| 1) Одинарная стрелка означает, что реакция идет фактически в одну сторону, а двойные стрелки – что реакция обратима. | |||
Фёршт Э. Структура и механизм действия ферментов. М., 1980
Страйер Л. Биохимия, т. 1 (с. 104–131), т. 2 (с. 23–94). М., 1984–1985
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека, т. 1. М., 1993
Читайте также:

