Строение органических веществ сообщение
Обновлено: 04.07.2024
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Этот порядок может быть отображен при помощи структурных формул, в которых валентности атомов обозначаются черточками: одна черточка соответствует единице валентности атома химического элемента. Например, для органического вещества метана, имеющего молекулярную формулу $СН_4$, структурная формула выглядит так:

Основные положения теории А. М. Бутлерова
- Атомы в молекулах органических веществ связаны друг с другом согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
- Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества.
- Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
- В состав всех органических веществ входят углерод и водород, поэтому при горении они образуют углекислый газ и воду.
- Органические вещества построены сложно и могут иметь огромную молекулярную массу (белки, жиры, углеводы).
- Органические вещества можно расположить в ряды сходных по составу, строению и свойствам гомологов.
- Для органических веществ характерной является изомерия.
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.

Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле $С_4Н_$ соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода $С_5Н_$ возможны три изомера: пентан, изопентан и неопентан:

С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода $С_Н_$ их уже $75$, а для углеводорода $С_Н_$ — $366 319$.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:

Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих к разным классам. Так, молекулярной формуле $С_6Н_$ соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан:

Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу $С_4Н_О$:
Структурными изомерами являются аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле $С_2Н_5NO_2$:

Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:

Геометрические изомеры различаются по физическим и химическим свойствам.
Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. Примером такой молекулы является молекула $α$-аминопропионовой кислоты ($α$-аланина) $СН_3СН(NH_2)COOH$.
Молекула $α$-аланина ни при каком перемещении не может совпасть со своим зеркальным отражением. Такие пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. Все физические и практически все химические свойства таких изомеров идентичны.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность $CH_2$. Например: $CH_4$ — метан, $C_2H_6$ — этан, $C_3H_8$ — пропан, $C_4H_$ — бутан и т. д.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
В органических соединениях углерод всегда четырехвалентен. В возбужденном состоянии в его атоме происходит разрыв пары $2s^3$-электронов и переход одного из них на р-орбиталь:

Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
На основании приведенной электронной формулы валентного уровня атома углерода можно было бы ожидать, что на нем находится один $s$-электрон (сферическая симметричная орбиталь) и три $р$-электрона, имеющих взаимно перпендикулярные орбитали ($2р_х, 2р_у, 2p_z$-орбиталь). В действительности же все четыре валентных электрона атома углерода полностью эквивалентны и углы между их орбиталями равны $109°28'$. Кроме того, расчеты показывают, что каждая из четырех химических связей углерода в молекуле метана ($СН_4$) на $25%$ является $s-$ и на $75%$ — $p$-связью, т.е. происходит смешивание $s-$ и $р-$состояний электронов. Это явление называют гибридизацией, а смешанные орбитали — гибридными.
Атом углерода в $sp^3$-валентном состоянии имеет четыре орбитали, на каждой из которых находится по одному электрону. В соответствии с теорией ковалентной связи он имеет возможность образовывать четыре ковалентные связи с атомами любых одновалентных элементов ($СН_4, CHCl_3, CCl_4$) или с другими атомами углерода. Такие связи называются $σ$-связями. Если атом углерода имеет одну $С—С$ связь, то он называется первичным ($Н_3С—СН_3$), если две — вторичным ($Н_3С—СН_2—СН_3$), если три — третичным (), а если четыре — четвертичным ().
Одной из характерных особенностей атомов углерода является их способность образовывать химические связи за счет обобщения только $р$-электронов. Такие связи называются $π$-связями. $π$-связи в молекулах органических соединений образуются только в присутствии $σ$-связей между атомами. Так, в молекуле этилена $Н_2С=СН_2$ атомы углерода связаны $σ-$ и одной $π$-связью, в молекуле ацетилена $НС=СН$ — одной $σ-$ и двумя $π$-связями. Химические связи, образовавшиеся с участием $π$-связей, называются кратными (в молекуле этилена — двойная, в молекуле ацетилена — тройная), а соединения с кратными связями — ненасыщенными.
Явление $sp^3$-, $sp^2$- и $sp$ - гибридизации атома углерода.
При образовании $π$-связей изменяется гибридное состояние атомных орбиталей атома углерода. Так как образование $π$-связей происходит за счет р-электронов, то в молекулах с двойной связью электроны будут иметь $sp^2$-гибридизацию (была $sp^3$, но один р-электрон отходит на $π$-орбиталь), а с тройной — $sp$-гибридизацию (два р-электрона отошли на $π$-орбиталь). Характер гибридизации изменяет направленность $σ$-связей. Если при $sp^3$-гибридизации они образовывают пространственно разветвленные структуры ($а$), то при $sp^2$-гибридизации все атомы лежат в одной плоскости и углы между $σ$-связями равны $120°$(б), а при $sp$-гибридизации молекула линейна (в):

При этом оси $π$-орбиталей перпендикулярны оси $σ$-связи.

Как $σ$-, так и $π$-связи являются ковалентными, значит, должны характеризоваться длиной, энергией, пространственной направленностью и полярностью.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5'$ | $0.154$ | $369$ |
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
Радикал. Функциональная группа.

Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (), нитрогруппа (—$NO_2$) и т. д. являются функциональными группами спиртов, альдегидов и азотсодержащих соединений соответственно.
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.

Поведение частиц в соединениях зависит от множества факторов. Теория строений органических соединений как раз изучает поведение молекулы в соединениях, природу атомов, валентность, порядок и характер химических связей. В данной статье сформулированы кратко основные положения этой теории.
Строение органических соединений
Многообразие органических соединений объясняются особенностью их химического строения. Атомы в молекуле расположены в определенном порядке в соответствии с их валентностью. Эта последовательность и является химическим строением.
Вещества, имеющие один и тот же качественный и количественный состав (молекулярную формулу), но разное строение, называются изомерами, а само их существование – изомерией. Известный русский химик А. М. Бутлеров доказал, что с помощью управляемых реакций можно получить новые вещества.
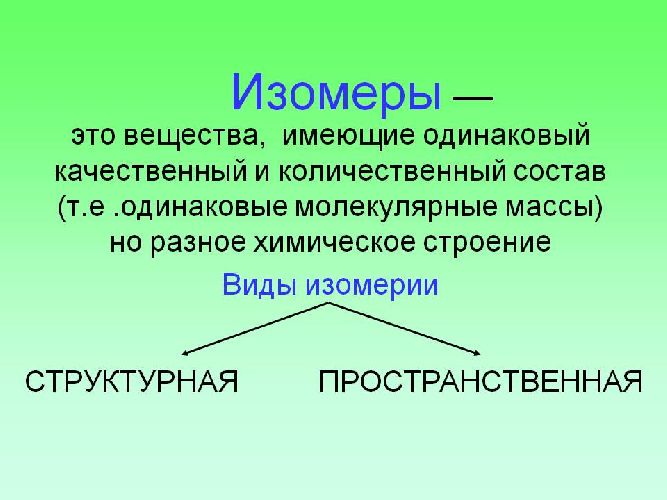
Рис. 1. Изомерия определение.
Также важным является положение о том, что атомы и группы атомов в молекуле взаимно влияют друг на друга.
Теория строений органических веществ
Теория строения органических соединений была сформулирована русским химиком А. М. Бутлеровым в 1861 году. Главным выводом этой научной работы стало утверждение, что каждом веществу соответствует только одна формула. Этот труд показывает поведение атомов внутри молекул.

Рис. 2. А. М. Бутлеров.
Основные положения и следствия теории строения Бутлерова могут быть сформулированы следующим образом:
- В молекулах атомы расположены не хаотично, а имеют определенную структуру.
Схематическое изображение строения молекулы называется структурной формулой

Рис. 3. Структурная формула молекулы.
Основываясь на положении о валентности атома углерода, равной четырем, и его способности образовывать цепи и циклы, строят структурные формулы органических веществ.
- Химические свойства вещества зависят от состава и порядка расположения атомов и молекул.
- Различное строение при одном и том же составе и молекулярной массе вещества обуславливает явление изомерии. Абсолютные разные химические элементы могут иметь одинаковый состав и молекулярную массу, все зависит от расположения мельчайших частиц и связей между ними.
- По свойствам вещества можно определить строение молекулы, а по ее строению можно предсказать свойства
- Так как при отдельных реакциях изменяются не все, а только некоторые части молекул, то, изучая продукты химических превращений соединения, можно установить его строение.
- Реакционная способность атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Связанные между собой атомы влияют друг на друга с большей силой, чем несвязанные.
Что мы узнали?
Значение теории химических строений органических соединений Бутлерова велико. Его теория не только объясняет строение молекул всех известных органических веществ и их свойства, но и дает возможность теоретически предвидеть существование неизвестных и новых веществ, а также найти способ их получения и синтеза.
Определение органических веществ записано в учебнике химии, но не каждый может его дословно воспроизвести. А зря, ведь органические вещества составляют большинство из известных веществ в природе. На сегодняшний день таких соединений наука насчитывает свыше 20 миллионов.
Имеются в виду не только образующие биологические организмы (в клетке их около трети по массе). Целые государства существуют за счет продажи продуктов предположительно органического происхождения (нефть, природный газ). Последние во многом определяют энергетическую составляющую мирового производства. Плюс залежи каменного угля.
Огромно значение данные вещества имеют в химической индустрии. Например, без кокса невозможна выплавка ферроуглеродных сплавов.
Что такое органические вещества
Это все углеродосодержащие соединения. Примеры и характеристика органических веществ приведены ниже.

соли угольной кислоты;
образует цепи, в том числе замкнутые;
поддерживает одинарные и больше связи;
прочно связывается с большинством элементов;
обладает способностью синтезировать изомеры. Соединения с изменчивой топологией. То есть идентичные по составу и массе молекулы, отличные в структуре;
гомология – добавление группы CH2.

Классификация органических веществ
Разделяют по особенностям углеродной цепи и функциональным группам. Ниже дано описание и приведены структурные формулы органических веществ по классам.
По углеродному скелету

Под ациклическими и циклическими понимают незамкнутую или замкнутую углеродную связь соответственно.

Как видно, представители могут иметь разветвленное строение. Имеет значение количество взаимосвязей углеродной основы. Включают спирты, кетоны, кислоты и подобные.
Из интересных веществ – ацетон, метанол, искусственное топливо (бензин), уксусная кислота.

В карбоциклическом кольце не попадаются чужеродные атомы. Только углерод. Из представителей получают пигменты (окрашивающие препараты), синтезируют смолы и пластики.

В гетероциклических кольцах имеют место вкрапления кислорода, азота, серы и не только. Применяют для производства красителей, лекарственных препаратов, пластиков.
По группам
Органические вещества или углеводороды, как следует из термина, содержат исключительно C и H. Разнообразие вносят функциональные группы с отличными атомами.

Спирты подразделяют на одно- и многоатомные. В зависимости от числа групп –OH. В фенолах группа присоединена к ароматическому кольцу.

Одноатомные спирты используют для пищевой и химической промышленности.

Этиленгликоль применяют для получения искусственных волокон и незамерзающих жидкостей (антифризов).
Глицерин – для лекарственных средств, парфюмерии, легкой промышленности и взрывчатых веществ.
Фенолы аналогично подразделяют на одно-, двух- и многоатомные. Собственно, фенол, типичный представитель, важен в синтезе смол, а как антисептик используется в медицинской отрасли.
Альдегиды и кетоны используют как сырье для синтеза смол, полимеров, медикаментов, дезинфицирующих препаратов, консервантов. Высшие – для одеколонов и духов. Ацетон – универсальный растворитель.

Карбоновые кислоты классифицируются по числу карбоксильных групп. Применяются в легкой и пищевой промышленности (добавки), в парфюмерии, для органического синтеза.

Нитросоединения, содержащие азот органику — являются потенциально взрывчатыми веществами. А отдельные – не потенциально. Для чего нужны и так понятно. Пример – тринитротолуол. Он же тротил.


Амины – органоаммиачные соединения. Большинство ядовито, некоторые канцерогенны. Характерный представитель – анилин. Участвуют в изготовлении смол, пигментов, клеящих средств, искусственных волокон. Также нужны для изготовления пестицидов, гербицидов, удобрений, медицинских препаратов (уротропин).

Галогенопроизводные, содержащие хлор (фреоны), ранее использовались в качестве хладагента в морозильном оборудовании. Но из-за вреда озоновому слою не рекомендуются.
Химикаты в индустрии являются растворителями, сырьем для инсектицидов и т. п. Жутковатый представитель семейства, синильная кислота – не только ингредиент боевых отравляющих веществ. Без нее затруднительна добыча драгоценных металлов и покрытие ими поверхностей.

Органика биологического происхождения
То, из чего состоят все организмы. От высших животных до микроводорослей.
Белки
Объединенные пептидной связью α-аминокислоты.

Посмотрим, какими свойствами они обладают, и какие функции выполняют:
обеспечивают рост клеток;
составляют энзимы и отдельные гормоны;
поддерживают наличие антител для иммунитета, свертываемость крови;
отвечают за перемещение необходимых для жизнедеятельности веществ;
белки-ферменты ускоряют биохимические взаимодействия.
Часть поставляется с пищей, остальные производится организмом.
Липиды
Делят на простые (жирные кислоты + глицерин) и сложные (с высокомолекулярными кислотами).

Характеристика:
действующие и резервируемое питание (1 г – 39 кДж);
поддерживают рост клеточных перегородок;
участвуют в гормональной регуляции;
при окислении выделяют воду;
растворяя, переводят витамины в усваиваемую форму.
Углеводы
Простые и сложные сахара.


Кратко охарактеризуем:
основное питание клетки (1 г – 18 кДж);
материал оболочки клетки;
некоторые не позволяют крови свертываться в сосудах.
Человек состоит из органических веществ и окружен ими. Скорее можно перечислить неорганических соседей: стекло, металл да керамика.
Даже электроника постепенно переходит на органику. Без нее немыслимы сельское хозяйство, фармацевтика. Великая наука – органическая химия.
Органическая химия – это химия углеводородов и их производных.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н. Например: СН4, С2Н6, С6Н6 и т.д.


Это учение просуществовало недолго, потому что уже в начале и середине XIX в. были синтезированы многие органические вещества:
1828 г. – Велер синтезирует мочевину CO(NH2)2, которая является одним из продуктов, образующихся в организме;
1850-е гг. – Бертло синтезирует жиры;
1861 г. – Бутлеров синтезировал один из углеводов.
Сейчас известно более 10 млн органических веществ; многие из них не существуют в природе, а получены в лаборатории. Промышленный синтез различных органических веществ является одним из основных направлений химической промышленности.
Кроме С и Н, в состав многих органических веществ входят следующие элементы: O, N, S, P, Cl, Br и др.
Принципиального различия между органическими и неорганическими веществами нет. Однако типичные органические вещества имеют ряд свойств, которые отличают их от типичных неорганических веществ. Это объясняется различием в характере химической связи:

Основные положения теории химического строения органических соединений
Эту теорию разработал русский ученый А.М. Бутлеров (1858 – 1861).
I положение. Атомы в молекулах органических веществ соединяются друг с другом в определенной последовательности согласно их валентности.
Последовательность соединения атомов в молекуле называется химическим строением (структурой).

В органических соединениях атомы углерода могут соединяться друг с другом, образуя цепи (углеродный скелет). В зависимости от наличия тех или иных атомов углерода цепи бывают:
а) прямые (неразветвленные) – содержат два первичных атома углерода (крайние в цепи), остальные атомы – вторичные; например:

б) разветвленные – содержат хотя бы один третичный или хотя бы один четвертичный атом углерода; например:
в) замкнутые (циклы) – не содержат первичных атомов углерода; например:
II положение. Свойства веществ зависят не только от состава, но и от строения их молекул.
Например, существуют 2 различных вещества, которые имеют одинаковый состав, выражаемый эмпирической формулой С2Н6О:

Изомеры – это вещества, которые имеют одинаковый состав, но разное строение молекул и различные свойства.
Изомерия – явление существования изомеров.
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает; например:
Типы изомерии
1. Структурная изомерия

2. Пространственная изомерия (геометрическая изомерия, цис-транс-изомерия)

Порядок соединения атомов в этих изомерах одинаковый, но расположение атомов в пространстве различно.
3. Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических соединений:

III положение. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
В бензольном ядре замещается один атом водорода.
При наличии группы – ОН в бензольном ядре замещаются три атома водорода.
С другой стороны, углеводородный радикал влияет на подвижность атома водорода в ОН-группе:
Если группа – ОН связана с бензольным кольцом, атом водорода в ней является подвижным и может замещаться на атом металла при взаимодействии со щелочью.
Если группа – ОН связана с алкильным радикалом, подвижность атома водорода в ней невелика, и он не может замещаться на металл при действии щелочи.
Гомологический ряд. Гомологи
Гомологический ряд – это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу СН2. Сходные по химическим свойствам соединения, образующие гомологический ряд, называются гомологами. Группа СН2 называется гомологической разностью.
Состав всех членов гомологического ряда может быть выражен общей формулой.
Классификация органических веществ
Большинство органических соединений можно представить формулой: R – X, где R – углеводородный радикал; Х – функциональная группа.

Функциональные группы – это группы атомов, которые определяют наиболее характерные химические свойства органических соединений. Углеводородные радикалы – остатки УВ, связанные с функциональными группами.
1. Классификация органических веществ по строению углеводородного радикала (R)

2. Классификация органических веществ по функциональным группам (Х)
Читайте также:

