Сообщение производство серной кислоты 9 класс кратко
Обновлено: 05.07.2024
Ключевые слова конспекта: соединения серы, серная кислота, участие в кислотно-основных и окислительно-восстановительных взаимодействиях, получение и применение серной кислоты.

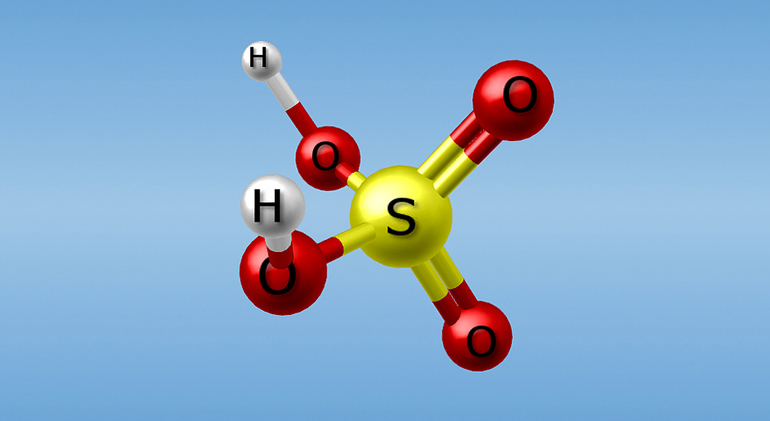
Серная кислота H2SO4 – вещество молекулярного строения. Её графическая формула:
В серной кислоте сера находится в высшей степени окисления +6.
Серная кислота представляет собой бесцветную маслянистую жидкость, хорошо растворимую в воде. Смешивается с водой в неограниченном количестве и очень гигроскопична. При растворении верной кислоты в воде выделяется значительное количество теплоты.
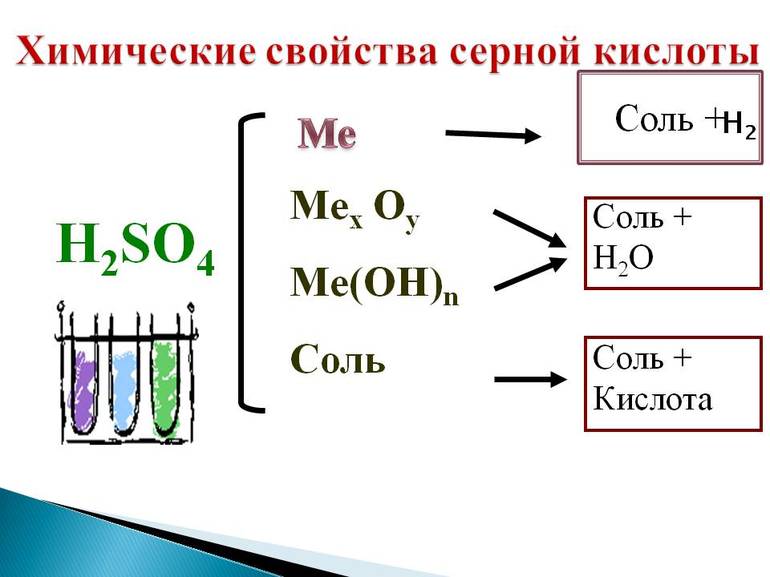
Химические свойства серной кислоты можно рассмотреть с точки зрения кислотно-основных и окислительно-восстановительных взаимодействий.
Участие в кислотно-основных взаимодействиях
- Серная кислота – сильный электролит, в водных растворах диссоциирует практически полностью:

Изменяет окраску индикатора (например, лакмуса с фиолетовой на красную).
Более корректно электролитическая диссоциация H2SO4 описывается уравнениями:

- Серная кислота реагирует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
2Н + + CuO = Cu 2+ + H2O
- Серная кислoта реагирует с основаниями и амфотерными гидроксидами:
H2SO4 + Cu(OH)2 = CuSO4 + 2H20
2Н + + Cu(OH)2 = Cu 2+ + 2H20
- Сернaя кислота вытесняет более слабые кислоты из их солей:

- Сeрная кислота вытесняет и сильные, но летучие кислоты из их солей:

Участие в окислительно-восстановительных взаимодействиях

Разбавленные растворы H2SO4 реагируют с металлами, расположенными в электрохимическом ряду напряжений металлов до H2, с образованием сульфатов и выделением водорода:
Чистая H2SO4 и H2SO4 в концентрированных растворах проявляют сильные окислительные свойства за счёт S +6 .
Концентрированная H2SO4 взаимодействует с металлами (в том числе с Cu, Ag, Hg), стоящими после H2 в ряду напряжений металлов, с образованием сульфатов, воды и продуктов восстановления S +6 : H2S, S, SO2. Концентрированная серная кислота не реагирует с благородными металлами вследствие их малой активности, а также с Al, Cr, Fe из-за пассивации. На поверхности этих металлов образуется защитная оксидная плёнка, защищающая их от дальнейшего окисления.

Глубина восстановления зависит от восстановительных свойств металлов.
Активные металлы восстанавливают H2SO4 до H2S:

Металлы с меньшей активностью восстанавливают H2SO4 до SO2:

Концентрированная сeрная кислoта окисляет и некоторые неметаллы. Например:

Важной химической особенностью серной кислоты является её способность выступать в качестве дегидратирующего реагента. Концентрированная серная кислота вступает в реакции дегидратации со многими органическими веществами, отщепляя от них молекулы воды. Например:
Получение и применение серной кислоты
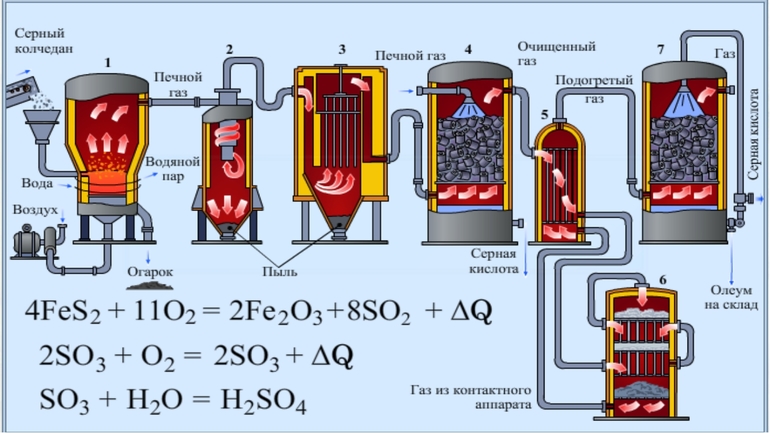
Промышленное получение серной кислоты включает несколько стадий. Сырьём является сера S и сульфидные руды (в основном пирит FeS2).
В ходе получения серной кислоты из пирита осуществляются три химические реакции:
- Обжиг пирита (проводится при температуре около 800 °С):

Эта реакция – обратимая, экзотермическая, каталитическая (её проводят в присутствии катализатора V2O5 при температуре около 450 °С).
Оксид серы (VI) (серный ангидрид) SO3 при обычных условиях – летучая жидкость (t°кип. = 44,8 °С), неограниченно растворяется в воде. Оксид серы (VI) SO3 – кислотный оксид, ему соответствует сильная серная кислота.
В промышленности для этой реакции используют концентрированную H2SO4, образуется олеум H2SO4 • SO3, при разбавлении которого получают концентрированную H2SO4.
Серная кислота – один из важнейших продуктов химической промышленности. Важнейшие области её применения: производство минеральных удобрений, других кислот и солей, красителей, пластмасс, волокон, лекарственных веществ, очистка нефтепродуктов, металлургия.
Трудно переоценить роль этой едкой жидкости в жизни современного общества. Химические свойства серной кислоты позволили ей занять особую нишу в промышленности и сельском хозяйстве. Очистка продуктов перегонки нефти, травление металлов, производства пластмасс, мыла и красителей используют её в огромных объёмах. А ещё это электролит свинцовых аккумуляторов, реагент обработки кожи и нанесения покрытий, компонент удобрений и взрывчатых веществ.
Формула и физические свойства

Способы промышленного производства
- Получение оксида серы (II), сернистого газа, путём сжигания серосодержащего сырья или его обжига в кислороде.
- Очистка газообразной фазы реагентов от твёрдых примесей.
- Окисление до оксида серы (III). Процесс описывается уравнением: 2SO2 + O2 = 2SO3.
- Поглощение водой: H2O + SO3 = H2SO4.
В общем объёме минеральных кислот, которые производятся сегодня химической промышленностью, H2SO4 занимает почётное первое место. При этом она является наиболее дешёвой, технологичной и не разрушает чёрные металлы в концентрированном состоянии.
Камерный метод получения
В эпоху средневековья алхимики синтезировали купоросное масло т. н. камерным способом. Для этого использовались специальные большие, размером с целую комнату, камеры, обложенные изнутри свинцом. Поверхности стенок в результате окисления покрывались защитным слоем сульфата свинца. При горении в присутствии воздуха смеси, состоящей из серы и калиевой селитры, образовывался твёрдый остаток оксидов азота и солей калия и выделялся газообразный оксид серы (III).
Он поглощался водой, имевшейся в камере, и позволял получить продукт малой крепости, которая требовала дальнейшей концентрации. После открытия каталитических свойств оксидов азота, камерный метод уступил место менее трудоёмким и более эффективным технологиям производства.
Современные способы синтеза
- контактная, использующая твёрдые катализаторы;
- башенная (нитрозная), где катализаторами служат газообразные оксиды азота, а окислителем выступает кислород.
При контактном способе смесь реагентов пропускается сквозь твёрдый катализатор, расположенный слоями для увеличения поверхности. Нитрозный метод подразумевает орошение сырья водой или разбавленной кислотой в башенных реакторах. Первый способ более производителен и компактен, позволяет получать продукт большей чистоты при меньших затратах и постепенно вытесняет нитрозного конкурента.

Ускорителей процесса окисления было открыто немало. Наибольший эффект проявляют платина, оксиды ванадия V2O5 и железа Fe2O3. Но первая стоит дорого и быстро отравляется примесями мышьяка, содержащимися в газовой фазе SO2. Для поддержания каталитической активности оксида железа необходимы температуры свыше 600 °C. Наиболее экономичным признан ванадиевый катализатор — он и применяется в производстве.
При улавливании SO3 водой выделяется много тепла, и продукт закипает с образованием аэрозоля. Поэтому используется 100% концентрированная кислота, и получается олеум, который затем разбавляется до необходимых пропорций.
Химические свойства продукта
Серная кислота занимает привилегированное положение среди наиболее сильных минеральных кислот. Такую активность легко охарактеризовать высокой полярностью молекулярной связи водород — кислород, и, соответственно, лёгкостью её разрыва. Это придаёт H2SO4 не только ряд общих для всех соединений её класса свойств, например, взаимодействие кислот с металлами, но и специфические качества. Среди основных химических свойств стоит отметить:
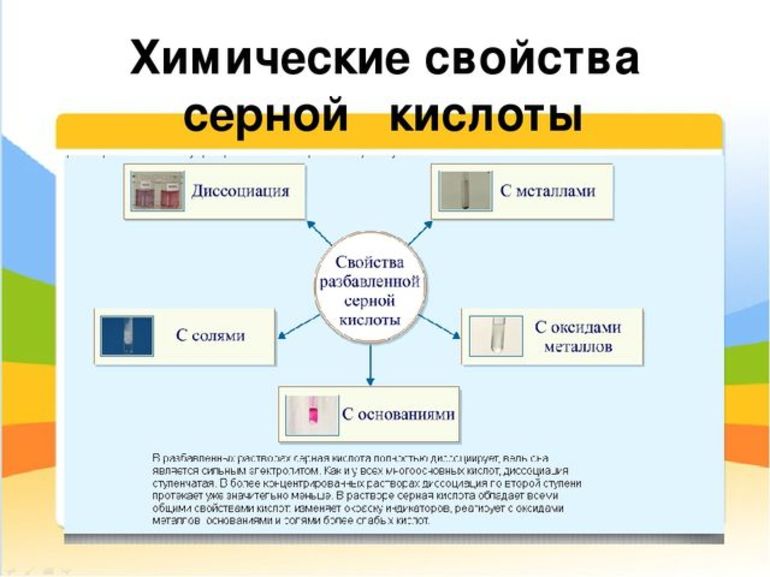
- Действие на индикаторы. Кислая среда водных растворов изменяет окраску фиолетового лакмуса, метилового оранжевого и универсального индикатора — они приобретают красный цвет.
- Реакция диссоциации. В водном растворе проявляются свойства сильного электролита, и в результате двухступенчатой диссоциации соединение распадается на два однозарядных положительных иона водорода и сульфат-ион с двойным отрицательным зарядом.
- Взаимодействие с металлами. Разбавленная серная кислота может реагировать с металлами, которые стоят в электрохимическом ряду активности левее водорода. При этом образуется сернокислая соль, которая называется сульфатом, и водород. Сульфаты не имеют цвета, хорошо растворимы в воде и легко кристаллизуются.
- Реакция нейтрализации. В результате взаимодействия с растворимыми и нерастворимыми основаниями образуется сульфатная соль и вода. Молекула H2SO4 имеет два атома водорода, поэтому кислота — двухосновная, и для полной нейтрализации требуется две молекулы основания.
- Взаимодействие с основными оксидами. Соединения с кислородом одно- и двухвалентных металлов (MgO, FeO, Li2O, Na2O) тоже участвуют в реакции нейтрализации. При этом образуется сульфат металла из состава оксида и вода.
- Обменные реакции с солями более слабых или легколетучих кислот. Происходит вытеснение и в результате образуется сульфатная соль и кислота (или выделяется летучий газ, а вода остаётся в растворе). Выпадение белого нерастворимого осадка BaSO4 — это качественная реакция на сульфат-ионы.
Специфические свойства концентрированных растворов обусловлены структурными особенностями формулы серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной, четвёртой степени окисления. Поэтому он может только принимать электроны и сообщать соединению высокие окислительные свойства. Стоит отметить некоторые из них:
- Окисление большинства металлов, в т. ч. пассивных (цинк и медь). В этих реакциях водород уже не выделяется, а H2SO4 восстанавливается до сероводорода, серы или оксида серы (II). Это определяется концентрацией исходных компонентов и местом, которое занимает метал в электрохимическом ряду активности. Исключение составляют золото, железо, алюминий и платиноиды, поэтому для перевозки автомобильным и железнодорожным транспортом используют стальные цистерны.
- Окисление многих неметаллов. В результате реакции неметалл образует соединение с максимальным окислительным числом, а H2SO4 восстанавливается до оксида серы (IV).
- Окисление сложных соединений. При обработке калиевых солей галогеноводородных кислот (KBr или KI) образуется сульфатная соль и выделяется свободный галоген. Хлорид-ионы не окисляются до хлора и позволяют получать соляную кислоту реакцией обмена.
- Дегидратация органических веществ. Химически связанная вода легко удаляется из гидроксильных групп в присутствии концентрированной H2SO4: из этилового спирта образуется этилен. Обугливание углеводов тоже объясняется обезвоживанием.
Интересно, что в природе эта едкая кислота встречается в чистом 100%-м виде: на итальянском острове Сицилия существует уникальное Озеро смерти, к которому не приближаются даже насекомые и птицы. В этих местах дисульфид железа из земной коры выступает сырьём для синтеза H2SO4, и продукт сочится прямо из дна! Действующие вулканы тоже вносят вклад — извергают в земную атмосферу сернокислотные выбросы, которые причиняют непоправимый вред окружающей среде и становятся причиной серьёзных климатических изменений.
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
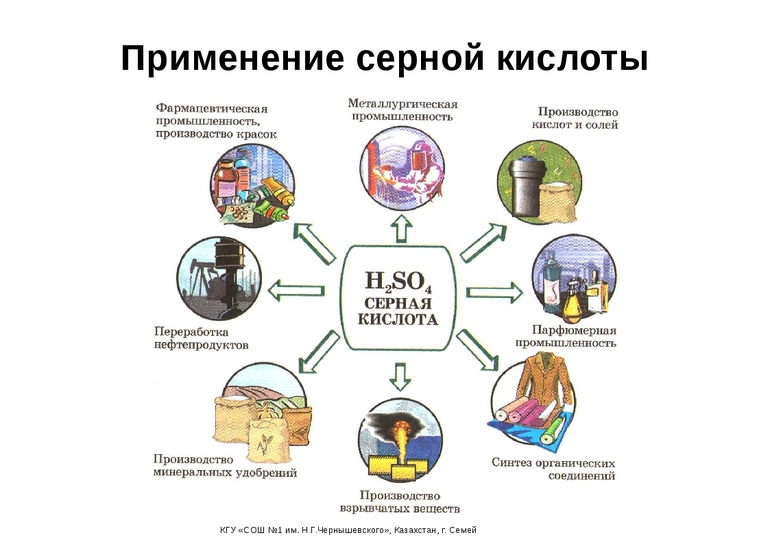
- добыча редких элементов (очистка урановых, иридиевых, циркониевых и осмиевых руд);
- производство минеральных удобрений, высокомолекулярных нитей, красок и пиротехники;
- неорганический синтез солей и кислот;
- текстильная и кожевенная отрасли;
- нефтехимия и металлообработка;
- пищевая промышленность (добавка-эмульгатор E513);
- автомобилестроение (электролит в аккумуляторах);
- дистиллирование воды (реагент для восстановления смол в фильтрах).
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.

При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.

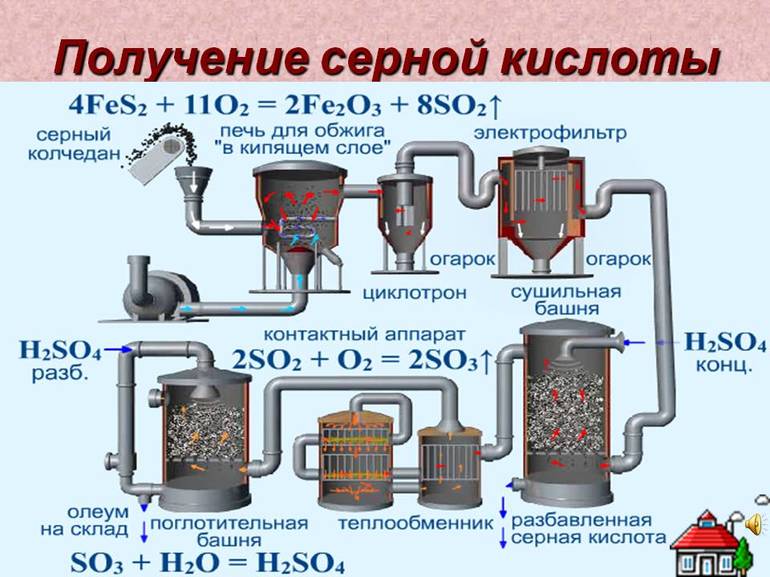
Сырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железа, кальция и др.
Основные этапы
Основные стадии получения серной кислоты:
В промышленности применяют два метода окисления SO2 в производстве серной кислоты: контактный — с использованием твердых катализаторов (контактов), и нитрозный (башенный) — с оксидами азота. Контактный способ вытесняет нитрозный.
Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия (V).
При реакции SO3 с водой выделяется огромное количество теплоты, и серная кислота начинает закипать с образованием "туманов" SO3 + H2O = H2SO4 + Q. Поэтому SO3 смешивается с H2SO4, образуя раствор SO3 в 91% H2SO4 - олеум
Получение серной кислоты (т.н. купоросное масло) из железного купороса - термическое разложение сульфата железа (II) с последующим охлаждением смеси
См. также
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Производство серной кислоты" в других словарях:
Случаи утечки аммиака и серной кислоты в 2008 -2010 гг — 22 ноября незначительный выброс аммиака произошел на севере Москвы на территории хладокомбината №7, расположенного по адресу: Ленинградское шоссе, дом 69. Автоматическая защита перекрыла подачу аммиака. Никто не пострадал. Это не первый случай… … Энциклопедия ньюсмейкеров
Камерное производство — (тех.) представляет обыкновенный способ заводского получения серной кислоты Н2SO4 [О других способах образования, составе, физических и химических свойствах и о способах получения одноводной (Н2SO4), дымящей и безводной (SO3) серной кислоты см.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сало производство* — (технич. и торгов.). Салотопенное производство. При нагревании сырого С. до 35° 40°, жир, заключенный в клеточки, плавится, но еще не вытекает из клеточек, так как стенки их выдерживают давление расширяющегося при нагревании жира. Только при темп … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сало, производство — (технич. и торгов.). Салотопенное производство. При нагревании сырого С. до 35° 40°, жир, заключенный в клеточки, плавится, но еще не вытекает из клеточек, так как стенки их выдерживают давление расширяющегося при нагревании жира. Только при темп … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Стеклянное производство — Заводское производство стекла в России начинается при царе Михаиле Феодоровиче (1635). Стеклоделие, упавшее было на первых порах по возникновении, начинает снова развиваться заботами Петра Великого в начале XVIII стол. С этого времени… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Стеклянное производство* — Заводское производство стекла в России начинается при царе Михаиле Феодоровиче (1635). Стеклоделие, упавшее было на первых порах по возникновении, начинает снова развиваться заботами Петра Великого в начале XVIII стол. С этого времени… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Свечи и производство их — Исторический очерк. Светильня. Окраска С. С. сальные. С. стеариновые. С. восковые. С. парафиновые и спермацетовые. С. впервые появились во времена первых гонений на христиан, и с этого времени римляне употребляли их при всех церковных церемониях … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Свечи и производство их* — Исторический очерк. Светильня. Окраска С. С. сальные. С. стеариновые. С. восковые. С. парафиновые и спермацетовые. С. впервые появились во времена первых гонений на христиан, и с этого времени римляне употребляли их при всех церковных церемониях … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сульфоновые кислоты — или сульфокислоты (жирного ряда) С. кислотами называются производные серной кисл. OH SO2 OH, получающиеся через замену одного из гидроксилов ее углеводородными остатками, напр. CH8 SO2 OH. Так происходят одноосновные С. кислоты. При замещении… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кожевенное производство — Кожа животных или шкура в присутствии влажности легко загнивает, высушенная делается твердой и хрупкой, при обработке горячей водой превращается в клей. К. производство имеет целью превращение сырых шкур в обработанную кожу, которая не должна… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона

Сырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железа, кальция и др.
Основные этапы
Основные стадии получения серной кислоты:
В промышленности применяют два метода окисления SO2 в производстве серной кислоты: контактный — с использованием твердых катализаторов (контактов), и нитрозный (башенный) — с оксидами азота. Контактный способ вытесняет нитрозный.
Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия (V).
При реакции SO3 с водой выделяется огромное количество теплоты, и серная кислота начинает закипать с образованием "туманов" SO3 + H2O = H2SO4 + Q. Поэтому SO3 смешивается с H2SO4, образуя раствор SO3 в 91% H2SO4 - олеум
Получение серной кислоты (т.н. купоросное масло) из железного купороса - термическое разложение сульфата железа (II) с последующим охлаждением смеси
См. также
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Производство серной кислоты" в других словарях:
Случаи утечки аммиака и серной кислоты в 2008 -2010 гг — 22 ноября незначительный выброс аммиака произошел на севере Москвы на территории хладокомбината №7, расположенного по адресу: Ленинградское шоссе, дом 69. Автоматическая защита перекрыла подачу аммиака. Никто не пострадал. Это не первый случай… … Энциклопедия ньюсмейкеров
Камерное производство — (тех.) представляет обыкновенный способ заводского получения серной кислоты Н2SO4 [О других способах образования, составе, физических и химических свойствах и о способах получения одноводной (Н2SO4), дымящей и безводной (SO3) серной кислоты см.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сало производство* — (технич. и торгов.). Салотопенное производство. При нагревании сырого С. до 35° 40°, жир, заключенный в клеточки, плавится, но еще не вытекает из клеточек, так как стенки их выдерживают давление расширяющегося при нагревании жира. Только при темп … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сало, производство — (технич. и торгов.). Салотопенное производство. При нагревании сырого С. до 35° 40°, жир, заключенный в клеточки, плавится, но еще не вытекает из клеточек, так как стенки их выдерживают давление расширяющегося при нагревании жира. Только при темп … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Стеклянное производство — Заводское производство стекла в России начинается при царе Михаиле Феодоровиче (1635). Стеклоделие, упавшее было на первых порах по возникновении, начинает снова развиваться заботами Петра Великого в начале XVIII стол. С этого времени… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Стеклянное производство* — Заводское производство стекла в России начинается при царе Михаиле Феодоровиче (1635). Стеклоделие, упавшее было на первых порах по возникновении, начинает снова развиваться заботами Петра Великого в начале XVIII стол. С этого времени… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Свечи и производство их — Исторический очерк. Светильня. Окраска С. С. сальные. С. стеариновые. С. восковые. С. парафиновые и спермацетовые. С. впервые появились во времена первых гонений на христиан, и с этого времени римляне употребляли их при всех церковных церемониях … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Свечи и производство их* — Исторический очерк. Светильня. Окраска С. С. сальные. С. стеариновые. С. восковые. С. парафиновые и спермацетовые. С. впервые появились во времена первых гонений на христиан, и с этого времени римляне употребляли их при всех церковных церемониях … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сульфоновые кислоты — или сульфокислоты (жирного ряда) С. кислотами называются производные серной кисл. OH SO2 OH, получающиеся через замену одного из гидроксилов ее углеводородными остатками, напр. CH8 SO2 OH. Так происходят одноосновные С. кислоты. При замещении… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кожевенное производство — Кожа животных или шкура в присутствии влажности легко загнивает, высушенная делается твердой и хрупкой, при обработке горячей водой превращается в клей. К. производство имеет целью превращение сырых шкур в обработанную кожу, которая не должна… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Читайте также:

