Сообщение про барий по химии кратко
Обновлено: 02.07.2024
1. Барий вступает в реакцию с простыми веществами :
1.1. Барий взаимодействует с азотом при 200 — 460º С образуя нитрид бария:
1.2. Барий сгорает в кислороде (воздухе) при температуре выше 800º С, то на выходе будет образовываться оксид бария:
2Ba + O2 = 2BaO
1.3. Барий активно реагирует при температуре 100 — 150º С с хлором, бромом, йодом и фтором . При этом образуются соответствующие соли :
1.4. С водородом барий реагирует при температуре 150 — 300º C с образованием гидрида бария:
1.6. Барий взаимодействует с серой при 150º С и образует сульфид бария:
Ba + S = BaS
1.7. Барий взаимодействует с углеродом (графитом) при 500º С и образует карбид бария:
Ba + 2C = BaC2
2. Барий активно взаимодействует со сложными веществами:
2.1. Барий при комнатной температуре реагирует с водой . Взаимодействие бария с водой приводит к образованию гидроксида бария и газа водорода:
2.2. Барий взаимодействует с кислотами:
2.2.1. Барий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бария и водород :
Ba + 2HCl = BaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой барий образует нитрат бария, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат бария, нитрат аммония и вода:
2.2.3. Барий вступает во взаимодействие с сероводородной кислотой при температуре выше 350 с образованием сульфида бария и водорода:
Ba + H2S = BaS + H2
2.3. Барий вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид бария и гидрид бария:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид бария и водород:
2.4. Барий взаимодействует с оксидами :
Барий реагирует с углекислым газом при комнатной температуре с образованием карбоната бария и углерода:
БАРИЙ – химический элемент 2-й группы периодической системы, атомный номер 56, относительная атомная масса 137,33. Расположен в шестом периоде между цезием и лантаном. Природный барий состоит из семи стабильных изотопов с массовыми числами 130(0,101%), 132(0,097%), 134(2,42%), 135(6,59%), 136(7,81%), 137(11,32%) и 138 (71,66%). Барий в большинстве химических соединений проявляет максимальную степень окисления +2, но может иметь и нулевую. В природе барий встречается только в двухвалентном состоянии.
История открытия.
Барий в природе.
В земной коре содержится 0,065% бария, он встречается в виде сульфата, карбоната, силикатов и алюмосиликатов. Основные минералы бария – уже упоминавшиеся выше барит (сульфат бария), называемый также тяжелым или персидским шпатом, и витерит (карбонат бария). Мировые минерально-сырьевые ресурсы барита оценивались в 1999 в 2 млрд. тонн, значительная часть их сосредоточена в Китае (около 1 млрд. тонн) и в Казахстане (0,5 млрд. тонн). Большие запасы барита есть и в США, Индии, Турции, Марокко и Мексике. Российские ресурсы барита оцениваются в 10 миллионов тонн, его добыча ведется на трех основных месторождениях, расположенных в Хакасии, Кемеровской и Челябинской областях. Общая годовая добыча барита в мире составляет около 7 миллионов тонн, Россия производит 5 тыс. тонн и импортирует 25 тыс. тонн барита в год.
Получение.
Основным сырьем для получения бария и его соединений служат барит и, реже, витерит. Восстанавливая эти минералы каменным углем, коксом или природным газом, получают соответственно сульфид и оксид бария:
BaSO4 + 4C = BaS + 4CO
BaCO3 + C = BaO + 2CO
Металлический барий получают, восстанавливая его оксидом алюминия.
Кроме того, барий можно получить электролизом расплавленной смеси хлоридов бария и кальция.
Простое вещество.
Барий – серебристо-белый ковкий металл, при резком ударе раскалывается. Температура плавления 727° С, температура кипения 1637° С, плотность 3,780 г/см 3 . При обычном давлении существует в двух аллотропных модификациях: до 375° C устойчив a -Ba с кубической объемно-центрированной решеткой, выше 375° С устойчив b -Ba. При повышенном давлении образуется гексагональная модификация. Металлический барий обладает высокой химической активностью, он интенсивно окисляется на воздухе, образуя пленку, содержащую BaO, BaO2 и Ba3N2, при незначительном нагревании или при ударе воспламеняется.
поэтому барий хранят под слоем керосина или парафина. Барий энергично реагирует с водой и растворами кислот, образуя гидроксид бария или соответствующие соли:
С галогенами барий образует галогениды, с водородом и азотом при нагревании – соответственно гидрид и нитрид.
Металлический барий растворяется в жидком аммиаке с образованием темно-синего раствора, из которого можно выделить аммиакат Ba(NH3)6 – кристаллы с золотистым блеском, легко разлагающиеся с выделением аммиака. В этом соединении барий имеет нулевую степень окисления.
Применение в промышленности и науке.
Соединения бария.
Наибольший практический интерес представляют соединения двухвалентного бария.
Оксид бария (BaO): промежуточный продукт в производстве бария – тугоплавкий (температура плавления около 2020° C) белый порошок, реагирует с водой, образуя гидроксид бария, поглощает углекислый газ из воздуха, переходя в карбонат:
Прокаливаемый на воздухе при температуре 500–600° C, оксид бария реагирует с кислородом, образуя пероксид, который при дальнейшем нагревании до 700° C вновь переходит в оксид, отщепляя кислород:
Так получали кислород вплоть до конца 19 в., пока не был разработан метод выделения кислорода перегонкой жидкого воздуха.
В лаборатории оксид бария можно получить прокаливанием нитрата бария:
Сейчас оксид бария используется как водоотнимающее средство, для получения пероксида бария и изготовления керамических магнитов из феррата бария (для этого смесь порошков оксидов бария и железа спекают под прессом в сильном магнитном поле), но основное применение оксида бария – изготовление термоэмиссионных катодов. В 1903 молодой немецкий ученый Венельт проверял закон испускания электронов твердыми телами, открытый незадолго до этого английским физиком Ричардсоном. Первый из опытов с платиновой проволокой полностью подтвердил закон, но контрольный эксперимент не удался: поток электронов резко превышал ожидаемый. Поскольку свойства металла не могли измениться, Венельт предположил, что на поверхности платины есть какая-то примесь. Перепробовав возможные загрязнители поверхности, он убедился в том, что дополнительные электроны испускал оксид бария, входивший в состав смазки вакуумного насоса, используемого в эксперименте. Однако научный мир не сразу признал это открытие, так как его наблюдение не удавалось воспроизвести. Лишь почти через четверть века англичанин Колер показал, что для проявления высокой термоэлектронной эмиссии оксид бария нужно прогревать при очень низких давлениях кислорода. Объяснить это явление смогли только в 1935. Немецкий ученый Поль предположил, что электроны испускаются небольшой примесью бария в оксиде: при низких давлениях часть кислорода улетучивается из оксида, а оставшийся барий легко ионизируется с образованием свободных электронов, которые покидают кристалл при нагревании:
2BaO = 2Ba + O2; Ba = Ba 2+ + 2е
Правильность этой гипотезы была окончательно установлена в конце 1950-х советскими химиками А.Бунделем и П.Ковтуном, которые измерили концентрацию примеси бария в оксиде и сопоставили ее с потоком термоэмиссии электронов. Сейчас оксид бария является активной действующей частью большинства термоэмиссионных катодов. Так например, пучок электронов, формирующий изображение на экране телевизора или компьютерного монитора, испускается оксидом бария.
Карбонат бария (BaCO3). В природе – минерал витерит. Белый порошок, нерастворимый в воде, растворимый в сильных кислотах (кроме серной). При нагревании до 1000° С разлагается с выделением CO2:
Карбонат бария добавляют в стекло для увеличения его коэффициента преломления, вводят в состав эмалей и глазурей.
Сульфат бария (BaSO4). В природе – барит (тяжелый или персидский шпат) – основной минерал бария – белый порошок (температура плавления около 1680° C), практически нерастворимый в воде (2,2 мг/л при 18° C), медленно растворяется в концентрированной серной кислоте.
Сульфат бария входит в состав литопона – неядовитой белой краски с высокой кроющей способностью, широко востребованной на рынке. Для изготовления литопона смешивают водные растворы сульфида бария и сульфата цинка, при этом происходит обменная реакция и в осадок выпадает смесь мелкокристаллических сульфата бария и сульфида цинка – литопон, а в растворе остается чистая вода.
BaS + ZnSO4 = BaSO4 Ї + ZnS Ї
В производстве дорогих сортов бумаги сульфат бария играет роль наполнителя и утяжелителя, делая бумагу белее и плотнее, его используют и в качестве наполнителя резин и керамики.
Более 95% добываемого в мире барита используется для приготовления рабочих растворов для бурения глубоких скважин.
Сульфид бария (BaS). Промежуточный продукт в производстве бария и его соединений. Торговый продукт представляет собой серый рыхлый порошок, плохо растворимый в воде. Сульфид бария применяется для получения литопона, в кожевенной промышленности для удаления волосяного покрова со шкур, для получения чистого сероводорода. BaS – компонент многих люминофоров – веществ, светящихся после поглощения световой энергии. Именно его получил Касциароло, прокаливая барит с углем. Сам по себе сульфид бария не светится: необходимы добавки веществ-активаторов – солей висмута, свинца и других металлов.
Титанат бария (BaTiO3). Одно из самых промышленно важных соединений бария – белое тугоплавкое (температура плавления 1616° C) кристаллическое вещество, нерастворимое в воде. Получают титанат бария сплавлением диоксида титана с карбонатом бария при температуре около 1300° C:
Титанат бария – один из лучших сегнетоэлектриков ( см. также СЕГНЕТОЭЛЕКТРИКИ), очень ценных электротехнических материалов. В 1944 советский физик Б.М.Вул обнаружил незаурядные сегнетоэлектрические способности (очень высокую диэлектрическую проницаемость) у титаната бария, который сохранял их в широком температурном диапазоне – почти от абсолютного нуля до +125° C. Это обстоятельство, а также большая механическая прочность и влагостойкость титаната бария способствовали тому, что он стал одним из самых важных сегнетоэлектриков, используемых, например, для изготовления электрических конденсаторов. Титанат бария, как и все сегнетоэлектрики, обладает и пьезоэлектрическими свойствами: изменяет свои электрические характеристики под действием давления. При действии переменного электрического поля в его кристаллах возникают колебания, в связи с чем их используют в пьезоэлементах, радиосхемах и автоматических системах. Титанат бария применяли при попытках обнаружить гравитационные волны.
Другие соединения бария.
Нитрат и хлорат (Ba(ClO3)2) бария – составная часть фейерверков, добавки этих соединений придают пламени ярко-зеленую окраску. Пероксид бария входит в состав запальных смесей для алюминотермии. Тетрацианоплатинат(II) бария (Ba[Pt(CN)4]) светится под воздействием рентгеновских и гамма-лучей. В 1895 немецкий физик Вильгельм Рентген, наблюдая свечение этого вещества предположил существование нового излучения, названного впоследствии рентгеновским. Сейчас тетрацианоплатинатом(II) бария покрывают светящиеся экраны приборов. Тиосульфат бария (BaS2O3) придает бесцветному лаку жемчужный оттенок, а, смешав его с клеем, можно добиться полной имитации перламутра.
Токсикология соединений бария.
Все растворимые соли бария ядовиты. Сульфат бария, применяемый при рентгеноскопии, практически нетоксичен. Смертельная доза хлорида бария составляет 0,8–0,9 г, карбоната бария – 2–4 г. При приеме внутрь ядовитых соединений бария возникают жжение во рту, боли в области желудка, слюнотечение, тошнота, рвота, головокружение, мышечная слабость, одышка, замедление пульса и падение артериального давления. Основной метод лечения отравлений барием – промывание желудка и употребление слабительных средств.
Основными источниками поступления бария в организм человека являются пища (особенно морепродукты) и питьевая вода. По рекомендации Всемирной организацией здравоохранения содержание бария в питьевой воде не должно превышать 0,7 мг/л, в России действуют гораздо более жесткие нормы – 0,1 мг/л.
Юрий Крутяков
Фигуровский Н.А. История открытия элементов и происхождения их названий. М., Наука, 1970
Венецкий С.И. О редких и рассеянных. Рассказы о металлах. М., Металлургия, 1980
Популярная библиотека химических элементов. Под. ред. И.В.Петрянова-Соколова. М., Наука, 1983
Информационно-аналитический обзор. Состояние и перспективы мирового и внутреннего рынков цветных, редких и благородных металлов. Выпуск 18. Барит. М., 2002
Первое название этого химического элемента – тяжелая земля. Свойства бария ценят атомщики, врачи, металлурги. Его влияние на человека бывает фатальным.

Что представляет собой
Барий – это химический элемент, занимающий ячейку 56 таблицы Менделеева:
- Изначально это мягкое, пластичное с вязкой структурой вещество серебристого цвета.
- Относится к щелочноземельным металлам.
- Подобно другим элементам этого сегмента, наделен повышенной химической активностью.
- По составу – конгломерат семи стабильных изотопов. Две трети (72%) приходится на Ba138. Синтезированы радиоактивные изотопы.
Самый востребованный из искусственных изотопов – Ba140. Этот продукт урано-торие-плутониевого распада служит маркером радиоактивности.
Международное обозначение – Ba (Barium).
Как был открыт
История открытия вещества связана с именами европейских ученых:
Нахождение в природе
В природе чистый барий не найден. Он представлен минералами, самые распространенные – барит (тяжелый шпат) и витерит.

Минерал Барит
Вещество не относится к редким.
Тонна земной коры содержит 500 грамм бария, литр морской воды – 0,02 мг.
Для разработки рентабельны баритовые, с добавкой сульфидов и флюоритов гидротермальные жилы. Промышленный интерес представляют месторождения метасоматических пластов и россыпей.
Технология получения
Исходник для промышленного извлечения бария – сульфитовый продукт (82-96%). Его добывают флотацией барита. Цель металлургов – получение бария в виде металла. Методика предусматривает восстановление оксида порошковым алюминием при высоких температурах.

Барий металлический Ba 99,9%
- Сульфат бария восстанавливают газом либо углем.
- Сульфид нагревают.
- Полученный гидроксид становится карбонатом, затем оксидом (850-1100°C).
- Из оксида восстанавливают металлическую форму бария. Задействуется алюминий и термовоздействие (1220-1260°С).
Процесс происходит в вакууме. Алгоритм работы аппаратуры позволяет проводить в режиме нон-стоп полный технологический цикл: восстановление, дистилляция, конденсация, плавка металла.
Продукт повышенной чистоты (примесей менее 0,001%) получают плавкой либо двойной вакуумной перегонкой.
Физико-химические характеристики
Барий наделен типичными для щелочноземельных металлов свойствами:
- Пластичен, хорошо куется, мягок (2 балла из 10 по Моосу).
- Хрупок, от сильного удара разрушается.
- Строение кристаллической решетки представлено двумя модификациями в зависимости от температуры (граница – 374,9°C).
По свойствам химический элемент барий сродни кальцию и стронцию, но более активен.
Активность проявляется даже при комнатных температурах:
- На воздухе окисляется.
- Бурно взаимодействует с галогенами, фосфором, водой, разбавленными кислотами.
- Восстанавливает до металла большинство оксидов, галогенидов, сульфидов.
Загорается даже при малом нагреве. Эту характеристику нейтрализуют погружением активного металла в парафин либо керосин.
| Свойства атома | |
|---|---|
| Название, символ, номер | Барий / Barium (Ba), 56 |
| Атомная масса (молярная масса) | 137,327(7) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s2 |
| Радиус атома | 222 пм |
| Химические свойства | |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
| Электроотрицательность | 0,89 (шкала Полинга) |
| Электродный потенциал | -2,906 |
| Степени окисления | +2 |
| Энергия ионизации (первый электрон) | 502,5 (5,21) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 3,5 г/см³ |
| Температура плавления | 1 002 K |
| Температура кипения | 1 910 K |
| Уд. теплота плавления | 7,66 кДж/моль |
| Уд. теплота испарения | 142,0 кДж/моль |
| Молярная теплоёмкость | 28,1 Дж/(K·моль) |
| Молярный объём | 39,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,020 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) (18.4) Вт/(м·К) |
| Номер CAS | 7440-39-3 |
Вещество легко опознать по цвету пламени: соединения бария делают его желтовато-зеленым.
Где используется
Утилитарные характеристики металла (пластичность, ковкость, вязкость) обеспечили востребованность промышленниками и учеными. Чаще это соединения, сплавы, чем чистый металл. Область использования – от атомной станции до салюта.
Атом, химия
Материал востребован серьезными отраслями:
- Источники тока (химические). Фторид – компонент электролита во фторионных, оксид – в медных, сульфат – в свинцово-кислотных аккумуляторах.
- Сверхпроводники. Смесь оксидов бария, меди, редкоземельных элементов – ингредиент при производстве керамики-сверхпроводника.
- Атомная промышленность. Оксид добавляют к стеклу-облицовке урановых стержней.
Другие отрасли промышленности
Применение нашлось металлу и сплавам (особенно с алюминием) в гражданском сегменте:
Нарасхват идут соединения элемента:
- Пероксид. Исходник отбеливателя волокон шелкопряда, хлопка, шерсти. Дезинфектор.
- Сульфид. Истребитель волосяного покрова со шкур животных.
- Перхлорат. Топ-осушитель.
- Хромат, манганат. Желтый и зеленый пигменты в лако-красочном производстве.
Нитрат, хлорат создают зеленые огни салюта, других пиротехнических зрелищ.
Непромышленный сегмент
Карбонатом изничтожают грызунов.
Медициной востребован сульфат. Он нетоксичен, используется как контрастный материал при исследовании ЖКТ.
Биологическое воздействие
Барий не классифицируется как жизненно необходимый микроэлемент:
- В организме человека порядка 20 мг вещества.
- За сутки организм получает до 1 мг.
- Микродозы выявлены во всех органах и тканях.
- Больше всего вещества содержат селезенка, мышцы, головной мозг, хрусталик глаза.
Порядка 90% микроэлемента аккумулирует скелет и зубы.
Сколько бария нужно человеку, не установлено.
Предупреждение
Воздействие вещества на человека бывает опасным.
Барий, его растворимые соли токсичны:
На коже, слизистых оболочках металл оставляет химический ожог.
По стандартам РФ, барий относится ко 2-му классу опасности. Кубический дециметр воды (объем 10х10х10 см) не может содержать более 0,7 мг вещества.
Стоимость
На мировом рынке представлен ассортимент продукции из бария. Цены определяются чистотой продукта. Например, слитки чистотой 99,91% идут по $32-35 за кг.
В ячейке под порядковым номером 56 периодической системы Менделеева располагается химический элемент барий. В таблице он находится в шестом периоде, второй группе, главной подгруппе (A). Обозначается барий символом Ba (от латинского наименования элемента - Barium). В периоде он окружен цезием и лантаном, в группе - стронцием и радием. Для бария характерна высокая химическая активность. Как и все элементы второй группы, он относится к щелочноземельным металлам.
- Атом элемента и кристалл
- Название и история открытия
- Природное вещество и его местонахождение
- Месторождения и их ценность
- Процесс получения
- Свойства металла
- Области использования
- Воздействие на человека
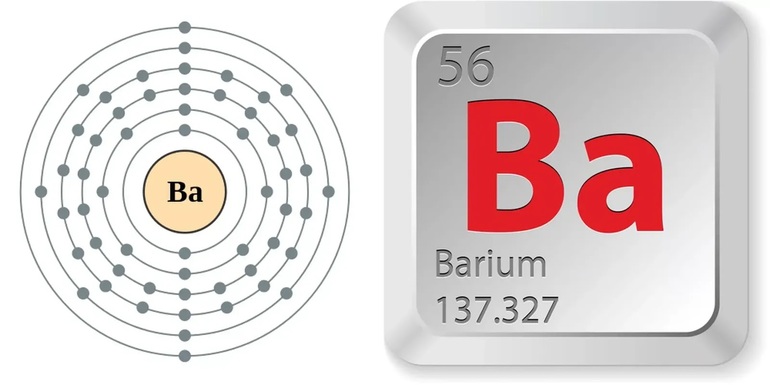
Атом элемента и кристалл
К настоящему моменту науке известны бариевые изотопы, то есть разновидности атомов элемента, имеющие массовые числа от 114 до 153, а также ядерные изомеры в количестве 10 штук.
В форме простого вещества барий представляет собой металл светло-серебристого цвета. Показатели относительной молярной, атомной и молекулярной масс равные и составляют 137,33 г/моль. Для этого металла в чистом виде характерны:
- мягкость;
- ковкость;
- вязкость.
В радиусе атом этого элемента равен 222 пикометрам. Схематичное строение атома бария с электронными слоями:
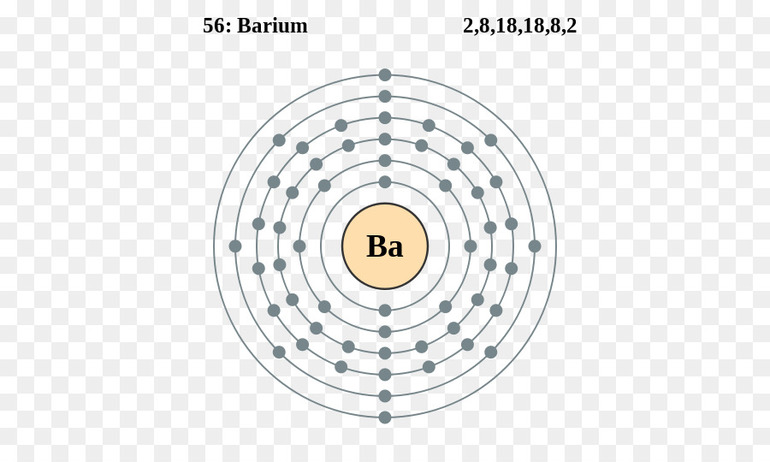
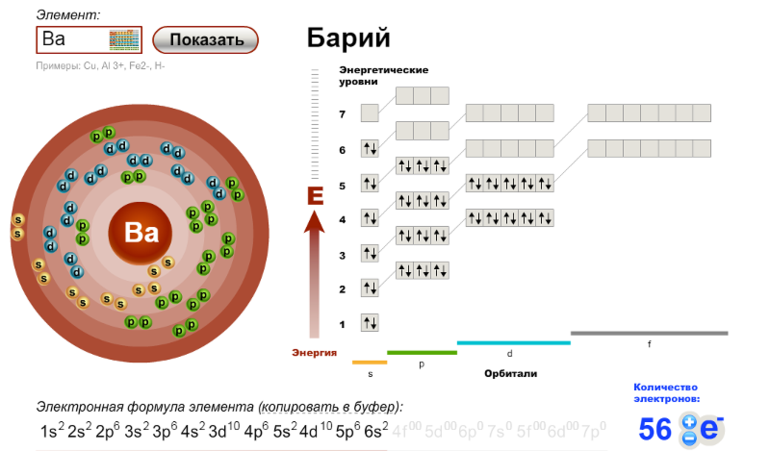
Заряд элемента всегда совпадает с его порядковым номером в периодической таблице, то есть у бария он равен 56. Конфигурация электронов на внешнем слое атома - 6s во второй степени. Электронная формула бария (в обычном и графическом представлении):
Кристаллическая решетка бария в форме простого вещества имеет кубическую структуру объемноцентрированного типа. Ее параметр, то есть размер ячейки, составляет 5,02 ангстрема.
Название и история открытия
Металлический барий в чистом виде был выделен химиком-англичанином Гемфри Дэви в 1808 году, после проведения опыта по получению бариевой амальгамы. Сплав был получен Дэви путем электролиза ртутного катода и влажного едкого барита, то есть гидроксида бария. Затем британский химик нагреванием выпарил ртуть из полученного вещества, в результате чего был впервые в истории выделен чистый металлический барий.
Природное вещество и его местонахождение
Природный барий включает в себя семь изотопов. Их доли в составе вещества (в порядке убывания) и массовые числа:
- 71,66% - 138;
- 11,32% - 137;
- 7,81% - 136;
- 6,59% - 135;
- 2,42% - 134;
- 0,101% - 130;
- 0,097% - 132.
Изотоп с массовым числом 130 имеет огромный период полураспада, который во много раз превышает нынешний возраст Вселенной. Шесть других изотопов относятся к стабильному типу.

Что касается нахождения бария в природе, то в коре Земли он содержится в количестве 0,05% от общей массы этого слоя земного шара. В морской воде этот металл в среднем содержится в объеме 0,02 мг/л.
Природный барий из подгруппы щелочноземельных металлов активен. Его химические связи в составе минералов отличаются прочностью. Главными минералами, включающими в себя барий, считаются барит и витерит. К редким бариевым минералам относятся:
- гиалофан - бариево-калиевый алюмосиликат смешанного типа;
- цельзиан (также известен как бариевый полевой шпат) - бариевый алюмосиликат;
- нитробарит - бариевый нитрат.
Месторождения и их ценность
Природные месторождения бария называются баритовыми рудниками. Добываемые вещества, то есть баритовые руды, по минеральным ассоциациям подразделяются на две категории: комплексную и мономинеральную.
Руды комплексного типа, в свою очередь, делятся на следующие подвиды:

- барито-флюоритовый;
- барито-сульфидный;
- барито-кальцитовый;
- железо-баритовый.
Состав баритовых руд мономинерального типа не нуждается в дополнительном пояснении. Именно месторождения руд этой категории представляют наибольшую ценность (особенно гидротермальные жильные). Также с практической стороны интересны месторождения руд барито-флюоритового и барито-сульфидного типов.
Кроме того, для промышленности особое значение имеют россыпи элювиального типа, а также пластовые месторождения метасоматического типа. Что касается редко встречающихся осадочных месторождений, образованных химическими осадками водоемов, то их ценность минимальна.
Баритовые руды, относящиеся к комплексной категории, содержат множество других полезных и ценных компонентов:
- флюорит;
- золото;
- серебро;
- галенит (источник свинца);
- медь;
- сфалерит (источник цинка);
- железо;
- олово;
- никель;
- кальцит;
- кварц и так далее.
Дополнительные компоненты содержатся в баритовых рудах в промышленной концентрации. По этой причине комплексные руды имеют многоцелевое значение и применяются в самых разных областях и сферах.
Процесс получения
В качестве основного сырья в процессе получения бария используется так называемый баритовый концентрат - это 80-95-процентный бариевый сульфат (то же, что и сернокислый барий). Концентрированное вещество производится путем флотации (обогащения) барита — минерала, известного как тяжелый шпат.

Для последующего восстановления бариевого сульфата в производственном процессе используется либо каменноугольный кокс, либо природный газ. Затем сульфид нагревают для гидролиза до образования едкого барита - бариевого гидроксида. Альтернативный вариант (вместо нагревания и гидролиза) - превращение сульфида в бариевый карбонат нерастворимого типа посредством воздействия углекислым газом.
Следующее действие — перевод полученного вещества в бариевый оксид BaO. Для этого вещество прокаливают. Для прокаливания карбоната необходима температура свыше 1000 градусов Цельсия, а для гидроксида достаточно 800 градусов Цельсия.
Последний этап в процессе получения металлического бария - это электролиз расплава бариевого хлорида безводного типа. Вещество распадается на компоненты — барий и хлор отделяются друг от друга. Химическое уравнение, отражающее этот этап, максимально простое: BaCl2 = Ba + Cl2.
Свойства металла
Барий обладает второй степенью окисления со знаком плюс. Валентность элемента совпадает с номером группы размещения в таблице Менделеева, то есть равна двум. Ковалентный радиус атома - 198 пикометров, а ионный - 134 пикометра.
По шкале Полинга показатель электроотрицательности бария составляет 0,89. Электродный потенциал элемента равняется -2,906. Энергия ионизации первого электрона достигает 502,5 кДж/моль, что равнозначно 5,21 электронвольта.
Согласно химическим свойствам бария, этот щелочноземельный металл:
- быстро окисляется на воздухе (в результате этого взаимодействия образуется смесь бариевых соединений - оксида и нитрида);
- воспламеняется даже при слабом нагревании;
- с водой реагирует энергично (результатом этой реакции служит образование бариевого гидроксида);
- с галогенами легко вступает в реакцию (образуются галогениды);
- с кислотами разбавленного типа взаимодействует активно.
Многие бариевые соли мало растворяются в воде или не растворяются полностью. К таким солям относятся:

- фосфат;
- сульфит;
- сульфат;
- карбонат.
Сульфид же, напротив, отлично растворяется в воде. Бариевые соли растворимого типа помогают установить содержание в растворе серной кислоты, а также ее растворимых солей. При их наличии в растворе выпадает осадок белого цвета - это бариевый сульфат, который не растворяется ни в кислотах, ни в воде.
Барий способен восстановить до соответствующего металла многие из таких соединений:
- галогениды;
- оксиды;
- сульфиды.
При совместном нагревании бария и водорода образуется бариевый гидрид. Кроме того, барий при нагревании вступает в реакцию с аммиаком. Бариевые соединения при попадании в пламя окрашивают его в насыщенный желто-зеленый цвет.
Термодинамические и физические свойства бария в форме простого вещества:
- молярный объем - 39 кубических сантиметров на моль;
- молярная теплоемкость - 28,1 джоуля на кельвин-моль;
- удельная теплота плавления - 7,66 килоджоуля на моль;
- удельная теплота испарения - 142 килоджоуля на моль.
В нормальных условиях плотность этого металла составляет 3,5 грамма на кубический сантиметр. Плавится он при температуре 1002 кельвина, а кипит при температуре 1910 кельвинов. Теплопроводность металла составляет 300 кельвинов или 18,4 ватта на метр-кельвин.
Такая физическая характеристика, как ковкость, не мешает барию раскалываться при резком ударе. По шкале Мооса твердость этого металла равна 1,25. Для хранения бария требуется определенная среда. Ее обеспечивает керосин или слой парафина, которым покрывают металл.
Области использования

Этот металл используется в самых разных отраслях. В электровакуумных приборах он играет роль геттера или, проще говоря, газопоглотителя. В металлургической отрасли и в производстве теплоносителей он используется в качестве антикоррозийного материала.
Помимо этого, барию найдено применение в следующих сферах:
- оптической;
- пиротехнической;
- медицинской и других.
Разумеется, это далеко не все области применения.
Воздействие на человека
Несмотря на активное использование бария в самых разных сферах, его биологическая роль пока мало изучена. К жизненно важным микроэлементам он не относится. Напротив, его воздействие на человеческий организм может быть смертельным.
В медицине применяется исключительно бариевый сульфат - это соединение нетоксично и нерастворимо. Что касается бариевых соединений, которые растворяются в воде, то их главная особенность - высокая токсичность. Абсолютно все они ядовиты и губительны для человеческого организма.
В зависимости от степени отравления бариевыми соединениями, человек может умереть всего за несколько часов (максимальный срок наступления летального исхода при сильном отравлении - сутки), поэтому крайне важно соблюдать максимальную осторожность при контакте с такими веществами и использовать их только по прямому назначению.
Читайте также:

