Сообщение об изотопах железа
Обновлено: 02.07.2024
Изото́пы желе́за — разновидности химического элемента железа, имеющие разное количество нейтронов в ядре. Известны изотопы железа с массовыми числами от 45 до 72 (количество протонов в ядре железа всегда 26, нейтронов от 19 до 46) и 6 ядерных изомеров.
Природное железо представляет собой смесь четырёх стабильных изотопов:
- 54 Fe (изотопная распространённость 5,845 %); (изотопная распространённость 91,754 %);
- 57 Fe (изотопная распространённость 2,119 %);
- 58 Fe (изотопная распространённость 0,282 %).
Из искусственных изотопов железа наиболее устойчивые 60 Fe (период полураспада 2,62 миллиона лет [1] ), 55 Fe ( 2,737 года ), 59 Fe ( 44,495 суток ) и 52 Fe ( 8,275 часа ); остальные изотопы имеют период полураспада менее 10 минут [2] .
Природное железо состоит из четырёх стабильных изотопов:
54 Fe (железо-54), 56 Fe (железо-56), 57 Fe (железо-57) и 58 Fe (железо-58).
Также известно более 20 нестабильных изотопов железа с массовыми числами от 45 до 72, наиболее устойчивые из которых — 60 Fe (период полураспада по уточнённым в 2009 году данным составляет 2,6 млн лет), 55 Fe (2,737 года), 59 Fe (44,495 суток) и 52 Fe (8,275 часа); остальные изотопы имеют период полураспада менее 10 минут. Изотоп железа 56 Fe относится к наиболее стабильным ядрам.
Основные сферы использования: научные исследования, медицина, материаловедение, атомная энергетика, метрология.

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Смотрите так же:
СТРУКТУРА
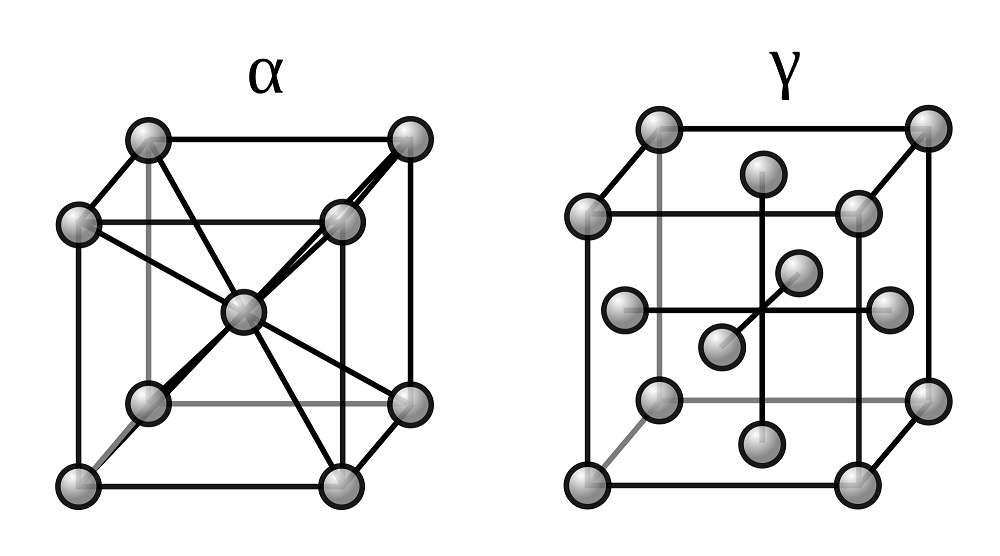
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

ПРОИСХОЖДЕНИЕ

ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железа ( Fe ) имеет 28 известных изотопов с массовыми числами в диапазоне от 45 до 72, а также шесть ядерных изомеров . Из этих изотопов четыре являются стабильными: 54 Fe, 56 Fe, 57 Fe и 58 Fe. Изотоп 56 Fe является наиболее распространенным, за ним следует 54 Fe (который считается очень слаборадиоактивным, с периодом полураспада). более 3,1 × 10 22 лет). Стандартная атомная масса железа 55,845 (2) ед .
Самым стабильным радиоизотопом железа является 60 Fe с периодом полураспада 2,6 миллиона лет, за ним следуют 55 Fe (2,7 года), 59 Fe (чуть менее 44,5 дней) и 52 Fe (8,5 часов). Все остальные изотопы имеют период полураспада менее 10 минут, а большинство из них - менее минуты. Изотопы, более легкие, чем стабильные изотопы, распадаются в основном за счет позитронной эмиссии (β + ) на изотопы марганца , за исключением некоторых очень легких изотопов, которые также могут распадаться, или даже главным образом, путем испускания позитронов с последующим испусканием протонов в изотопах хрома . Самый легкий из них, 45 Fe, распадается в основном (на 70%) за счет двойного испускания протона в 43 Cr. Изотопы тяжелее , чем изотопы стабильны , главным образом, р излучения - в изотопов кобальта . 55 Fe распадается электронным захватом в 55 Mn.
Резюме
Известные изотопы
Натуральное железо
Природное железо состоит из четырех стабильных изотопов 54 Fe, 56 Fe, 57 Fe и 58 Fe и очень слабых следов 60 Fe, обнаруженных на дне океана.
Утюг 54
Железа 54 ( 54 Fe ) является изотопом железа, ядро состоит из 26 протонов и 28 нейтронов . Наблюдается, что он стабилен, но теоретически он должен распадаться за счет двойной эмиссии позитронов (2β + ) до 54 Cr с периодом полураспада более 3,1 × 10 22 лет.
Утюг 55
Железа 55 ( 55 Fe ) является изотопом железа, ядро состоит из 26 протонов и 29 нейтронов . Это радиоизотоп, который распадается при захвате электрона на марганец с периодом полураспада 2,737 года. Это рентгеновский излучатель , используемый в качестве источника рентгеновского излучения в различных методах научного анализа, таких как дифракция рентгеновских лучей . Это также источник оже-электронов , испускаемых при распаде.
Утюг 56
Утюг 57
Железа 57 ( 57 Fe ) является изотопом железа, ядро состоит из 26 протонов и 31 нейтронов . Это стабильный изотоп, обычно используемый в мессбауэровской спектроскопии из-за небольшого естественного изменения энергии ядерного перехода при 14,4 кэВ .
Утюг 60
Железа 60 ( 60 Fe ) является изотопом железа, ядро состоит из 26 протонов и 34 нейтронов . Это радиоизотоп с периодом полураспада 2,6 миллиона лет, тогда как до 2009 года считалось, что он составляет 1,5 миллиона лет. Он распадается за счет β-излучения - до кобальта 60 .
Железо-60 также было обнаружено на дне океана , что подтверждается коротким периодом полураспада железа 60 в геологическом масштабе, поступившим от нескольких близлежащих сверхновых (менее 300 световых лет от Земли), возникших менее 10 миллионов лет назад.
Читайте также:

