Сообщение о веществе по химии 8 класс
Обновлено: 30.06.2024
Химия – это наука о веществах и их свойствах, о превращениях веществ и способах управления этими превращениями.
В современном мире Химия играет одну из ведущих ролей среди всех наук. И занимает это место по праву. Современную медицину, металлургию, разные виды промышленностей невозможно представить без достижений, которых достигла химия. Каждая отрасль производства использует эти достижения.
Человек еще с древности тесно связан с химическими процессами. Когда первобытным человеком был зажжен огонь, он использовал его для приготовления пищи, обогрева жилья, обжига гончарных изделий.
Дальнейшее развитие человека уже было тесно связанно со знаниями о веществах. Металлы стали следующим шагом человеческой цивилизации. Появились целые эпохи: вслед за каменным веком пришел медный, бронзовый, затем наступил железный век.
Медь, золото, серебро, свинец, олово, железо – это одни из первых металлов, которые были использованы человеком. Их применение шло одновременно в Азии, Африке, Европе в V-VI м тысячелетиях до н.э. В то же время с развитием металлургии шло развитие изготовления керамики и стекла, лекарственных препаратов, и косметики. Ученые античной Греции внесли наибольший вклад в развитие науки. Среди них Аристотель, Платон, Эмпедокл.
Именно важные теоретические знания Аристотеля стали фундаментом следующей эпохи в развитии химии, а именно алхимии. Алхимия донаучное направление в химии, зародившиеся в III-IV веке до н.э. Она просуществовала до XVI.в., когда происходит ее упадок. Считается, что родина алхимии это Древний Египет. Главной целью алхимиков было превращение не благородных металлов в благородные или в ценные, например в золото. В этом и заключалась главная цель химии до XVI столетия. Алхимия была широко распространена в Арабском мире, Греции, Риме, Европе, Китае, Индии. На Руси же алхимия была развита, крайне слабо. Несомненно, что именно алхимия явилась фундаментом при развитии современной химии. Она сыграла свою историческую роль.
Менделеевым стало еще одним весомым вкладом. С XIX в. берет свое начало новое направление органическая химия. В нынешнее время химия работает над такими задачами как источники альтернативного топлива. Не секрет что нефть и газ не возобновляемые ресурсы. Химия работает во многих направлениях таких как изготовление всевозможных полимерных материалов. От парфюмерии до сельского хозяйство. Огромное число химических лабораторий работают по всему миру на благо человечества.
Вариант №2
Наука прошлого
Химия - наука о веществах, их соединениях и возможных реакциях, пришедшая к нам из античного мира. В те далёкие времена наука именовалась алхимией и приравнивалась к искусству. Это продолжалось до XVI-XVII веков. Именно с того периода химия получила мощный толчок в развитии, который продолжается и по сей день.
Алхимия
Своё начало наука берёт с глубокой древности. Первые упоминания о ней датируются II-IV веком нашей эры. В этот период времени наиболее широко алхимия развивалась в Риме и Египте, но после упадка в Римской империи “пальму первенства” в этом ремесле взяли арабские мудрецы, которые в свою очередь внесли не измеримый вклад в дальнейшее развитие науки. Была заложена теория о возникновении и составе металлов, объяснены все их основные свойства, введены представления о философском камне (с помощью которого можно было превращать металл в золото и исцелять все болезни), выявлен “принцип твёрдости” металлов.
После завоевания турками части Европы алхимия (как арабская, так и европейская) получила плодородную почву для бурного развития. Было создано множество книг и трактатов о изучении и свойствах различных элементов, заложено начало экспериментальной алхимии, изготовлен чёрный порох. Но в скором времени христианская церковь запретила изучение и применение алхимии, связав это с деятельностью ведьм. С этого момента можно наблюдать значительный спад в развитии науки.
Интересный факт: долгое время алхимия не рассматривалась как отдельная наука, Она представляла собой особое направление ритуального искусства.
Химия как наука
Развитие химии принято считать с начала шестнадцатого столетия, с момента появления буржуазного общества. С пониманием общей картины мира многие учёные стали задумываться о его составляющих. Прогресс химии начался с объяснения Робертом Бойльём разности химических элементов и их строения. Неоценимый вклад также внёс Ван Гельмонт своим открытием углекислого газа.
Химия - наука, тесно связанная с биологией и физикой. Она продолжает своё развитие. Практически каждый год выявляются новые элементы, их свойства и воздействие на живой организм.
Факт: в первом экземпляре периодической таблицы Д. Менделеева находилось 66 элементов, расположенных по возрастанию атомной массы.
8 класс, 9 класс Из истории возникновения химии
Химия (история возникновения)
Россия относится к самым уникальным странам. Именно в этой стране хорошо развивается современная культура, но и чтятся древние традиции русского народа. Традиции русского народа уходят глубоко не только в православие, но оказывается еще и в язычество.
На территории нашей страны живет множество самых разных народов. Всего их насчитывается около 190. Есть народы большие, такие как русские, татары, чеченцы, а есть и совсем крошечные, которых осталось лишь считанные сотни человек.
15 и 16 века являются временем заметных перемен в политическом строе и в культуре Европы, а также в росте экономики. Общество перестраивалось и проходило новые этапы развития, а именно в науке, литературе,
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
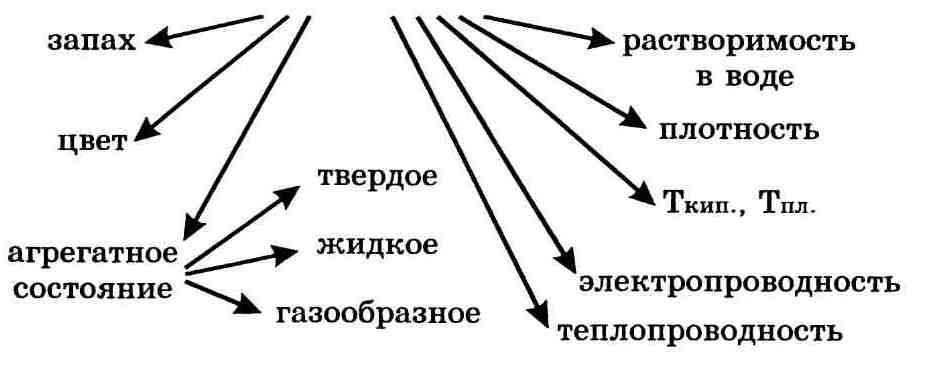
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.

Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов. Так какова же характеристика химического элемента, и чем он отличается от простого вещества?
Химический элемент: история открытия
В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
К моменту, когда Д. И. Менделеев открыл периодический закон, было известно всего 63 химических элементов. Открытие ученого не только привело к упорядоченной классификации химических элементов, а также помогло предсказать существование новых, еще не открытых элементов.
Что такое химический элемент?
Химическим элементом называют определенный вид атомов. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке.
Cуществует много видов систем, но общепринятой является Периодическая система химических элементов Д. И. Менделеева, которая является графическим выражением Периодического закона Д. И. Менделеева. Обычно используют короткую и длинную формы Периодической системы.
Что же является главным признаком, по которому атом относят к определенному элементу? Д. И. Менделеев и другие ученые-химики XIX века считали главным признаком атома массу как наиболее стабильную его характеристику, поэтому элементы в Периодической системе расположены в порядке возрастания атомной массы (за немногим исключением).
По современным представлениям, главным свойством атома, относящим его к определенному элементу, является заряд ядра. Таким образом, химический элемент – это вид атомов, характеризующихся определенным значением (величиной) части химического элемента – положительного заряда ядра.
Из всех существующих 118 химических элементов большую часть (около 90) можно обнаружить в природе. Остальные же получены искусственно с помощью ядерных реакций. Элементы 104-107 были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы делятся на металлы и неметаллы. Более 80 элементов относятся к металлам. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
Содержание различных элементов в природных объектах колеблется в широких пределах. 8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий).
Некоторые элементы объединяются в группы, такие как органогены (углерод, кислород, водород, азот), щелочные металлы (литий, натрий, калий и т.д.), лантаноиды (лантан, церий и т.д.), галогены (фтор, хлор, бром и т.д.), инертные элементы (гелий, неон, аргон)
Что мы узнали?

Данный видеофрагмент раскрывает сущность основных химических понятий, вводит учащихся в мир химии. Рисунки и наглядные примеры будут необходимы для лучшего усвоения материала. Знакомство с химией станет ярким и красочным, что привлечёт внимание всех учеников. Здесь подробно описаны физические свойства веществ, что является необходимым условием описания свойств любого вещества.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Предмет химии. вещества"
Химия играет огромную роль в жизни современного человека, как в его быту, так и в промышленности. Химия – это наука о веществах, их свойствах и превращениях.
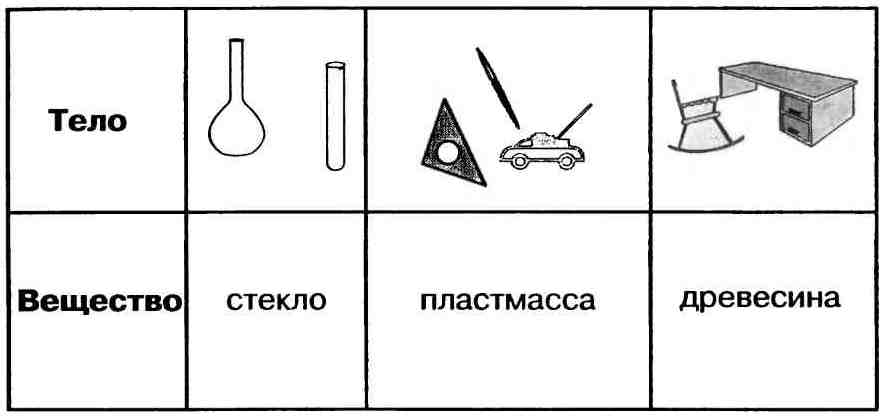
На рисунке представлены физические тела. Их объединяет одно свойство – все они сделаны из стекла. Стекло и является веществом. Поэтому можно сделать вывод, что вещество – это то, из чего состоят физические тела.
Физические тела

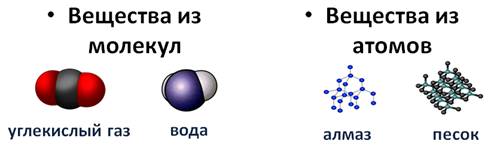
Некоторые вещества состоят из молекул. Такие как молекула углекислого газа, молекула воды, а такие вещества как алмаз или песок, состоят из атомов.
Строение вещества
Представьте, атомы настолько малы, что на человеческом волосе их поместиться несколько миллиардов. Однако видов атомов всего 114. Определенный вид атомов называется химическим элементом.
Из таких вот отдельных изолированных атомов состоят такие вещества как ксенон, аргон, неон, криптон, гелий. Их еще называют благородными или инертными газами, потому что их атомы не соединяются друг с другом и почти не соединяются с атомами другими химических элементов.
Благородные газы

Атомы водорода могут существовать поодиночке, могут соединяться в молекулы по два атома, а могут соединяться с другими атомами, как в молекуле воды они соединены с кислородом.
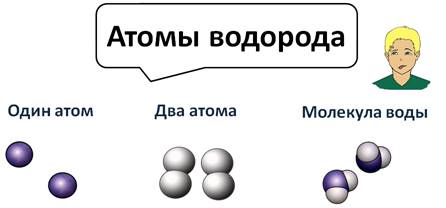
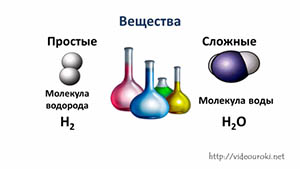
Таким образом, если вещество состоит из атомов одного вида, то оно называется простым. А если вещество состоит из атомов разных химических элементов, то оно называется сложным, или химическим соединением. Например, это молекула воды – Н2О.

Все вещества отличаются друг от друга своими свойствами. Свойства – это признаки, по которым вещества отличаются друг от друга.
Следует различать физические и химические свойства веществ. С химическими свойствами мы познакомимся позже.
Физические свойства вещества:
1. Агрегатное состояние (их три: газообразное, жидкое и твёрдое).
3. Запах (есть или нет).
4. Твердость (описывается по шкале Мооса).
5. Плотность (больше или меньше единицы).
6. Температура кипения и плавления (эти данные указаны в таблицах в учебнике).
7. Электропроводность и теплопроводность (в основном это свойство характерно для металлов).
8. Растворимость в воде (т.е. растворяется вещество или не растворяется в воде).
9. Пластичность, ковкость (это свойство тоже характерно в основном для металлов).
Зная различные свойства веществ, человек может использовать их с пользой для себя. Рассмотрим пример использования алюминия.
Благодаря легкости и прочности его используют в самолёто- и ракетостроении. Лёгкость и хорошую электропроводность алюминия используют для изготовления электрических проводов, его теплопроводность и неядовитость – при изготовлении алюминиевой посуды, неядовитость и пластичность даёт возможность применять алюминий для изготовления фольги, а такое его свойство, как способность гореть ослепительным пламенем позволят его использовать при производстве бенгальских огней.
Читайте также:

