Сообщение о химических элементах 9 класс
Обновлено: 06.07.2024
Символ химического элемента состоит из одной или двух букв. Как правило, используются первые буквы его латинского названия.
Названия и символы \(118\) химических элементов приведены в периодической таблице. Более \(20\) элементов получены искусственно с помощью сложных физических методов. Таблица постоянно дополняется новыми элементами.
Атомы химических элементов соединяются друг с другом в разных комбинациях и образуют огромное количество природных и синтетических веществ.
Ключевые слова конспекта:Химические элементы, знаки химических элементов.
Например, железо и сера свои свойства в смеси сохраняют. Поэтому можно утверждать, что смесь порошка железа с порошком серы состоит из двух простых веществ — железа и серы. Так как химическое соединение сульфид железа образуется из простых веществ — железа и серы, то хочется утверждать, что сульфид железа тоже состоит из железа и серы. Но познакомившись со свойствами сульфида железа, мы понимаем, что этого утверждать нельзя. Это сложное вещество, образовавшееся в результате химического взаимодействия, обладает совершенно другими свойствами, нежели исходные вещества. Потому что в состав сложных веществ входят не простые вещества, а атомы определённого вида.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — это определённый вид атомов.
Так, например, все атомы кислорода независимо от того, входят ли они в состав молекул кислорода или в состав молекул воды, — это химический элемент кислород. Все атомы водорода, железа, серы — это соответственно химические элементы водород, железо, сера и т. д.
Химические элементы и образуемые ими простые вещества можно разделить на две большие группы: металлы и неметаллы. Примерами металлов служат железо, алюминий, медь, золото, серебро и др. Металлы пластичны, имеют металлический блеск, хорошо проводят электрический ток. Примерами неметаллов служат сера, фосфор, водород, кислород, азот и др. Свойства неметаллов разнообразны.
Знаки химических элементов
Каждый химический элемент имеет своё название. Для упрощённого обозначения химических элементов используют химическую символику. Химический элемент обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента. Так, водород (лат. hydrogenium — гидрогениум) обозначают буквой Н, ртуть (лат. hydrargyrum — гидраргирум) — буквами Hg и т. д. Предложил современную химическую символику шведский химик Й. Я. Берцелиус в 1814 году
Сокращённые буквенные обозначения химических элементов — это знаки (или символы) химических элементов. Химический символ (химический знак) обозначает один атом данного химического элемента.

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
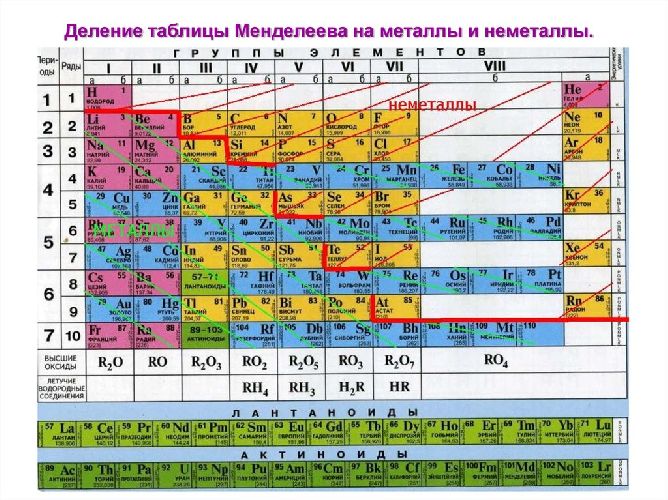
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Большинство химических элементов относится к металлам (химия, 9 класс). Под этим материалом подразумеваются простые вещества, наделенные определенным комплексом свойств: кристаллическая структура, блеск, высокая теплопроводность и электропроводимость, а также ее зависимость от нагрева, способность легко отдавать электроны, ковкость, тягучесть, склонность к образованию сплавов.
Большинство химических элементов относится к металлам (химия, 9 класс). Под этим материалом подразумеваются простые вещества, наделенные определенным комплексом свойств: кристаллическая структура, блеск, высокая теплопроводность и электропроводимость, а также ее зависимость от нагрева, способность легко отдавать электроны, ковкость, тягучесть, склонность к образованию сплавов.

Общая характеристика
В атомах металлов наружные электроны удерживаются довольно слабо (если сравнивать с другими, неметаллическими, элементами). В химических реакциях металлы обычно выступают в качестве восстановителей — это объясняется тем, что они имеют низкую степень ионизации.
Для металлов и их сплавов характерна металлическая связь, то есть та, что возникает за счет перекрытия валентных электронов. Это дает возможность осуществлять взаимные атомные смещения без нарушения кристаллической решетки (это объясняет тот факт, что эти вещества более пластичные по сравнению с неметаллами).

- Щелочные (примером таких выступают натрий Na, калий K, цезий Cs, франций Fr и прочие).
- Щелочноземельные — кальций Ca, стронций Sr, барий Ba.
- Переходные — медь Cu, серебро Ag, золото Au. Эта группа — самая многочисленная, она насчитывает 38 веществ.
- Легкие — алюминий Al, олово Sn, титан Ti.
- Полуметаллы — кремний (Si), бор (B), мышьяк (As), сурьма (Sb).
- Лантаноиды — лантан (La), лютеций (Lu), скандий, иттрий.
- Актиноиды (они до конца не изучены) — торий, плутоний, уран, нептуний.
Примечательно, что такие элементы, как магний и бериллий, нельзя отнести ни к одной из групп — их свойства отличаются от характеристик прочих металлов. Например, при нормальных условиях они устойчивы к воздействию воды и воздуха, потому что имею тончайшую оксидную пленку по всей своей поверхности.
Большинство металлов при нормальных условиях находятся в твердом состоянии. Но бывают исключения: например, ртуть и франций (условно) при комнатной температуре и обычном атмосферном давлении.
Твердость у всех элементов отлична. Температура плавления колеблется от -39°C (Hg) до 3410 °C (W). В зависимости от плотности они делятся на легкие (Li) и тяжелые (Os, Ir).
Нахождение в природе и получение

Металлы (общая формула записывается как Me) могут присутствовать в природе как самородки. Это характерно для тех, что практически не окисляются на воздухе (пример: платина, золото, серебро, реже — ртуть и медь).
Активные Me в природе находятся в виде солей (нитраты, карбонаты, сульфаты, хлориды), оксидов. Минералы входят в состав руд и горных пород.
В промышленности Me получают восстановлением соответствующих руд. Один из основных методов получения Me — флотация (определенный способ обогащения руд, основанный на способности минералов удерживаться на межфазовой поверхности). В этом случае руду, содержащую необходимые элементы, переводят в определенную (единую) форму: например, в оксид: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2. Полученные окислы затем восстанавливают. Сделать это возможно несколькими способами:

- Металлотермия — восстановление элемента другим, более активным (с точки зрения химии): Cr2O3 + 2Al → 2Al2O3 + 2Cr; CuO + C → Cu + CO.
- Термическое разложение. Fe (CO)5 (пентакарбонилжелезо)→ Fe + 5CO. Такой способ применяется, если нужно получить высокочистый элемент.
- Электролиз. Используется для получения щелочных металлов: 2NaCL → 2Na + Cl2; 2LiCl → 2Li + Cl2.
- Вытеснение более активным металлом менее активного из раствора соли. CuSO4 + Fe → FeSO4 + Cu.
Химические особенности
Все Me в свободном состоянии — восстановители, их степени окисления имеют положительное значение. Химическая активность этих веществ зависит от двух величин: электродного потенциала и энергии ионизации (в таблице Менделеева это значение увеличивается слева направо). Типичные реакции:

- Взаимодействие с хлором и фтором: Cu + Cl2 → CuCl2.
- Окисление кислородом (протекает не слишком энергично): 4Li + O2 → 2Li2O; K + O2 → KO2 (название этого соединения — надпероксид калия).
- С серой протекают только при повышенных температурах: Fe + S → FeS. Золото и платина в подобных реакциях не участвуют.
- Участие водорода приводит к образованию гидридов: Mg + H2 → MgH2; 2Na + H2 → 2NaH.
- С углеродом взаимодействуют только активные металлы. 2Na + 2C → Na2C2 (ацетиленид натрия); Na2C2 + 2H2O → 2NaOH + C2H2 (ацетилен). 4Al + 3C → Al4C3 (метанид алюминия); Al4C3 + 12H2O → 3CH4 (метан) + 4Al (OH)3.
- Реакции замещения с кислотами. В этом случае все будет зависеть от того, какая активность у элемента. Например: Zn + H2SO4 (разб) → ZnSO4 + H2; Zn + H2SO4 (конц) → ZnSO4 + S + H2O.
- Вода будет давать реакцию по такой схеме: 2Na + 2H2O → 2NaOH + H2.
- Возможны реакции с растворами солей: Fe + CuSO4 → FeSO4 + Cu.
Кроме того, металлы способны образовывать комплексы. Это происходит за счет наличия свободных электронных орбиталей.
Способность к комплексообразованию зависит от величины заряда и его радиуса: чем выше первый показатель и ниже второй, тем сильнее способность.
Названия таких соединений подчиняются определенной структуре: сначала указывается наименование аниона, а затем — катиона, из которых состоит вещество. Например: [Li (H2O)4]NO3 — нитрат тетрааквалития.
Образование сплавов

Примечательно, что сплавы бывают не только состоящие исключительно из металлов — в них часто присутствуют и неметаллические вещества. При этом они могут не просто смешиваться механически, но и образовывать атомные соединения. Такие сплавы будут значительно отличаться по своим физическим и химическим свойствам от элементов-исходников. Кроме того, существует возможность заранее задавать свойства, которыми будет обладать полученный материал:


- Чугун — сплав Fe с C, в котором присутствуют легирующие добавки. Используется для изготовления деталей, различных предметов в тяжелой промышленности (машиностроение, автомобилестроительная индустрия и прочие).
- Латунь — медь + цинк. Материал устойчив к коррозии, легко сваривается со сталью. Благодаря своему цвету (золотистый) широко применяется для изготовления фурнитуры, художественных изделий.
- Амальгама — металлическая смесь, содержащая ртуть. Применяется для золочения металлсодержащих изделий, в производстве зеркал, люминесцентных ламп.
- Сталь — смесь железа с углеродом (но второго компонента меньше, чем в чугуне — всего до 1,8%), также с использованием легирующих добавок, в качестве которых используются Ni, P, Si, Mn, и некоторые другие. Используется для изготовления различных инструментов (слесарных, столярных), в строительстве, судоремонтной и авиационной промышленности.
- Мельхиор — медь и никель. Применяется для изготовления посуды, бюджетных ювелирных и художественных изделий.
- Бронза — медь, олово и легирующие добавки. Используется в машиностроении, ракетостроении, авиационной индустрии, для изготовления художественных изделий и прочего.
- Дюралюминий (дюраль) — сплав Al + Cu + Mg + Mn. Используется в авиастроении, производстве скоростных поездов, и прочих отраслях машиностроения.
Поэтому изучение этих элементов, проведение опытов с различными сплавами, еще долгое время будет являться одним из приоритетных направлений науки и промышленности.
Читайте также:

