Сообщение о фторе и хлоре
Обновлено: 05.07.2024

Галогены. Элементы VIIA-группы. Хлор, фтор
Ключевые слова: галогены, VIIA-группа, хлор, фтор, бром, йод, характеристика элемента, строение галогенов, получение хлора.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ХЛОР
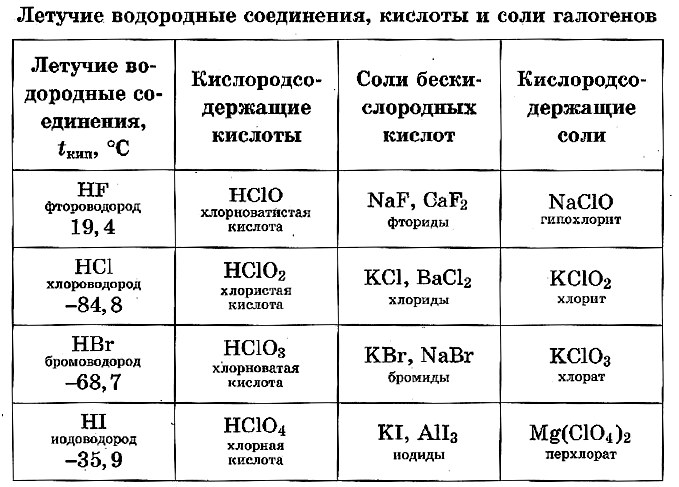
Высший оксид хлора – оксид хлора (VII) Cl2О7 – кислотный оксид, высшим гидроксидом хлора является хлорная кислота НСlO4 (сильная кислота).
Водородное соединение хлора – хлороводород НCl (газ при обычных условиях), его водный раствор – соляная кислота, сильный электролит.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ФТОР
В атоме фтора нет вакантных орбиталей на втором энергетическом уровне для перехода атома в возбуждённое состояние. Переход на вакантные орбитали третьего энергетического уровня потребовал бы слишком больших затрат энергии, следовательно, фтор может быть только одновалентен.
Электроотрицательность фтора среди других элементов максимальна (∼4,0 по шкале Полинга). Следовательно, для фтора невозможны положительные степени окисления. Возможные степени окисления фтора: 0 (F2) и –1 (HF, KF и т. д.).
СТРОЕНИЕ ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ
Галогенам не присуща аллотропия, каждому элементу – галогену (Hal) соответствует одно простое вещество Наl2. Галогены – вещества молекулярного строения.
При обычных условиях фтор F2 – зеленовато–жёлтый газ; хлор Cl2 – жёлто–зелёный газ; бром Вг2 – красно–бурая жидкость, примерно в 3 раза тяжелее воды; йод I2 – фиолетово–чёрные кристаллы с металлическим блеском. Все галогены обладают характерным запахом.
Хлор, бром, йод умеренно растворимы в воде, их растворы называются соответственно хлорной, бромной и йодной водой (фтор с водой реагирует).

ПОЛУЧЕНИЕ ХЛОРА
В промышленности хлор получают электролизом расплава поваренной соли.
Лабораторные способы получения хлора основаны на окислении хлора в соляной кислоте с помощью таких окислителей, как перманганат калия, дихромат калия или диоксид марганца. Приведём примеры этих реакций:
Конспект урока по химии «Галогены. Элементы VIIA-группы. Хлор, фтор «. Выберите дальнейшее действие:
Фтор – газ светло-зеленого цвета (tпл = — 220 о С tкип = — 188 о С). По поводу истинного цвета фтора возникало немало разногласий: из-за необычайно высокой реакционной способности редко кто осмеливался получать его в достаточном количестве в прозрачном сосуде. Но последующие исследования подтвердили окраску фтора, о которой сообщал ещё Муассан.

Фтор взаимодействует почти со всеми простыми веществами, включая тяжелые инертные газы (Kr, Xe). В его атмосфере загорается даже стекловата (SiO2 + 2F2 = 4HF + O2) и вода (2H2O + 2F2 = 4HF + O2). При этом наряду с кислородом в продуктах реакции присутствуют фториды кислорода OF2, O2F2 и озон O3.
Фтор используют для получения некоторых ценных фторпроизводных углеводородов, обладающих уникальными свойствами, как, например, смазочных веществ, выдерживающих высокую температуру, пластической массы, стойкой к химическим реагентам (тефлон), жидкостей для холодильников (фреонов).
В организме человека фтор содержится в виде нерастворимых фторидов, главным образом фторапатита, и входит в состав костной ткани и зубной эмали. Для укрепления эмали рекомендуют использовать специальные фторсодержащие зубные пасты. С этой же целью фторируют питьевую воду, доводя концентрацию фторид-ионов примерно до 1 мг/л. Однако следует помнить, что в больших количествах растворимые в воде фториды ядовиты.
Фториды – соли слабой плавиковой кислоты HF, представляющей собой водный раствор фтороводорода. Молекулы HF в плавиковой кислоте связаны друг с другом настолько прочными водородными связями, что ее состав правильнее было бы передать формулой (HF)n. Поскольку эта кислота (наряду с газообразным фтороводородом) обладает уникальной способностью разъедать стекло, её хранят в полиэтиленовой, свинцовой или парафиновой посуде.
Применение фтористого водорода довольно разнообразно. Безводный HF используют, главным образом, при органических синтезах, а плавиковую кислоту – при получении фторидов, травления стекла, удалении песка с металлических отливок, при анализах минералов и т.д.
Хлор

Физические свойства
При обычных условиях хлор – газ жёлто-зеленого цвета с резким запахом. Он в 2,5 раза тяжелее воздуха, ядовит. Вдыхание даже небольших количеств хлора вызывает раздражение дыхательных путей и кашель. В одном объёме воды при 20 о С растворяется 2,5 объема хлора. Раствор хлора в воде называется хлорной водой.
Нахождение в природе
Хлор в природе в свободном состоянии практически не встречается. Широко распространены его соединения: каменная соль NaCl, сильвинит KCl ∙ NaCl и карналлит KCl ∙ MgCl2. Большое количество хлоридов содержится в морской воде. Хлор входит в состав зеленого вещества растений – хлорофилла.

Получение
В промышленности хлор получают электролизом водного раствора или расплава хлорида натрия:
В лаборатории хлор можно получить действием концентрированной соляной кислоты (при нагревании) на различные окислители, такие как оксид марганца (IV) MnO2, перманганат калия KMnO4, бертолетова соль KClO3 и др.:
Химические свойства
Хлор – химически активное вещество, взаимодействует с простыми и сложными веществами.
Взаимодействие с простыми веществами
Как сильный окислитель хлор реагирует:
в) с некоторыми менее электроотрицательными неметаллами:
С кислородом и азотом хлор непосредственно не взаимодействует.
Взаимодействие со сложными веществами
а) Реакция взаимодействия хлора с водой идет в две стадии. На первой стадии процесса образуются две кислоты – соляная HCl и хлорноватистая HClO:
Затем происходит процесс разложения хлорноватистой кислоты:
HClO = HCl + [O]→ атомарный кислород
Образованием атомарного кислорода объясняется окисляющее и отбеливающее действие хлора в воде. В хлорной воде погибают микроорганизмы. Органические красители, помещенные в хлорную воду, обесцвечиваются.
б) Обратите внимание, что с кислотами хлор не реагирует.
в) Взаимодействие хлора с растворами щелочей происходит по-разному в зависимости от условий протекания реакции:
на холоде: Cl2 + 2NaOH = NaCl + NaClO + H2O
при нагревании: 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
г) Хлор взаимодействует с бромидами и йодидами металлов:
С фторидами металлов хлор не реагирует, так как его окислительная способность ниже окислительной способности фтора:
д) Хлор легко взаимодействует со многими органическими веществами, например с метаном, бензолом и др.:
Хлороводород и соляная кислота
Хлороводород HCl – бесцветный газ с резким запахом, в воде хорошо растворяется, при 0 о С в 1 л воды растворяется около 400 л HCl. Раствор хлороводорода в воде имеет кислую реакцию и называется хлороводородной, или соляной кислотой. Соляная кислота является сильной кислотой, обладает всеми общими свойствами кислот.
Соляная кислота – активный химический реагент, она взаимодействует:
HCl + NaOH = NaCl + H2O
Последняя реакция является качественной реакцией на хлорид-ион.
Хлороводород можно получать:
а) прямым синтезом водорода и хлора;
б) действием концентрированной серной кислоты на твердые хлориды, например:
(Отметим, что аналогичным способом можно получать HF, но нельзя получить HBr и HI, так как они являются сильными восстановителями и окисляются серной кислотой до свободных брома и йода).
Применение хлора и хлороводорода. Физиологическая роль соляной кислоты в организме человека
Хлор используется для отбеливания бумаги и тканей, в производстве пластмасс, для дезинфекции питьевой воды. Хлор является исходным веществом при получении таких важнейших продуктов, как хлорная известь, фосген, хлороформ, определенные виды моющих средств, ядохимикатов, каучуков и т.д. Огромное количество хлора используется для синтеза хлороводорода, растворением которого в воде получают соляную кислоту.
В организме человека соляная кислота вырабатывается клетками слизистой желудка. Она играет важную физиологическую роль, так как способствует перевариванию белков и убивает различные болезнетворные бактерии.
Общая характеристика галогенов
От F к At (сверху вниз в периодической таблице)
Увеличивается
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, они содержат 7 электронов на внешнем слое ns 2 np 5 :
Br – 3d 10 4s 2 4p 5 ;
I — 4d 10 5s 2 5p 5 ;
At – 4f 14 5d 10 6s 2 6p 5
Электронная конфигурация фтора и хлора

Электронная конфигурация брома и йода

Нахождение в природе галогенов
Галогены являются химически активными веществами, в связи с чем, в природе они встречаются только в виде соединений. Их распространённость в земной коре снижается при увеличении атомного радиуса (от фтора к иоду). Например, содержание астата в земной коре исчисляется граммами.
Наиболее распространённые соединения фтора — флюорит CaF2, криолит Na3AlF6 и др., хлора — каменная соль (галит) NaCl, сильвин KCl и сильвинит KCl⋅NaCl.
Бром и иод не образуют индивидуальных минералов, но их соединения содержатся в морской воде и могут накапливаться водорослями.

Способы получения фтора
Фтор получают методом электролиза расплава гидрофторида калия (смеси HF и KF):
Физические свойства фтора

Фтор при обычной температуре — зеленовато-жёлтый ядовитый газ, с резким запахом, очень реакционноспособный, хорошо растворим в жидких водороде и кислороде.
Химические свойства фтора
Фтор является самым сильным окислителем из всех простых веществ. Непосредственно он не взаимодействует только с N2, Не, Ne, Аr, а при нормальных условиях также и с O2.
Взаимодействие с простыми веществами
С кислородом
Реакция протекает при электрическом разряде (2100-2400 В, 25-30 мА), температуре от -196°C до -183°C и давлении 12 мм рт.ст. с образованием дифторида трикислорода (триоксодифторид, фторид озона) или фторида кислорода:
С галогенами (Cl, Br, I)
Фтор вступает в реакции с другими галогенами:
Например, Cl2 + F2 → 2ClF
С водородом
Взаимодействует с водородом со взрывом даже в темноте:
С серой
Реакция с серой протекает легко даже при сильном охлажлении:
С углеродом
Реакция окисления порошкообразного углерода сопровождается самовоспламенением последнего:
С азотом
При нагревании фтор реагирует и с азотом:
С фосфором
Фтор взаимодействует с P энергично (со взрывом) на свету и в темноте, даже при охлаждении жидким N2:
С кремнием
Взаимодействует с кремнием с образованием фторида кремния
C инертными газами
Окисляет ксенон, образуя фторид ксенона:
С металлами
При взаимодействии с металлами образуются фториды:
- К, Na, Pb, Feзагораются при обычной температуре на свету. С щелочными металлами реакция протекает со взрывом:
- Mg, Zn, Sn, Al, Ag, Cu и др. загораются на свету при слабом нагревании:
- с малоактивными металлами – Au, Pt реагирует при нагревании до 300-400°С
Взаимодействие со сложными веществами
С водой
Фтор активно разлагает воду с образованием таких соединений, как фториды кислорода OF2, O2F2; пероксид водорода Н2O2; кислород, озон, фтороводород:
С кислотами
- Взаимодействует с безводной азотной кислотой при комнатной температуре с образованием диоксида-гипофторита азота и фтороводорода:
- С серной кислотой образует гексафторид серы, фтороводород и кислород:
С щелочами и аммиаком
Фтор окисляет щелочи:
Реагирует с газообразным аммиаком:
С солями
Не взаимодействует
Взаимодействие фтора с водными растворами солей невозможны, т.к. он ступает в реакцию с водой.
С оксидами
Реагирует с оксидом кремния, который загорается в атмосфере F2:
Способы получения хлора
Промышленный способ
Электролиз расплавов или водных растворов хлоридов, чаще – NaCl.
- Электролиз расплава хлорида натрия:
A(+): 2Cl − ̶ 2e → Cl2 0
2Na + + 2Cl − → 2Na º + Cl2º
Таким образом, получаем:
- Электролиз раствора хлорида натрия.
A(+): 2Cl − ̶ 2e → Cl2 0
Таким образом, получаем:
Лабораторный способ
Окисление концентрированной HCI сильными окислителями:
Физические свойства хлора
Хлор Cl2 при обычной температуре – тяжелый, желто-зеленый газ с резким удушающим запахом.

Cl2 в 2,5 раза тяжелее воздуха, малорастворим в воде (~ 6,5 г/л); хорошо растворим в неполярных органических растворителях. В свободном состоянии встречается только в вулканических газах.
Химические свойства хлора
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, с образованием в устойчивые хлорид-ионы:
Взаимодействие с простыми веществами
С кислородом
Непосредственно не взаимодействует
С галогенами
Хлор взаимодействует с другими галогенами – более активные галогены окисляют менее активные. В зависимости от условий могут получиться различные соединения:
С водородом
Реакция с водородом при обычных условиях не протекает. Однако, при нагревании, УФ — освещении или электрическом разряде реакция протекает со взрывом:
Непосредственно не взаимодействует
С фосфором
Непосредственно не взаимодействует
С кремнием
2Cl2 + Si = SiCl4 (при нагревании)
С металлами
- Активные металлы самовоспламеняются и горят в атмосфере сухого газообразного хлора:
- Окисление малоактивных металлов происходит легче влажным хлором или его водными растворами:
Взаимодействие со сложными веществами
Окисляет сложные вещества:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кипячении)
С водой
При растворении хлора в воде вступает в реакцию диспропорционирования (самоокисления-самовосстановления), с образованием хлорноватистой кислоты:
С водными растворами щелочей
При взаимодействии с щелочами хлор диспропорционирует с образованием солей, состав которых зависит от условий проведения реакции:
- с холоднымраствором щелочи образуются хлорид и гипохлорит:
- с горячимраствором щелочи образуются хлорид и хлорат:
- Хлор также растворяется в холодном растворе гидроксида кальция:
Эти реакции имеют важное практическое значение, приводят к получению гипохлоритов — КClO3 и Са(ClO)2; хлората калия (бертолетова соль) — КClO3
С солями
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов:
HC ≡ CH + 2Cl2 → Cl2HC — CHCl2 1,1,2,2-тетрахлорэтан
Способы получения брома
Промышленный способ
- Исходное сырьё для получения брома — морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Br-
Бром втесняют при помощи хлора:
Далее бром отгоняют из раствора водяным паром или воздухом.
Лабораторный способ
- В лаборатории для получения брома используют сильные окислители:
Физические свойства брома

В обычных условиях бром – красно-бурая жидкость с резким зловонным запахом. При Т=-7,2°C жидкий бром застывает, образуя красно-коричневые игольчатые кристаллы.
Пары брома жёлто-бурого цвета, Ткип = 58,78°C.
В воде бром растворяется лучше других галогенов (3,58 г брома в 100 г H2O при 20°C). Хорошо растворим во многих органических растворителях.
Химические свойства брома
Химические свойства брома сходны с хлором. Различаются только условия протекания реакций.
Взаимодействие с простыми веществами
С металлами
Жидкий бром сильный окислитель. Например, железо и алюминий самовозгораются при соприкосновении с бромом даже при обычной температуре.
С водородом
Взаимодействие брома с водородом происходит лишь при повышенной температуре. Реакция эндотермической и обратимой.
С азотом, углеродом, кислородом и благородными газами
Непосредственно не взаимодействует
С галогенами
Бром окисляется более активными галогенами:
Взаимодействие со сложными веществами
- диспропорционирует в водном растворе:
3BrO — ↔ BrO3 — + 2Br —
4BrO — ↔ BrO4 — + 3Br —
Обесцвечивание бромной воды
Обесцвечивание бромной воды – качественная реакция на многие неорганические и органические соединения:
- в воде SO2 и H2S в газообразном и растворенном виде, а также растворимые сульфиты и сульфиды реагируют с бромной водой, обесцвечивая ее:
- Обесцвечивание бромной воды непредельными органическими соединениями:
- Фенол и анилин также легко взаимодействуют с бромной водой:
Способы получения йода
Промышленный способ
- Йод, также как и бром, извлекают из морской воды, соленых озер, подземных рассолов и буровых вод, где он содержится в виде I — .
- Получение свободного йода с помощью различных окислителей, чаще всего газообразного хлора:
Лабораторный способ
- Йод можно получить также как и хлор или бром действием различных окислителей (КМnО4, МnО2, КСlO3, КВrО3, FеСl3 и СuSO4) на иодоводородную кислоту:
2 FеC3 + 2 НI = 2 FeCl2 + I2 + 2 НСl
Физические свойства йода
Свободный йод I2 при обычной температуре — черно-серое с фиолетовым оттенком кристаллическое вещество с металлическим блеском. Легко возгоняется. Пары йода имеют своеобразный запах и очень ядовиты.

Среди галогенов I2 обладает самой меньшей растворимостью в воде, однако он хорошо растворим в спирте и других органических растворителях.
Химические свойства йода
Химическая активность йода – наименьшая по сравнению с другими галогенами. Со многими элементами йод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы).
Йод-крахмальная реакция
Обнаружить I2 даже в самой минимальной концентрации можно с помощью раствора крахмала, который при наличии I2 окрашивается в грязно-синий цвет.
Йод-крахмальная реакция используется при качественном обнаружении йода, а также его количественного анализа
Взаимодействие с простыми веществами
С водородом
Реакция обратима и возможна только при высокой температуре:
С металлами
При добавлении капли воды в качестве катализатора цинк, железо и алюминий в смеси с порошком йода горят, образуя йодиды:
С азотом, углеродом, кислородом
Непосредственно не взаимодействует
Взаимодействие со сложными веществами
С водой
Частично реагирует с водой (реакция диспропорционирования):
С щелочью
Диспропорционирует в водном растворе щелочи:
C аммиаком
C аммиаком образует аддукт нитрид трииодида:
С иодидами щелочных металлов
Молекулы галогенов присоединяются к иодидам щелочных металлов с образованием полииодидов (периодидов):
С окислителями
Йод проявляет восстановительные свойства в реакциях с сильными окислителями:
C восстановителями
Иод менее сильный окислитель, чем фтор, хлор и бром. Восстановители, такие как H2S, Na2S2O3 и др. восстанавливают его до иона I − :
К галогенам относят фтор, хлор, бром, йод и астат. Они образуют VIIА-группу Периодической системы химических элементов.

Содержание галогенов в земной коре снижается от фтора к астату. Причем, если фтор, бром и йод можно отнести к распространенным химическим элементам, то содержание астата в земной коре крайне мало. Галогены входят в состав многих минералов. Исключение составляет астат. Астат обнаружен в продуктах радиоактивного распада урана.

Галогены – элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.

Физические свойства галогенов: F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.


Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:

Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде. Все галогены в свободном состоянии – окислители . Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель . Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
1. Взаимодействие с ксеноном. Наибольшей химической активностью обладает фтор, это сильнейший окислитель, который реагирует даже с инертными газами:
2. Взаимодействие с металлами. Все галогены взаимодействуют практически со всеми простыми веществами, наиболее энергично протекает реакция с металлами. Фтор при нагревании реагирует со всеми металлами, включая золото и платину, на холоде взаимодействует с щелочными металлами, свинцом и железом. Хлор, бром и йод при обычных условиях реагируют со щелочными металлами, а при нагревании – с медью, железом и оловом. В результате взаимодействия образуются галогениды, которые являются солями:
3. Взаимодействие с водородом. При обычных условиях фтор реагирует с водородом в темноте со взрывом, взаимодействие с хлором протекает на свету, бром и йод реагируют только при нагревании, причем реакция с йодом обратима.
4. Взаимодействие с неметаллами. С кислородом и азотом галогены непосредственно не взаимодействуют, реагируют с серой, фосфором, кремнием, проявляя окислительные свойства, химическая активность у брома и йода выражена слабее, чем у фтора и хлора:
5. Взаимодействие с водой. Галогены реагируют со многими сложными веществами. С водой фтор и остальные галогены реагируют по-разному:
Эта реакции является реакцией диспропорционирования, где галоген одновременно является окислителем и восстановителем.
10. Взаимное замещение галогенов. Реакционная способность галогенов снижается при переходе от фтора к йоду, поэтому предыдущий элемент вытесняет последующий из галогеноводородных кислот и их солей:



История открытия:
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты.
Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Название элемента происходит от греческого clwroz - "зелёный".

Нахождение в природе, получение:
Природный хлор представляет собой смесь двух изотопов 35 Cl и 37 Cl. В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2·6H2O, карналлита KCl·MgCl2·6Н2O, каинита KCl·MgSO4·3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В промышленных масштабах хлор получают вместе с гидроксидом натрия и водородом при электролизе раствора поваренной соли:
Для рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений используется процесс Дикона (каталитическое окисление хлороводорода кислородом воздуха):
4HCl + O2 = 2H2O + 2Cl2
В лабораториях обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Физические свойства:
При нормальных условиях хлор - жёлто-зелёный газ с удушающим запахом. Хлор заметно растворяется в воде ("хлорная вода"). При 20°C в одном объеме воды растворяется 2,3 объема хлора. Температура кипения = -34°C; температура плавления = -101°C, плотность (газ, н.у.) = 3,214 г/л.

В отсутствии влаги хлор довольно инертен, но в присутствии даже следов влаги активность его резко возрастает. Он хорошо взаимодействует с металлами:
Полученные растворы называются жавелевой водой, которая, как и хлорная вода, обладает сильными окислительными свойствами благодаря наличию иона ClO - и применяется для отбеливания тканей и бумаги. С горячими растворами щелочей хлор образует соответствующие соли соляной и хлорноватой кислот:
При нагревании хлор легко взаимодействует со многими органическими веществами. В предельных и ароматических углеводородах он замещает водород, образуя хлорорганическое соединение и хлороводород, а к непредельным присоединяется по месту двойной или тройной связи.
При очень высокой температуре хлор полностью отбирает водород у углерода. При этом образуются хлороводород и сажа. Поэтому высокотемпературное хлорирование углеводородов всегда сопровождается сажеобразованием.
Хлор - сильный окислитель, поэтому легко взаимодействует со сложными веществами, в состав которых входят элементы, способные окисляться до более высокого валентного состояния:
Важнейшие соединения:
Хлороводород HCl - бесцветный газ, на воздухе дымит вследствие образования с парами воды капелек тумана. Обладает резким запахом, сильно раздражает дыхательные пути. Содержится в вулканических газах и водах, в желудочном соке. Химические свойства зависят от того, в каком состоянии он находится (может быть в газообразном, жидком состоянии или в растворе). Раствор HCl называется соляной (хлороводородной) кислотой. Это сильная кислота, вытесняет более слабые кислоты из их солей. Соли - хлориды - твёрдые кристаллические вещества с высокими температурами плавления.
Ковалентные хлориды - соединения хлора с неметаллами, газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства, как правило легко гидролизующиеся водой с образованием соляной кислоты:
Оксид хлора(I) Cl2O., газ буровато-желтого цвета с резким запахом. Поражает дыхательные органы. Легко растворяется в воде, образуя хлорноватистую кислоту.
Хлорноватистая кислота HClO. Существует только в растворах. Это слабая и неустойчивая кислота. Легко разлагается на соляную кислоту и кислород. Сильный окислитель. Образуется при растворении хлора в воде. Соли - гипохлориты, малоустойчивы (NaClO*H2O при 70 °C разлагается со взрывом), сильные окислители. Широко используется для отбеливания и дезинфекции хлорная известь, смешанная соль Ca(Cl)OCl
Хлористая кислота HClO2, в свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается. Кислота средней силы, соли - хлориты, как правило, бесцветны и хорошо растворимы в воде. В отличие от гипохлоритов, хлориты проявляют выраженные окислительные свойства только в кислой среде. Наибольшее применение (для отбелки тканей и бумажной массы) имеет хлорит натрия NaClO2.
Оксид хлора(IV) ClO2, - зеленовато-желтый газ с неприятным (резким) запахом, .
Хлорноватая кислота , HClO3 - в свободном виде нестабильна: диспропорционирует на ClO2 и HClO4. Соли -хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния. Это сильные окислители, в смеси с восстановителями взрывоопасны. Хлорат калия (бертолетова соль) - KClO3, использовалась для получения кислорода в лаборатории, но из-за высокой опасности её перестали применять. Растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Хлорная кислота HClO4, в водных растворах хлорная кислота - самая устойчивая из всех кислородсодержащих кислот хлора. Безводная хлорная кислота, которую получают при помощи концентрированной серной кислоты из 72%-ной HСlO4 мало устойчива. Это самая сильная одноосновная кислота (в водном растворе). Соли -перхлораты, применяются как окислители (твердотопливные ракетные двигатели).
Применение:

Биологическая роль и токсичность:
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Ионы хлора жизненно необходимы растениям, участвуя в энергетическом обмене у растений, активируя окислительное фосфорилирование.
Хлор в виде простого вещества ядовит, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую Мировую войну.

1. В сосуде, имеется смесь водорода и хлора. Как изменится давление в сосуде при пропускании через смесь электрической искры?
В результате этой реакции общее количество молекул в газовой фазе не изменяется, поэтому давление в сосуде также остается неизменным.
2. Газ, выделившийся при действии 2,0 г цинка на 18,7 мл 14,6%-ной соляной кислоты (плотность раствора 1,07 г/мл), пропустили при нагревании над 4,0 г оксида меди (II). Чему равна масса полученной твердой смеси?
Найдем количества веществ в первой реакции: m(р-ра НСl) = 18,7 . 1,07 = 20,0 г. m(НСl) = 20,0 . 0,146 = 2,92 г. v(НСl) = 2,92/36,5 = 0,08 моль. v(Zn) = 2,0/65 = 0,031 моль. Цинк находится в недостатке, поэтому количество выделившегося водорода равно:v(Н2) = v(Zn) = 0,031 моль.
Во второй реакции в недостатке находится водород, поскольку v(СuО) = 4,0/80 = 0,05 моль. В результате реакции 0,031 моль СuО превратится в 0,031 моль Сu, и потеря массы составит:
3. Напишите уравнения реакций, которые могут происходить при действии концентрированной серной кислоты на все твердые галогениды калия. Возможны ли эти реакции в водном растворе?
При действии концентрированной серной кислоты на фторид и хлорид калия при нагревании выделяются, соответственно,фтороводород и хлороводород:
Бромоводород и иодоводород — сильные восстановители и легко окисляются серной кислотой до свободных галогенов, при этом НBrвосстанавливает серную кислоту до SО2, а НI (как более сильный восстановитель) — до Н2S:
В водном растворе серная кислота уже не является сильным окислителем. Кроме того, все галогеноводородные кислоты — сильные (за исключением плавиковой кислоты), и серная кислота не может вытеснять их из солей. В водном растворе возможна единственная обменная реакция:
Читайте также:

