Сообщение о аллотропных модификациях неметаллов
Обновлено: 19.05.2024
Аллотропия, это
Термин вошел в обиход с 1841 благодаря шведскому ученому, И. Я. Берцелиусу, в целях обозначения различных форм проявления одного и того же химического элемента.
Аллотропия химических элементов может проявляться в виде:
- аллотропии состава, когда различно число атомов в молекуле,
- аллотропии формы, когда различны строения кристаллических решеток.
Аллотропные преобразования
Химические элементы, образующие различные простые вещества и встречающиеся в природе, называются аллотропными формами химического элемента.
Химические элементы, образующие различные простые вещества под воздействием изменения окружающих условий, например, температура и давление, называются аллотропными модификациями химического элемента.
Не все химические элементы обладают свойством аллотропии.
Установлено, что аллотропией обладают химические элементы с высокой степенью окисления и способностью атомов к образованию гомоцепных структур.
Поэтому аллотропные преобразования в основном наблюдаются у неметаллов (за исключением галогенов и инертных газов), а также у полуметаллов.
Аллотропные преобразования металлов в природе встречаются намного реже. Только 28 металлов при атмосферном давлении имеют аллотропные формы и 6 образуют аллотропные модификации при их технологической обработке.
Химия аллотропных переходов
Преобразования химического элемента происходят при химическом переходе его атомного или молекулярного состояния из одной формы в другую. Эти переходы могут происходить при изменении окружающих условий, например:
- при нормальном давлении и изменении температуры;
- при изменении давления при неизменной температуре;
- при одновременном изменении давления и температуры.
Эти преобразования могут носить обратимый (энантиотропный) характер или необратимый (монотропный).
Примеры преобразований:
-
энантиотропный переход — превращение ромбической серы (α-S) в моноклинную (β-S) при нормальном давлении и температуре 95,6 °C. При снижении температуры ниже 95,6 °С происходит обратный переход моноклинной формы в ромбическую.
- монотропный переход — модификация белого фосфора P4 в чёрный фосфор при температуре 200 °C и давлении 1,25 ГПа. Возвращение температуры и давления к исходным условиям не приводит к обратному переходу.
У некоторых химических элементов аллотропные переходы могут чередоваться.
Примером является олово.
Белое олово (β-Sn) в обычных условиях пластичное, имеет тетрагональную кристаллическую решетку и устойчиво.
Белое олово при повышении температуры выше 173 °C, превращается в хрупкую форму (γ-Sn). Превращение происходит энантиотропно.
Белое олово при понижении температуры ниже 13.2 °C, превращается в серое олово (α-Sn) порошкообразное с кубической алмазоподобной решёткой. Превращение происходит монотропно.
Некоторые химические элементы и их модификации
Неметаллы
-
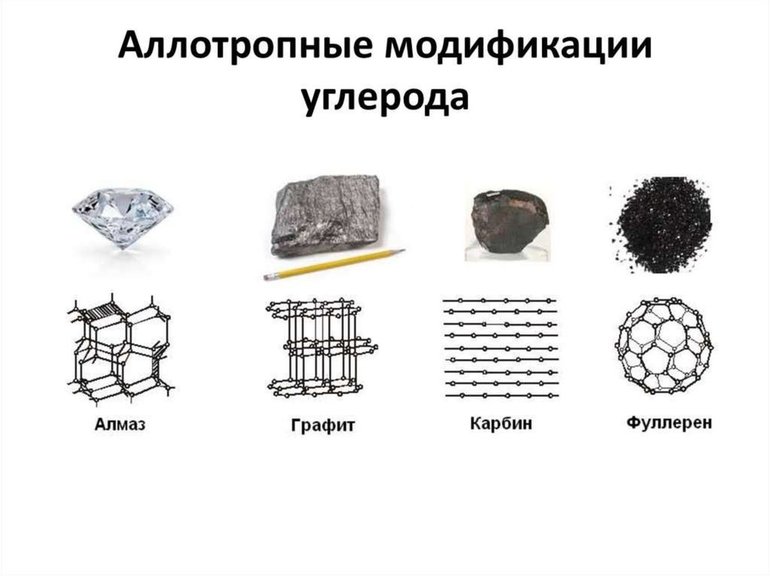
Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.
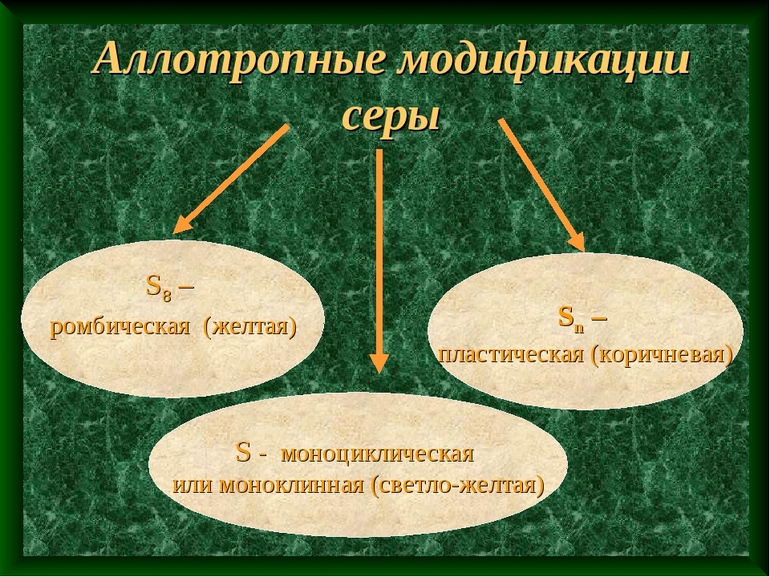
- Сера — вторая по подверженности аллотропии среди неметаллов. Основные ее виды: ромбическая, моноклинная и пластическая. При нормальных условиях окружающей среды моноклинная и пластическая модификации серы переходят в ромбическую.
- Фосфор — имеет 11 аллотропных форм, различающихся числом атомов в молекуле, химическими связями и свойствами, из которых белый фосфор, красный фосфор и черный фосфор имеют устойчивые формы и встречаются в природе, остальные формы распадающиеся и в природе не встречаются.
- Селен — в свободном состоянии бывает в трех видах: красный цикло-Se8, гексагональный или серый селен Se и чёрный селен.
- Водород — бывает в виде o-H2 (орто-водород) и p-H2 (пара-водорода). Молекулы o-H2 и p-H2 отличаются построением ядерных спинов. У o-H2 они параллельные, у p-H2 антипараллельные.
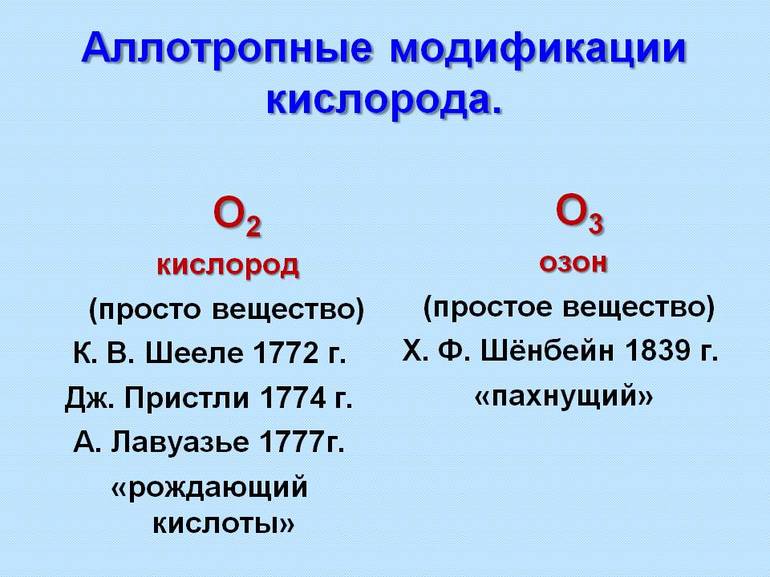
- Кислород — модифицируется в два вещества: Кислород (O2) и Озон (O3).
Полуметаллы
- Бор — встречается в более, чем в 10 состояниях в аморфной и кристаллической формах. Физические свойства этих форм различны.
- Кремний — бывает в аморфной и кристаллической формах. У кристаллической модификации решётка атомная, алмазоподобная.
- Сурьма — имеет четыре металлические и три аморфные аллотропные модификации. Металлические формы существуют при разном давлении. Аморфные формы сурьмы: взрывчатая, чёрная и жёлтая.
- Мышьяк — встречается в трех аллотропных состояниях: в виде неметалла или жёлтый мышьяк, в виде полуметаллического полимера или серый мышьяк, в виде неметаллической молекулярной структуры или чёрный мышьяк.
Металлы
- Железо — бывает в виде четырех кристаллических модификаций:
-
α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;
- β-Fe. Имеет решётку объемноцентрированную кубическую. Существует при температурах от 769 °C до 917 °C. Обладает магнитными свойствами парамагнетики;
- γ-Fe или аустенит. Имеет решётку гранецентрированную кубическую. Существует при температурах от 917 °C до 1394 °C;
- δ-Fe. Имеет решётку объемноцентрированную кубическую. Имеет устойчивость при температуре выше 1394 °C.
Видео
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

Аллотропные модификации неметаллов Презентацию выполнила: Ученица 9 класса Шарлаева Яна Учитель: Болховитина Л. В. МКОУ Терновская ООШ

Аллотропия От греческого allos – другой, tropos – поворот, свойство. Явление, при котором один и тот же химический элемент существует в виде нескольких простых веществ, различных по строению и свойствам.

Аллотропные модификации Простые вещества, образованные одним химическим элементом называют аллотропными модификациями

Элементы, имеющие аллотропные модификации Кислород Фосфор Сера Углерод

Кислород Кислород О2 Озон О3

Кислород Химическая формула О2. Физические свойства: газ, без цвета, без запаха, мало растворим в воде, не задерживает УФ лучи. Биологические свойства: Не ядовит, не бактерициден, необходим для дыхания аэробных организмов. Содержание в воздухе - 21% по объему, 23% по массе.

Озон Химическая формула О3. Физические свойства: синий газ с резким запахом, растворим в воде в 10 раз лучше кислорода, задерживает УФ лучи. Биологические свойства: Ядовит в больших концентрациях, бактерициден, сильно раздражает глаза и дыхательные пути. Содержание в воздухе: летом – до 7*10-9% (по объему), зимой – до 2*10-10%. В атмосфере максимальная концентрация на высоте 20-25 км, где озон образует слой, защищающий Землю от УФ-излучения.

Фосфор Белый фосфор Красный фосфор Черный фосфор другие

Белый фосфор Химическая формула P4. Физические свойства: воскообразное, прозрачное вещество с характерным запахом. Кристаллическая решетка – молекулярная. Белый фосфор ядовит, на воздухе при t около 40 °С самовоспламеняется, поэтому его следует хранить под водой.

Красный фосфор Химическая формула P. Физические свойства: твердое аморфное вещество с цветом от темно-коричневого до фиолетового. Кристаллическая решетка атомная. Красный фосфор не ядовит, на воздухе не воспламеняется. Не растворяется ни в воде, ни в сероуглероде. Не светится в темноте. Загорается лишь при поджигании.

Черный фосфор Химическая формула P. Физические свойства: по внешнему виду похож на графит, полупроводник. Кристаллическая решетка – атомная. Черный фосфор малоактивен, с трудом воспламеняется на воздухе, поэтому его можно безопасно подвергать механической обработке.

Причины аллотропии Образование молекул с различным числом атомов (О2 и О3). Образование различных кристаллических решеток (модификации фосфора).

Элементарный углерод образует три аллотропных видоизменения: алмаз, графит и карбин, наиболее известны алмаз и графит. Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра. Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет. Аллотропные видоизменения углерода.

Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным. Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (3700 °С).

АДСОРБЦИЯ Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении. Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля. Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.


Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация. Моноклинная (b - сера) - S8 темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуреболее 96°С; при обычных условиях превращается вромбическую. Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.

СПАСИБО ЗА ВНИМАНИЕ!
Краткое описание документа:
Изучение простых веществ и их свойств чрезвычайно важно для неорганической химии и закладывает основу для ее изучения. Кардинальная особенность простых веществ заключается в том, что при рассмотрении их свойств не нужно учитывать изменения их состава, поскольку он всегда один и тот же. Но и у простых веществ необходимо уделить особое внимание явлению аллотропии. Это позволит выявлять зависимость свойств веществ от их химического строения. Материал может быть полезен при обобщающении темы: "Неметаллы".
Неметаллы – вещества, обладающие неметаллическими свойствами и находящиеся в правом верхнем углу таблицы Менделеева. Открытие неметаллов произошло сравнительно недавно, в отличии от металлов, которые издавна известны человеку. В настоящее время открыто 22 неметаллических элемента.
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.

Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
Свойства материалов в большинстве случаев отличаются постоянством, но ряд веществ меняет характеристики, в зависимости от состояния. Аллотропия в химии — это нахождение одного простого элемента в двух формах состояния, которые различаются кристаллическим строением. Аллотропные модификации выражают взаимное термодинамическое превращение между фазами вещества.
Общее понятие
Аллотропия проявляется, благодаря разному составу микрочастиц простой материи и координируется вариантом размещения молекул и атомов в кристаллической решетке. Вещество кристаллизуется в нескольких модификациях, при этом два параметра простой ячейки совпадают. Изменение состояния происходит из-за отличия третьего показателя, который учитывает расстояние между сопредельными слоями.
Явление часто обнаруживается в структурах, которые равнозначны гексагональному и кубическому расположению атомов. Соседняя атомная среда представляет эквивалентное окружение, а различия проявляются на удаленных сферах. Энергетические характеристики решеток приблизительно равны, поэтому физические свойства разных состояний одного элемента остаются похожими.
Первые примеры аллотропных модификаций показал шведский минералог и химик Берцелиус середине XIX века для выделения различных форм нахождения элемента. Через 2 десятка лет была принята гипотеза итальянского химика А. Авогадро о многоатомных молекулах и стало видно, что от строения частиц зависит проявление элемента в материи. Например, О3 — озон, а О2 — кислород.
В 1912 году ученые определили, что различия в структуре простых элементов, например, фосфора или углерода, относятся к первопричинам существования двух и более состояний. В настоящее время аллотропией называется видоизменение простых материй, независимо от агрегатного вида. Изменения в твердых состояниях сложных и простых веществ имеет название полиморфизма. Два определения совпадают, если речь идет о простых материалах в твердом виде (железо, сера в кристаллах, фосфор).
Реорганизация веществ
Продолжаются открытия видов простых материалов, способных к аллотропии, несмотря на то, что список образовательных веществ уже превышает 400 материалов. Типы химических связей в элементарных частицах зависят от строения атома, вместе эти характеристики определяют возможность вещества образовывать разные аллотропные формы.
Компоненты, которые могут изменять показатель координационного числа и стадии окисления, образовывают большее количество аллотропных состояний. Важным фактором разнообразия форм является способность элемента к образованию гомоцепных решеток (состоящих из однотипных атомов).
Преобразование простых элементов
Более выраженными являются аллотропные модификации неметаллов, но среди веществ этой группы имеются исключения, например, благородные газы и галогены. Некоторые состояния отличаются температурной стабильностью, другие характеризуются фазовой динамикой. Такие различия объясняются затратами некоторой энергии при изменении кристаллической решетки в результате плавления.
Примеры реорганизации неметаллов:
- Водород. Может быть в форме пара- и ортоводорода на молекулярном уровне. В первой макромолекуле отмечаются антипараллельные импульсные моменты электронов, а в частицах второго типа проявляются параллельные ядерные спины.
- Углерод. Элемент встречается в виде графена, алмаза, нанотрубок, графита, лонсдейлита и др. Точное количество состояний не поддается учету из-за того, что существует большое многообразие связей атомов друг с другом. Нанотрубки и фуллерены относятся к наиболее многочисленным структурам.
- Фосфор. Вещество насчитывает 11 видов аллотропных форм. Черный, белый и красный фосфор относятся к основным модификациям. Первый вид включается в группу инертных и токопроводящих материалов. Белый фосфор отсвечивает в темноте, ядовит и способен к самостоятельному возгоранию. Красный вид не опасен для человека, не воспламеняется и не светится в сумраке.
- Кислород. В природе бывает в виде озона с ярко выраженным запахом слабо фиолетового цвета или в форме кислорода, который не пахнет и без видимого колера.
- Селен. Представлен в двух видах. Первый — черный селен, второй — серый полимер.
- Сера. По количеству аллотропных состояний находится на 2 месте после углерода. Распространенными видами является моноклинная, пластическая и ромбическая сера.
Разные состояния одного компонента обозначаются строчными литерами греческой латиницы для написания в формулах. Низкотемпературные формы отмечаются буквой α, следующие состояния по показателям обозначаются β и дальше по такому принципу.
Модификации полупроводников
К этой группе относятся элементы, располагающиеся в таблице на переходе от металлов к неметаллам. У материалов присутствует кристаллическая ковалентная решетка, чаще они характеризуются проводимостью по типу металлов. Иногда материалы работают как полупроводники.
Примеры трансформации неметаллов:

- Бор. Существует в природе в кристаллической и аморфной форме, первый тип имеет черный, а второй — бурый колер. Наука знает о более 10 аллотропных состояний бора, которые встречаются в тетрагональном и ромбическом соединении. В некоторых модификациях имеется несколько открытых слоев, образующих бесконечное строение.
- Кремний. Свойства кристаллической формы обусловлены алмазоподобной атомной решеткой, выделяется моно- и поликристаллический кремний. В природе встречается в виде песка, кварцита, полевого шпата, силикатов.
- Мышьяк. Распространены 3 основные аллотропные формы. Серый полимер относится к классу полуметаллов, желтый мышьяк входит в группу неметаллов, черный вид по структуре напоминает красный фосфор.
- Германий. Существует в форме полуметалла с кристаллической решеткой по типу алмаза и в фазе металла с токопроводящими качествами.
- Сурьма. Известно 4 модификации материала в форме металлов, из которых наиболее стабильной является серебристо-белое вещество с голубым оттенком. Аморфные аллотропии существуют в виде желтой, взрывчатой и черной сурьмы.
- Полоний. Находится в 2 металлических разновидностях. Низкотемпературная форма отличается кубическим строением решетки, высокотемпературный вид имеет ромбическую структуру.
К особенностям относится слабое сочетание зоны проводимости и валентной области. Это обеспечивает электропроводность до того времени, пока температура не снизится до 0ºС. Нагревание способствует увеличению электронных дырок (обладателей тока), но видоизменение идет слабо. Положительные квазичастицы в полуметаллах активно двигаются при малой полезной массе. По этой причине материалы больше других веществ подходят для изготовления фазовых переходов в магнитных полях большой силы, наблюдения квантовых и классических размерных эффектов.
Особенности видоизменения металлов
Металлы образовывают различные состояния при увеличении давления или в случае технологической обработки. Аллотропной модификацией металлов называется возможность материала в твердой форме образовывать различные виды кристаллических решеток. Процесс перехода от одной структуры к другой рассматривается в виде превращения.
Обследование структуры производится способом микроанализа, делается ультразвуковая, магнитная и рентгеновская дефектоскопия.
Микроанализ проводится на основе снятия микрошлифов, которые перед исследованием полируются до блеска. Вывод о структуре делается после рассмотрения срезов под микроскопом после травления. Шлифы показывают границы зерен из-за неодинаковой обработки основного слоя и рельефных выступов. Анализ выявляет форму и размеры частиц, инородные включения.
Рентген дает понятие об атомном строении материала, типе кристаллической структуры, дефектах решеток. Для исследования используется свойство рядов отражать гамма-лучи. При магнитном способе поверхность металла намагничивается и покрывается железным порошком. После размагничивания слой показывает очертания решетки.
Ультразвук применяется для эффективного обнаружения качественного преобразования металла в требуемую аллотропную модификацию. Волновое излучение распространяется внутрь и отражается от элементов решетки.
Примеры аллотропии
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540ºС ведет к перестройке до центрировано-кубической структуры.
Аллотропные модификации металлов:

Определенные свойства твердых элементов зависят не только от строения решетки и дефектов, но и от структуры микрочастиц, их состава, размера и формы. Конструкция кристаллов оказывает влияние на физические характеристики тела и предопределяет пределы деформационной пластики, твердость материала.
Обратимые и непоправимые переходы
В случае изменения температурных показателей и параметров давления твердые материалы переходят из одной структуры в другую без перемены количественного состава элементов. Предпосылками является подвижность частиц решетки и перенос некоторого количества вещества, вызванный дефектами строения твердого состояния.
Примеры переходов:
- энантиотропные преобразования (обратимые);
- монотропные видоизменения (необратимые).

Проводят разработанную методику трехфазной реакции для направленного получения требуемой решеточной структуры. Выбор нагревательного режима и продолжительность повышения температуры ускоряет рост кристаллов до больших зерен, что улучшает качество. Изменение способа обработки направляется иногда на снижение активности катализаторов в результате процесса рекристаллизации.
Энантиотропное видоизменение возникает при нулевой температуре и выбранном давлении. Иногда аллотропное преобразование относится к необратимым и одно из состояний материала является неустойчивым в термическом плане. Эта фаза сохраняется на всем температурном интервале от абсолютного нуля и называется монотропным. При получении серого олова из белого происходит обратимое преобразование, а превращение алмаза в графит становится необратимым.

Отличие этих типов превращений — в технологических особенностях проведения. Энантиотропные переходы модификации А чаще получаются методом постепенного охлаждения сплава. Сначала масса кристаллизуется в виде состояния Б, которое затем видоизменяется в устойчивую фазу к низким температурам.
При монотропном переходе в случае охлаждения сплава образуется только вещество в состоянии А. Требуется особый технологический режим со строгим дозированием понижения температуры и давления для получения модификации Б. Примером служит получение стабильного черного фосфора из белого путем нагревания до + 200ºС и повышения давления до 1,25 ГПа. После помещения полученного образца в нормальные условия обратного преобразования не происходит.
Читайте также:

