Сообщение на тему применение азота и аммиака
Обновлено: 02.07.2024
Аммиак
Оксиды азота
Оксид азота(I). По химическим свойствам достаточно инертен, однако заметно активен по физиологическому действию. В силу специфики своего наркотического воздействия на организм человека используется в медицине.
Оксид азота(II). Наиболее характерны для оксида азота(II) реакции присоединения. Присоединение кислорода к NO происходит с необычайной легкостью и ведет к получению оксида азота(IV). Может этот оксид присоединять также хлор:
Смесь NO с равным объемом H2 взрывается при нагревании. В кислой среде ион Cr 3+ восстанавливает оксид азота(II) до гидроксиламина – продукта, необходимого для получения многих сложных органических соединений, содержащих азот.
Оксид азота(III). У оксида N2O3 на передний план выходит свойство разлагаться при температуре, близкой к температуре его плавления (–102 °С), а потому применение этого оксида затруднительно.
Оксид азота(IV). Применение диоксида азота NO2 основано на его свойствах восстанавливаться (т. е. быть окислителем) и окисляться. Конечно, как окислитель оксид азота(IV) намного сильнее, чем восстановитель. Оксид NO2 применяют как компонент в ракетном топливе и в смесевых взрывчатых веществах, им очищают нефтепродукты от сераорганических соединений. На этом же свойстве – умении отдавать кислород, восстанавливаясь (в сочетании со свойством оксида азота(II) присоединять кислород), – основано его использование как катализатора окисления некоторых соединений (например, бензола до фенола, метана до формальдегида, оксида серы(IV) до серной кислоты. ). Но не стоит забывать, что при образовании азотной кислоты (а это очень существенная часть применения оксида азота(IV)), он работает все же восстановителем, окисляясь (т. е. присоединяя кислород) до максимально возможной для азота степени окисления +5.
Оксид азота(V). При комнатной температуре N2O5 самопроизвольно разлагается на оксид азота(IV) и кислород. Применяется весьма ограниченно.
Азотная кислота
Сильная неорганическая кислота и сильный окислитель. Соответственно и применение: основная часть разбавленной азотной кислоты идет на производство минеральных удобрений, много кислоты расходуется при получении различных лаков и красок, она активно используется в химических лабораториях, входит в состав ракетного топлива. Еще одно применение – получение взрывчатых веществ (саму кислоту использовать как взрывчатое вещество затруднительно именно из-за ее кислотных свойств).
Можно и дальше с той или иной степенью подробности перечислять примеры применения азота и его соединений. Но это скучно. К тому же если азот, аммиак и оксиды азота активно начали применять исторически относительно недавно, потому что для этого необходима развитая химическая отрасль промышленности, то азотная кислота известна и много применяема уже около семи столетий, а ее соли – и того больше. Поэтому воспользуемся принципиально иным способом изложения материала.
Получение огня и письменность –
вот то, что кардинальным образом
отличает человека от животного
Письменность тоже добавила этим бактериям неприятности – человек передавал опыт использования огня. И конечно, опыт использования многого другого.
Первое знакомство (завязка)
Древнеегипетский художник
мог бы вот так изобразить
процесс купеляции
Толкая науку. (кульминация)
Явление первое
Действующие лица: Селитра, Азотная кислота.
Азотная кислота (разбавленная, падающая на землю вместе с дождем после грозы и молний). Ах! Какая несправедливость! Я всю жизнь кручусь, как белка, в этом круговороте, а Человек до сих пор меня не открыл!
Селитра. Так потому и не открыл, что ты все время крутишься: то в растение – ему, видите ли, белок нужно сделать, то еще куда-нибудь. А я лежу себе спокойненько на месте. Вот Человек меня и открыл.
Уходят.
Явление второе
Действующие лица: Человек, другой человек по имени Роджер, Квасцы, Купорос, Серная и Азотная кислоты, Нашатырь. Человек. Эй, Роджер! Хватит заниматься этим дурацким философским камнем. Уж очень он твердый и тяжелый. Вчера мне на ногу свалился, так я полчаса прыгал по лаборатории на одной ноге. Займемся чем-нибудь жидким. Например, спиртом.
Роджер. Да, да, да. С философским камнем у меня ничего не получается. Надо переключиться! Жидкое. Жидкое. Жидкое! Да. Универсальный растворитель – вот чем следует заняться! Надо что-то погреть. Так, что у нас имеется?
Квасцы. Это мы! Это мы! Это нас надо погреть!
Купорос. И меня тоже неплохо было бы погреть.
Роджер. Ну что ж, погреем вас всех. Так, что у нас получается? Неужели я его нашел? Растворяет! И это, и это, и это тоже. Да, но керамический сосуд, к счастью, не растворился. А золотой? Тоже нет. Значит, это не универсальный растворитель, но все же довольно хороший. Назову его купоросным спиртом.
Серная кислота. Фу! Ну какой же я купоросный спирт? Я же обыкновенная необыкновенная серная кислота. Хотя этот Роджер молодец: заметил, как много чего я умею растворять. Эх, жаль, что он меня сейчас не слышит. Впрочем, не важно. Могу какое-то время откликаться и на имя Купоросный спирт.
Роджер. А если так попробовать? Смешаем Селитру, Медный купорос, квасцы и погреем.
Азотная кислота. Ура! Наконец-то меня получили!
Роджер. Так, так, так. Что же я получил на этот раз? Это не Купоросный спирт. Это. Ай! Больно как жжется! Крепкая штука! Вот так и назовем ее – Крепкая водка. Так, а на золото она действует? Нет? Какая жалость!
Нашатырь. Эй, ты, химик!
Роджер. Я не химик! Прошу не путать! Я – алхимик!
Нашатырь. Да не важно, хоть горшком, как говорится, назови, только в печь не ставь, а соедини меня вон с той дамой, с Крепкой водкой. Не пожалеешь!
Роджер. Смешать Нашатырь с Крепкой водкой. А почему бы и нет? Так, замесили, отделили, отлили. Это растворяет, это растворяет, и это, и это. И золото тоже растворяет?! Неужели я нашел универсальный растворитель? Ах, нет. Керамический сосуд же цел. Ну и ладно. Зато я нашел растворитель царя металлов! Я назову его Царская водка!
Комментарий. Квасцами называли раньше, да и сейчас иногда называют, кристаллогидраты двойных сульфатов, например алюмокалиевые квасцы Kal(SO4)2•12H2O.
Купоросы – это кристаллогидраты сульфатов, например железный купорос FeSO4•7H2O
Нашатырем издавна называли хлорид аммония NН4Cl.
Явление третье (800 лет спустя)
Явление четвертое
Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой):

Он же обнаружил, что при взаимодействии азотной кислоты с поташом K2CO3 образуется чистая калийная селитра. Это открытие имело большое практическое значение, ведь раньше селитру, необходимую для производства пороха, ввозили в Европу из стран Востока, а также выделяли из соляного налёта на стенах конюшен или из селитряных ям, где она образовывалась под действием микроорганизмов как конечный продукт окисления азотсодержащих органических соединений.

Редко встречаются минералы, которые содержат азот, например чилийская селитра NaNO3, залежи которой тянутся вдоль побережья Чили и Перу на расстояние свыше 3600 км. В конце XIX в. добыча ее составляла примерно 0,5 тонн в год. Не случайно у предпринимателей и ученых возникали опасения в том, что скоро ее запасы иссякнут. Это и подтолкнуло химиков к разработке технологий по связыванию азота воздуха.
В промышленности азот получают из жидкого воздуха. Для этого воздух переводят в жидкое состояние, и при температуре – 196 0 С азот испаряется.
В лаборатории азот получают разложением нитрита аммония NH4NO2 при нагревании:
Физические свойства

Азот – газ без цвета, вкуса и запаха (tпл = -210 0 С, tкип = -196 0 С), мало растворимый в воде. Свободный азот химически инертен из-за высокой прочности молекулы N2, в которой атомы связаны тройной связью. Поэтому азот с трудом вступает в химические реакции, не поддерживает горение и дыхание.
Характерные степени окисления:
— 3 0 +1 +2 +3 +4 +5
Химические свойства
В химических реакциях азот может быть как окислителем, так и восстановителем.
Азот взаимодействует как окислитель:
Азот взаимодействует как восстановитель:
Применение
Азот является исходным сырьем для получения аммиака, азотной кислоты и азотных удобрений.
Аммиак
Аммиак – бесцветный газ с резким запахом, хорошо растворимый в воде. В одном литре воды при температуре 20 0 С растворяется 700 л аммиака. Этот раствор называется аммиачной водой или нашатырным спиртом.
Химические свойства
Кислотно-основные свойства
Атом азота в молекуле аммиака имеет неподеленную электронную пару, которая может участвовать в образовании донорно-акцепторной связи. В частности, атом азота в NH3 способен присоединять ион водорода Н + . Вещества, молекулы которых способны присоединять ионы водорода, обладают основными свойствами. Следовательно, аммиак обладает основными свойствами:
- взаимодействие с кислотами (в результате образуются средние и кислые соли):
- аммиак взаимодействует с солями некоторых металлов с образованием комплексных соединений – аммиакатов:
AgCl + 2NH3 = [Ag(NH3)2]Cl Хлорид диамин серебра (I)
Окислительно – восстановительные свойства
В молекуле аммиака азот имеет степень окисления – 3, поэтому в окислительно – восстановительных реакциях он может только отдавать электроны и является только восстановителем.
- аммиак окисляется кислородом без катализатора до азота:
- аммиак в присутствии катализатора окисляется до монооксида азота NO:
Соли аммония

При взаимодействии аммиака или гидроксида аммония с кислотами образуются соли аммония:
Все соли аммония хорошо растворимы в воде. Соли аммония имеют общие свойства солей. К особым свойствам солей аммония относятся реакции их термического разложения, которые протекают по-разному, в зависимости от характера аниона, например:
Реакция взаимодействия солей аммония со щелочью является качественной реакцией на катион аммония NH4 + :
Выделяющийся аммиак определяют по запаху или по посинению влажной лакмусовой бумаги.
Применение аммиака и солей аммония
Из аммиака получают азотную кислоту, гидроксид аммония (нашатырный спирт), соли аммония и т.д. Нашатырный спирт NH4OH и нашатырь NH4Cl широко применяется в медицине. Нитрат аммония, фосфат аммония и другие аммонийные соли используются в сельском хозяйстве в качестве удобрений.
Аммиак (от латинского Ammonia) — химический элемент в виде газа без цвета, обладающий неприятным запахом в естественных условиях. Он легче воздушного потока, ядовит для живых организмов, отличается высоким коэффициентом растворимости в воде. Молекулярная формула представляет собой строение в виде тригональной пирамиды с тремя микрочастицами азота, расположенными вверху. За счет неспаренных частиц азота связь полярная с водородом и неопределенная — с четвертой парой электронов.

Описание элемента

В жидкой форме аммиака молекулы соединены водородной связью. Температура, вязкость и плотность аммиака по сравнению с водой значительно ниже. Процесс кипения начинается от 33 градусов, а процесс горения или плавления — от 77 градусов по Цельсию. Показатели проводимости и диэлектрической проницаемости аммиака низкие. Следовательно, прочность связей в состоянии жидкости низкая.
Аналогично воде, аммиак в жидком состоянии ассоциирован из-за наличия водородной связи. Переход химического состава в состояние жидкости, не имеющей цвета, с плотностью 681 килограмм на метр кубический, быстрый. Проводимость тока в этом состояние практически отсутствует.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
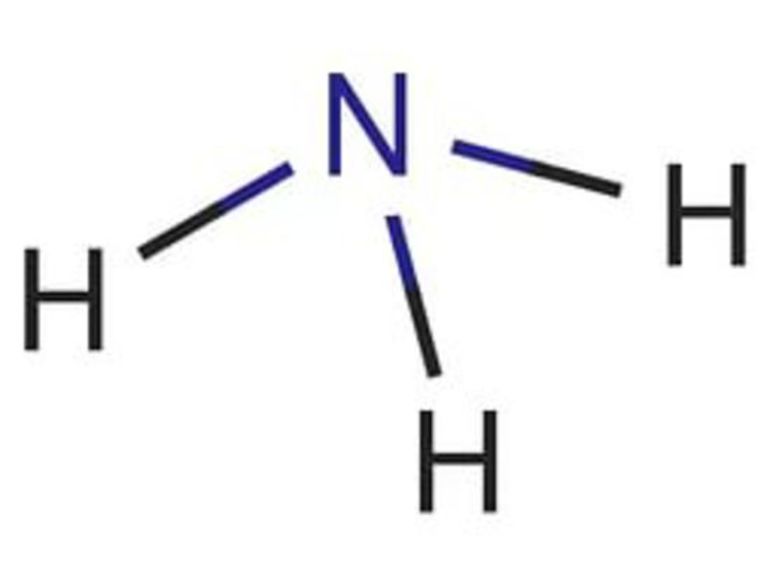
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H + → NH4 + .
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4 + +ОН - .
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M + + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.

В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Физическое воздействие
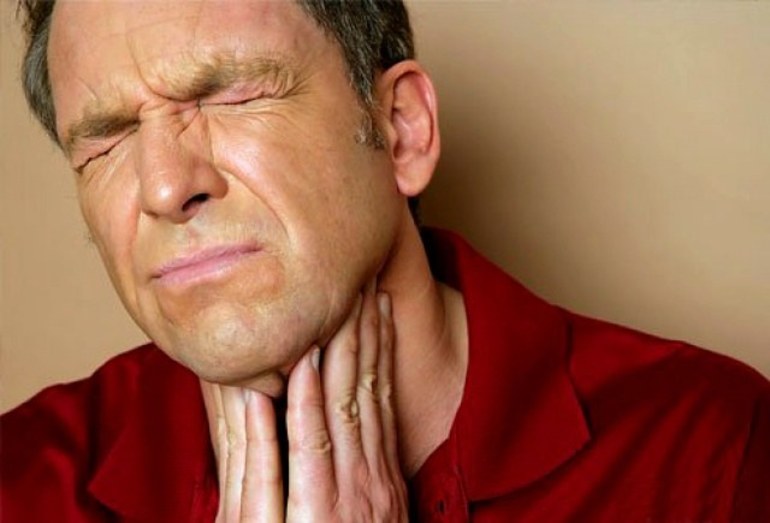
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
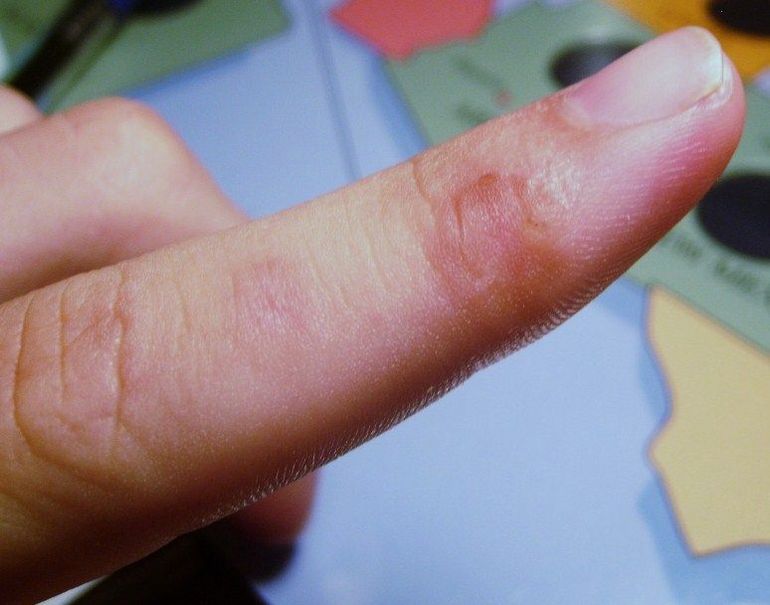
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:

- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.

Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Способы получения
Аммиак производят при водородном и азотном взаимодействии молекул в промышленности. Техника производства называется процессом Габера. Вся реакция протекает с выбросом тепла и уменьшением объема. Таким образом, реакция проводится при пониженной температуре окружающей среды и повышенном давлении. Равновесие смещается вправо. В этих условиях скорость прохождения реакции маленькая, а при повышении показаний температуры скорость начинает увеличиваться. Для безопасного проведения реакции требуется специальное оборудование, поддерживающее повышенное давление.
Для ускорения получения состояния равновесия используют катализаторные материалы — железо с пористым составом и некоторым процентом добавок.
По всем свойствам процесс получения аммиака происходит при температуре в 500 градусов по Цельсию и при наличии высокого давления, достигающего 350 атмосфер. Процент добычи при соблюдении этих факторов составит 30 процентов. В промышленности процесс зациклен. Происходит охлаждение состава и удаление аммиака, а непрореагировавший азот и водород возвращают для повторного синтеза обратно. Этот способ добычи аммиака в промышленности считается самым экономичным.
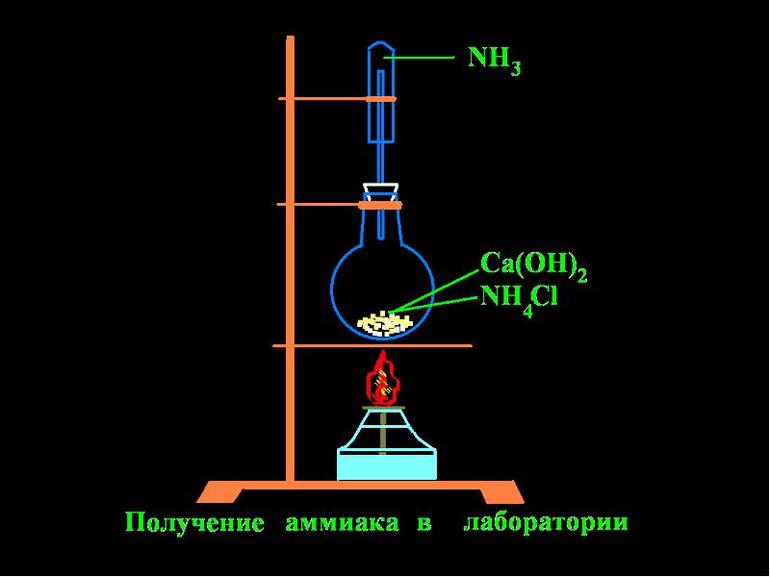
В условиях лаборатории аммиак добывают за счет действия щелочей. Химический элемент получают путем нагревания аммония с известью. Для сушки аммиака используют известь с натром.
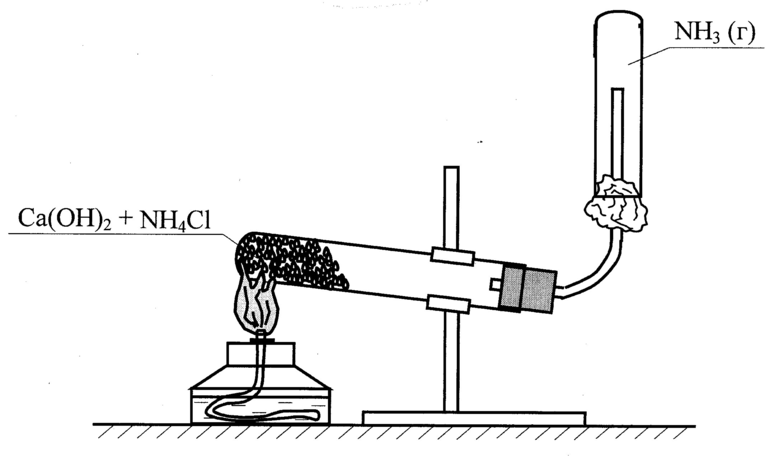
Благодаря физическим и химическим свойствам аммиака его успешно используют в промышленности, производстве, медицине, химии и многих других областях человеческой деятельности.
Аммиак
Оксиды азота
Оксид азота(I). По химическим свойствам достаточно инертен, однако заметно активен по физиологическому действию. В силу специфики своего наркотического воздействия на организм человека используется в медицине.
Оксид азота(II). Наиболее характерны для оксида азота(II) реакции присоединения. Присоединение кислорода к NO происходит с необычайной легкостью и ведет к получению оксида азота(IV). Может этот оксид присоединять также хлор:
Смесь NO с равным объемом H2 взрывается при нагревании. В кислой среде ион Cr 3+ восстанавливает оксид азота(II) до гидроксиламина – продукта, необходимого для получения многих сложных органических соединений, содержащих азот.
Оксид азота(III). У оксида N2O3 на передний план выходит свойство разлагаться при температуре, близкой к температуре его плавления (–102 °С), а потому применение этого оксида затруднительно.
Оксид азота(IV). Применение диоксида азота NO2 основано на его свойствах восстанавливаться (т. е. быть окислителем) и окисляться. Конечно, как окислитель оксид азота(IV) намного сильнее, чем восстановитель. Оксид NO2 применяют как компонент в ракетном топливе и в смесевых взрывчатых веществах, им очищают нефтепродукты от сераорганических соединений. На этом же свойстве – умении отдавать кислород, восстанавливаясь (в сочетании со свойством оксида азота(II) присоединять кислород), – основано его использование как катализатора окисления некоторых соединений (например, бензола до фенола, метана до формальдегида, оксида серы(IV) до серной кислоты. ). Но не стоит забывать, что при образовании азотной кислоты (а это очень существенная часть применения оксида азота(IV)), он работает все же восстановителем, окисляясь (т. е. присоединяя кислород) до максимально возможной для азота степени окисления +5.
Оксид азота(V). При комнатной температуре N2O5 самопроизвольно разлагается на оксид азота(IV) и кислород. Применяется весьма ограниченно.
Азотная кислота
Сильная неорганическая кислота и сильный окислитель. Соответственно и применение: основная часть разбавленной азотной кислоты идет на производство минеральных удобрений, много кислоты расходуется при получении различных лаков и красок, она активно используется в химических лабораториях, входит в состав ракетного топлива. Еще одно применение – получение взрывчатых веществ (саму кислоту использовать как взрывчатое вещество затруднительно именно из-за ее кислотных свойств).
Можно и дальше с той или иной степенью подробности перечислять примеры применения азота и его соединений. Но это скучно. К тому же если азот, аммиак и оксиды азота активно начали применять исторически относительно недавно, потому что для этого необходима развитая химическая отрасль промышленности, то азотная кислота известна и много применяема уже около семи столетий, а ее соли – и того больше. Поэтому воспользуемся принципиально иным способом изложения материала.
Получение огня и письменность –
вот то, что кардинальным образом
отличает человека от животного
Письменность тоже добавила этим бактериям неприятности – человек передавал опыт использования огня. И конечно, опыт использования многого другого.
Первое знакомство (завязка)
Древнеегипетский художник
мог бы вот так изобразить
процесс купеляции
Толкая науку. (кульминация)
Явление первое
Действующие лица: Селитра, Азотная кислота.
Азотная кислота (разбавленная, падающая на землю вместе с дождем после грозы и молний). Ах! Какая несправедливость! Я всю жизнь кручусь, как белка, в этом круговороте, а Человек до сих пор меня не открыл!
Селитра. Так потому и не открыл, что ты все время крутишься: то в растение – ему, видите ли, белок нужно сделать, то еще куда-нибудь. А я лежу себе спокойненько на месте. Вот Человек меня и открыл.
Уходят.
Явление второе
Действующие лица: Человек, другой человек по имени Роджер, Квасцы, Купорос, Серная и Азотная кислоты, Нашатырь. Человек. Эй, Роджер! Хватит заниматься этим дурацким философским камнем. Уж очень он твердый и тяжелый. Вчера мне на ногу свалился, так я полчаса прыгал по лаборатории на одной ноге. Займемся чем-нибудь жидким. Например, спиртом.
Роджер. Да, да, да. С философским камнем у меня ничего не получается. Надо переключиться! Жидкое. Жидкое. Жидкое! Да. Универсальный растворитель – вот чем следует заняться! Надо что-то погреть. Так, что у нас имеется?
Квасцы. Это мы! Это мы! Это нас надо погреть!
Купорос. И меня тоже неплохо было бы погреть.
Роджер. Ну что ж, погреем вас всех. Так, что у нас получается? Неужели я его нашел? Растворяет! И это, и это, и это тоже. Да, но керамический сосуд, к счастью, не растворился. А золотой? Тоже нет. Значит, это не универсальный растворитель, но все же довольно хороший. Назову его купоросным спиртом.
Серная кислота. Фу! Ну какой же я купоросный спирт? Я же обыкновенная необыкновенная серная кислота. Хотя этот Роджер молодец: заметил, как много чего я умею растворять. Эх, жаль, что он меня сейчас не слышит. Впрочем, не важно. Могу какое-то время откликаться и на имя Купоросный спирт.
Роджер. А если так попробовать? Смешаем Селитру, Медный купорос, квасцы и погреем.
Азотная кислота. Ура! Наконец-то меня получили!
Роджер. Так, так, так. Что же я получил на этот раз? Это не Купоросный спирт. Это. Ай! Больно как жжется! Крепкая штука! Вот так и назовем ее – Крепкая водка. Так, а на золото она действует? Нет? Какая жалость!
Нашатырь. Эй, ты, химик!
Роджер. Я не химик! Прошу не путать! Я – алхимик!
Нашатырь. Да не важно, хоть горшком, как говорится, назови, только в печь не ставь, а соедини меня вон с той дамой, с Крепкой водкой. Не пожалеешь!
Роджер. Смешать Нашатырь с Крепкой водкой. А почему бы и нет? Так, замесили, отделили, отлили. Это растворяет, это растворяет, и это, и это. И золото тоже растворяет?! Неужели я нашел универсальный растворитель? Ах, нет. Керамический сосуд же цел. Ну и ладно. Зато я нашел растворитель царя металлов! Я назову его Царская водка!
Комментарий. Квасцами называли раньше, да и сейчас иногда называют, кристаллогидраты двойных сульфатов, например алюмокалиевые квасцы Kal(SO4)2•12H2O.
Купоросы – это кристаллогидраты сульфатов, например железный купорос FeSO4•7H2O
Нашатырем издавна называли хлорид аммония NН4Cl.
Явление третье (800 лет спустя)
Явление четвертое
Читайте также:
- Капиллярные явления в медицине сообщение
- Сообщение знакомство с родителями классного руководителя
- Какое количество информации несет сообщение о том что встреча назначена на 8 число введите
- Понятие о композиции в интерьере характерные особенности жилища отделка квартиры освещение сообщение
- Сообщение о любом полимере на основе углеводородов

