Сообщение на тему металлы побочных подгрупп
Обновлено: 05.07.2024
К металлам побочных подгрупп периодической системы Д. И. Менделеева относятся все d-элементы. Таких подгрупп 10: скандия, титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди и цинка. Здесь рассматриваются общие характеристики подгрупп хрома и семейства железа.
Побочную подгруппу VI группы составляют следующие элементы - хром Cr, молибден Мо и вольфрам W. Хром возглавляет побочную подгруппу 4 группы. На внешнем энергетическом уровне атомов хрома и молибдена содержится по одному электрону, вольфрама - два электрона, что обусловливает металлический характер этих элементов и отлично от элементов главной подгруппы.
Прикрепленные файлы: 1 файл
Документ Microsoft Word.doc
К металлам побочных подгрупп периодической системы Д. И. Менделеева относятся все d-элементы. Таких подгрупп 10: скандия, титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди и цинка. Здесь рассматриваются общие характеристики подгрупп хрома и семейства железа.
Побочную подгруппу VI группы составляют следующие элементы - хром Cr, молибден Мо и вольфрам W. Хром возглавляет побочную подгруппу 4 группы. На внешнем энергетическом уровне атомов хрома и молибдена содержится по одному электрону, вольфрама - два электрона, что обусловливает металлический характер этих элементов и отлично от элементов главной подгруппы. В соответствии с числом валентных электронов они проявляют максимальную степень окисления +6 и образуют оксиды типа RO3, которым соответствуют кислоты общей формулы H2RO4. Сила кислот закономерно снижается от хрома к вольфраму. Большинство солей этих кислот в воде малорастворимо, хорошо растворяются только соли щелочных металлов и аммония.
Элементы подгруппы хрома проявляют также степени окисления +5, +4, +3, +2. Но наиболее типичны соединения высшей степени окисления, которые во многом весьма похожи на соответствующие соединения серы. С водородом элементы подгруппы хрома соединений не образуют.
С ростом порядкового номера в подгруппе возрастает температура плавления металлов. Вольфрам плавится при 3390 °С. Это самый тугоплавкий металл. Поэтому его используют для изготовления нитей в электрических лампочках накаливания.
Металлы подгруппы хрома в обычных условиях весьма устойчивы к воздействию воздуха и воды. При нагревании взаимодействуют с кислородом, галогенами, азотом, фосфором, углем, кремнием и др. Известны их многочисленные сплавы с другими металлами. Сплавы и сами металлы - весьма ценные материалы современной техники.
По физическим и химическим свойствам молибден и вольфрам сходны между собой и несколько отличаются от хрома. Химическая активность металлов в ряду хром - молибден - вольфрам заметно понижается.
Понятие переходный элемент обычно используется для обозначения любого из d- или f- элементов. Эти элементы занимают переходное положение между электроположительными s- элементами и электроотрицательными p- элементами. d- Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3 d- орбиталей . Хром и медь имеют на 4 s- орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d- подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3 d- орбиталей, образующих 3 d- подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3 d- орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
Все d- элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s- металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d- элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к обра зованию комплексных ионов; образование окрашенных соединений.
d- Элементы характеризуются также более высокой плот ностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d- Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s- электрон сверх полузаполненной или заполненной d- оболочки. Например, медь, .
Химические свойства . Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда посте пенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием С r 2 О 3 , реагирует с парами воды
и с галогенами, образуя галогениды состава С r На l 3 . Хром (так же, как алюминий) пассивируется холодными концентрированными Н 2 S О 4 и Н N О 3 . Однако при сильном нагревании эти растворяют хром:
С r + 6 Н N О 3(конц) = С r(N О 3 ) 3 + 3 NO 2 ↑ + 3 Н 2 О.
При обычной температуре хром растворяется в разбавленных кислотах (НС l, Н 2 S О 4 ) с выделением водорода, образуяС r 2+ . По своим свойствам соли С r 2+ похожи на соли F е 2+ . Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома ( II):
С r С l 2 + 2 Na ОН = С r( ОН) 2 ↓ + 2 Na С l.
При прокаливании С r( ОН) 2 в отсутствие кислорода образуется оксид хрома ( II) С r О.
Соли Cr 3+ сходны с аналогичными солями алюминия. При действии щелочей на соли С r 3+ выпадает студнеобразный осадок гидроксида хрома ( III) зеленого цвета:
обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома ( III)
так и в щелочах с образованием тетрагидроксихромитов, т.е. солей, в которых С r 3+ входит в состав аниона:
В результате прокаливания С r( ОН) 3 получают оксид С r 2 О 3 - зеленые кристаллы, нерастворимые в воде. Этот оксид получают также прокаливанием дихроматов калия и аммония
При сплавлении С r 2 О 3 со щелочами, содой и кислыми солями получаются соединения С r +3 , растворимые в воде:
С r 2 О 3 + 2 Na ОН = 2 Na С r О 2 + Н 2 О↑,
Наиболее важными соединениями хрома в высшей степени окисления +6 являются оксид хрома ( VI) С r О 3 , хромат ( VI) калия К 2 С r О 4 и дихромат ( VI) калия К 2 С r 2 О 7 .
Оксид хрома ( VI) — ангидрид хромовой Н 2 С r О 4 и дихромовой Н 2 С r 2 О 7 кислот, представляет собой ярко-красные кристал лы, растворимые в воде. Он также реагирует со щелочами, образуя желтые хроматы С r О 4 2- :
В кислой среде ион CrO 4 2- превращается в ион С r 2 О 7 2- . В щелочной среде эта реакция протекает в обратном направлении:
Металлическое железо получают восстановлением его оксидов; реагируя с водяным паром, оно образует смешанный оксид железа ( II, III) F е O . F е 2 О 3 :
На воздухе в присутствии влаги ржавеет:
4 F е + 3 O 2 + 6 Н 2 О = 4 F е(ОН) 3 .
С галогенами оно образует галогениды железа ( III)
2 F е + 3 В r 2 = 2 F еВ r 3 ,
а взаимодействуя с соляной и разбавленной серной кислотами железа ( II):
Концентрированные (Н N О 3 , Н 2 S О 4 ) пассивируют железо на холоде, однако растворяют его при на гревании:
F е + 6 Н N О 3(конц) = F е( N О 3 ) 3 + 3 N О 2 ↑ + 3 Н 2 О.
Растворимые соли железа в воде гидролизуются и дают кислую реакцию, поскольку железа ( II) и ( III) в воде не растворимы.
Гидроксид железа ( II) получают действием раствора щелочи на соли железа ( II) без доступа воздуха:
F е S О 4 + 2 Na ОН = F е(ОН) 2 ↓ + Na 2 S О 4 .
F е(ОН) 2 — осадок белого цвета; в присутствии воздуха он быстро превращается в гидроксид железа ( III) ( бурый осадок):
Гидроксид железа ( III), в отличие от F е(ОН) 2 , амфотерен, при нагревании он способен растворяться в щелочах с образова нием гексагидроферрата ( III):
Это — один из анионных комплексов железа ( III).
Отметим еще две важные комплексные соли железа: гексацианоферрат ( II) калия К 4 [ F е(С N) 6 ] ( желтая кровяная соль) и гексацианоферрат ( III) калия К 3 [ F е(С N) 6 ] ( красная кровяная соль), являющиеся реактивами для качественного определения ионов F е 3+ и Fe 2+ соответственно.
Добавление раствора гексацианоферрата ( II) к растворам, в которых содержатся вызывает образование темно-синего осадка, часто называемого берлинской лазурью :
4 К 4 [ F е(С N) 6 ] + 4 F е 3+ = 4 К F е III [F е II ( С N) 6 ]↓ + 12 К + . (*)
Такой же темно-синий осадок образуется при добавлении рас твора гексацианоферрата ( III) к растворам, содержащим ионы железа ( II). В этом случае осадок называется турнбуллевой синью :
3 К 3 [ F е(С N) 6 ] + 3 F е 2+ = 3 К F е II [F е III ( С N) 6 ]↓ + 6 К + . (**)
Установлено, что берлинская лазурь и турнбуллева синь — это одно и то же вещество, так как комплексы, образующиеся в реак циях (*) - (**) находятся между собой в равновесии:
К F е III [F е II ( С N) 6 ] = К Fe II [F е III ( С N) 6 ].
Медь — довольно мягкий металл красно-желтого цвета, об ладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют из растворов ее солей. Медь не реагирует с соляной и разбавленной серной кис лотами и растворяется только в кислотах — окислителях:
С u + 2 Н 2 S О 4(конц) = С uS О 4 + S О 2 ↑ + 2 Н 2 О,
3 Cu + 8 Н N О 3(разб) = 3 С u(NO 3 ) 2 + 2 NO↑ + 4 Н 2 О.
Известны соединения меди со степенями окисления +1 и +2, из которых последние более устойчивы. Одновалентная медь об разует либо нерастворимые Хлорид меди ( I) растворяется в концентрированном растворе аммиака с образованием комплексной соли хлорида диамминмеди ( I)[ С u(N Н 3 ) 2 ]С l; так же в аммиаке растворяется оксид меди ( I):
С u С l + 2 N Н 3 = [С u(N Н 3 ) 2 ]С l,
Ионы С u 2+ в водном растворе существуют в виде комплексов гексааквамеди ( II) [ С u( Н 2 О) 6 ] 2+ , придающих раствору сине-голубую окраску. При добавлении щелочи к такому раствору об разуется голубой осадок гидратированного гидроксида меди ( II):
Полученный осадок, в свою очередь, растворяется в растворе аммиака, образуя ярко-синий комплекс.
Изменение окраски соединений меди при переходе из степени окисления +2 в Так, свежеосажденный Cu( ОН) 2 голубого цвета восстанавливается альдегидами или углеводами (глюкозой) в желтый осадок гидроксида меди ( I); последний даже при слабом нагревании распадается на воду и оранжевый оксид С u 2 О.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дата ______ Урок № 36/37 Класс 11
Учитель: Веремьева Р.И.
Предмет химия
Цель: Повторить и обобщить знания о металлах на примере металлов представителей побочных подгрупп (меди, железа, хрома); углубить знания об их свойствах и применении.
Образовательная : Изучить строение, свойства и применение металлов побочных подгрупп
Развивающие : 1. Создать условия для развития логического мышления через сравнение и установление взаимосвязи строения и свойств веществ с учетом зоны ближайшего развития 2. Формирование умений переносить полученные знания в новую ситуацию
Воспитательные : 1. Формирование научного мировоззрения через познаваемость химических явлений 2. Формирование умений осуществлять самоконтроль хода и результатов своего труда 3. Развитие коммуникативности личности
Планируемые результаты:
Знать строение атома, физические и химические свойства, получение и применение металлов побочных подгрупп.
Уметь составлять электронные формулы атомов металлов побочных подгрупп на примере меди, железа, хрома; записывать уравнения реакций, характеризующих химические свойства, способы получения.
Тип урока: изучение нового материала
I .Организационный момент.
II .Актуализация опорных знаний
Устный опрос по пройденному материалу:
Прежде, чем мы приступим к изучению нового материала вспомним материал прошлого занятия. Постарайтесь ответить на вопросы.
- В какой части Периодической системы в основном расположены металлы?
Ответ: в левой нижней части таблицы
- Что общего в физических свойствах всех металлов?
Ответ: высокая электрическая проводимость, теплопроводность, ковкость, пластичность
- По каким характерным физическим свойствам металлы в значительной степени отличаются друг от друга?
Ответ: по плотности, твердости, температуре плавления
- Назовите самый легкий и самый тяжелый металл
Ответ: самый легкий литий, тяжелый осмий
- У какого из металлов самая низкая и самая высокая температура плавления?
Ответ: ртуть –38,9 ; вольфрам 3390
- Какие металлы мы изучали на последнем занятии?
Ответ: металлы главных подгрупп
- Назовите несколько металлов главных подгрупп
Ответ: литий, натрий, калий, магний, кальций и др.
- Назовите общее химическое свойство металлов главных подгрупп
Ответ: это их способность легко отдавать валентные электроны вследствие гораздо большего атомного радиуса по сравнению с неметаллическими элементами, поэтому являются восстановителями
III .Самоопределение к деятельности
- На сегодняшнем занятии мы познакомимся с еще одной группой металлов, среди которых наибольшее практическое значение имеют: медь, цинк, титан и железо
- Возникает вопрос, почему эти металлы изучаются отдельно?
Чтобы ответить на этот вопрос – выясните в чем отличие в расположении этих элементов в таблице Менделеева от ранее изученных металлов?
Ответ: эти металлы находятся в побочных подгруппах
- Какие цели вы ставите перед собой на уроке?
Ответ: узнать, изучить строение, свойства и применение металлов побочных подгрупп
- Давайте вместе обсудим план работы на сегодняшнем занятии. Предложите свои пункты плана по которому можно будет достичь вашей цели на уроке.
Ответ: предлагают изучить строение, физические, химические свойства и т.д
1) Исторические данные
2) Строение атома
3) Физические свойства
4) Химические свойства
В течении урока, вам необходимо будет сделать краткий конспект - записать необходимые данные, которые вы узнаете на занятии.
IV. Изучение нового материала
б) Строение атома
– Электронное строение атомов меди, железа, хрома
Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).

в) Физические свойства меди, железа, хрома
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Медь — довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло - и электропроводностью . Tплавл= 10830С. ρ = 8,96г/см3. СО: 0,+1,+2
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. Tплавл=15390С. ρ = 7,87г/см3.
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С
г) Химические свойства меди, железа, хрома
Химические свойства меди
I. Взаимодействие с простыми веществами.
1. При высокой температуре взаимодействует с кислородом: 2Cu + O2 2CuO
2. Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 CuCl2
II. Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3( разб .) → 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3( конц .) → Cu(NO3)2 + 2NO2↑+ 2H2O
Cu + 2H2SO4( конц .) → CuSO4 + SO2↑+2H2O
Химические свойства железа
I. Взаимодействие с простыми веществами.
1. Горит в кислороде, образуя окалину - оксид железа (II, III): 3Fe + 2O2 → Fe3O4
2. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 2FeBr3
II. Взаимодействие со сложными веществами.
1. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O Fe3O4 + 4H2 ↑
2. На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
3. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4( разб .) → FeSO4 + H2↑
4. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H2SO4( конц .) Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3( конц .) Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
Химические свойства хрома
I. Взаимодействие с простыми веществами.
1. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом , кремнием, бором, серой, фосфором.
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
II. Взаимодействие со сложными веществами.
1. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Получение меди
1. Восстановлением из оксидов углём или оксидом углерода (II): CuO + C Cu + CO
CuO + CO Cu + CO2
2. При электролизе солей меди: 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Получение железа
1. Восстановлением из оксидов углём или оксидом углерода (II)
Fe2O3 + 3CO 2Fe + 3CO2
Получение хрома
1. Алюминотермия: Cr2O3 + 2Al Al2O3 + 2Cr
2. Восстановлением оксидов хрома оксидом углерода (II), водородом :
CrO + Н2 Cr + H2O
е) Применение меди, железа, хрома
V .Закрепление
– Напишите электронное строение атома меди
– Допишите уравнения реакций:
а) Fe + O 2 б) Cr + H 2 SO 4 в) Cu + Cl 2
Тест по теме урока
1) Электронная формула 1s 2 2s2 2p6 3s2 3p6 3d2 4s2 принадлежит:
а) Zn б) Ti в) Cu г) Fe
2) Определите металл по следующим данным: светло-розовый цвет, тягучий, вязкий, легко прокатывается. Температура плавления 1083С. По проводимости электрического тока уступает лишь серебру.
а) Zn б) Ti в) Cu г) Fe
3) Степень окисления железа в формуле Fe2O3:
а) –2 б) + 4 в) + 2 г) + 3
4) Металлические свойства в ряду Ti Cr Fe:
а) уменьшаются б) увеличиваются в) не изменяются г) изменяются периодически
5) В схеме превращений Cr → CrCl 3 → Cr ( OH ) 3
веществами x и y могут быть соответственно
а) Cl 2 , H 2 O б) Cl 2 , NaOH в) NaCl , KOH г) HCl , KOH
VI .Итог урока.
VII .Рефлексия.
Какая цель была на уроке _________________
Достиг ли ты поставленной цели ____________
Что тебе помогло достичь цели? _______________
Я узнал на уроке _____________
Я не согласен _____________
На уроке столкнулся со следующими трудностями ___________
Поставьте себе оценку за урок _______
VIII . Домашнее задание: изучить § 28
Выполните одно из трех заданий по своим возможностям


У элементов III В группы атомные радиусы возрастают , химическая активность увеличивается, благодаря чему они проявляют большее сходство с элементами главных подгрупп, чем побочных. По реакционной способности элементы подгруппы скандия уступают лишь щелочным и щелочноземельным металлам.
В периодах слева направо металлические свойства уменьшаются.
Минимальные восстановительные свойства проявляют тяжелые металлы VIIIB и IB – групп. За свою инертность они названы благородными.

В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня.
В образовании связей могут участвовать все или только часть d-электронов предпоследнего энергетического уровня, поэтому образуются соединения с различной валентностью или степенью окисления (кроме d-элементов II и III групп).
Например, характерными для элементов VIII В группы являются следующие степени окисления (в скобках – наиболее устойчивые):
Fe Co Ni семейство железа
Ru Rh Pd легкие платиновые металлы
О s Ir Pt тяжелые платиновые металлы

Таким образом,
особенностями электронного строения d-элементов обусловлены и их свойства:
а) большое разнообразие проявляемых валентностей и степеней окисления;
б) способность образовывать различные комплексные соединения;
в) каталитическая активность.

Физические свойства d- металлов
Физические свойства переходных металлов зависят от электронного строения, от числа неспаренных d-электронов, которые могут участвовать в образовании связей.
- Металлы, у которых по3–4 неспаренныхd-электрона (VВ и VIВ группы), имеют максимальную температуруплавления и кипения.
- Переходные металлы, имеющиена внешнемs-подуровне один электрон, как правило, имеют более высокую электрическую проводимость (Cr, Мo и особенно Cu, Ag, Au).
Химические свойства d -металлов
Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается.
Наиболее сильными восстановителями являются металлы IIIВ группы.
У большинства d-элементов образуются защитные оксидные пленки , вызывающие их пассивацию и предохраняющие их от коррозии. Наиболее склонны к пассивации металлы IVВ–VIВ групп.
Элементы IIIВ и IIВ групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а лантан взаимодействует и с водой.
Не взаимодействуют с разбавленными кислотами металлы IВ группы, ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt).
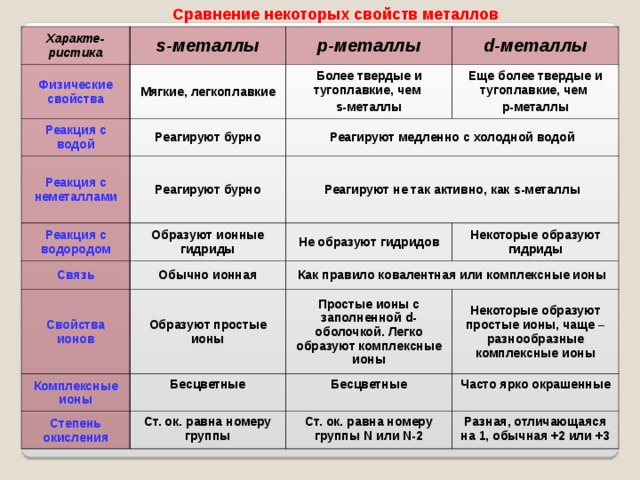
Сравнение некоторых свойств металлов
Характе-ристика
s -металлы
Физические свойства
р-металлы
Реакция с водой
Мягкие, легкоплавкие
d- металлы
Более твердые и тугоплавкие, чем
s -металлы
Реагируют бурно
Реакция с неметаллами
Еще более твердые и тугоплавкие, чем
Реагируют медленно с холодной водой
Реагируют бурно
Реакция с водородом
Реагируют не так активно, как s -металлы
Образуют ионные гидриды
Свойства ионов
Не образуют гидридов
Обычно ионная
Как правило ковалентная или комплексные ионы
Некоторые образуют гидриды
Образуют простые ионы
Комплексные ионы
Простые ионы с заполненной d- оболочкой. Легко образуют комплексные ионы
Степень окисления
Некоторые образуют простые ионы, чаще – разнообразные комплексные ионы
Ст. ок. равна номеру группы
Часто ярко окрашенные
Ст. ок. равна номеру группы N или N -2
Разная, отличающаяся на 1, обычная +2 или +3
Строение и свойства соединений d -элементов зависят от степени окисления металла
Степень окисления элемента
Низшая
Свойства соединений
восстановительные
Промежуточная
Высшая
Амфотерные, окислительно-восстановительные
Mo 2+ , V 2+ , Mn 2+ , Cu + , Fe 2+
окислительные
Ковалентно-полярный
Преимущественно ковалентный
Mo 3+ , Mn 4+ , Cr 3+ , Fe 3+
Mo 6+ , V 5+ , Mn 7+ , Cr 6+

Оксиды и гидроксиды d -элементов
Переходные металлы реагируют с кислородом, образуя оксиды ( искл . Ag, Au) . Почти все они нерастворимы в воде, черного или иного цвета. Обладают заметной ковалентностью связей.
Оксид железа ( II ) FeO,
магнитный железняк (магнетит) Fe 3 O 4
и красный железняк (гематит) Fe 2 O 3 (в чашке).
Оксид хрома С r 2 O 3

![Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком: Осадок Цвет Реакция Cr(OH) 3 с NaOH (водн.) зеленый Mn(OH) 2 с NH 3 (водн.) бежевый CrO 3 3- Fe(OH) 2 Fe(OH) 3 - - зеленый ржавый - - Co(OH) 2 - Ni(OH) 2 - розовый зеленый - [Co(OH) 4 ] 2- Cu(OH) 2 [Co(NH 3 ) 6 ] 2+ - голубой Zn(OH) 2 [Ni(NH 3 ) 4 ] 2+ бесцветный - [Cu(NH 3 ) 4 ] 2+ [Zn(OH) 4 ] 2- [Zn(NH 3 ) 4 ] 2+](https://fsd.multiurok.ru/html/2017/11/02/s_59fa3a12dc15c/img14.jpg)
Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком:
Осадок
Реакция
Cr(OH) 3
с NaOH (водн.)
зеленый
Mn(OH) 2
с NH 3 (водн.)
бежевый
CrO 3 3-
Fe(OH) 2
Fe(OH) 3
зеленый
ржавый
Co(OH) 2
Ni(OH) 2
розовый
зеленый
[Co(OH) 4 ] 2-
Cu(OH) 2
[Co(NH 3 ) 6 ] 2+
голубой
Zn(OH) 2
[Ni(NH 3 ) 4 ] 2+
бесцветный
[Cu(NH 3 ) 4 ] 2+
[Zn(OH) 4 ] 2-
[Zn(NH 3 ) 4 ] 2+
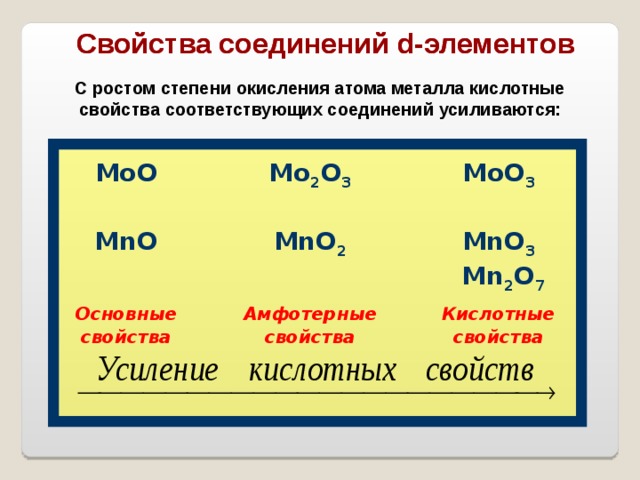
Свойства соединений d -элементов
Свойства соединений d -элементов
С ростом степени окисления атома металла кислотные свойства соответствующих соединений усиливаются:
M о 2 O 3
MoO 3
MnO 2
Основные
свойства
Амфотерные
свойства
MnO 3
Mn 2 O 7
Кислотные
свойства
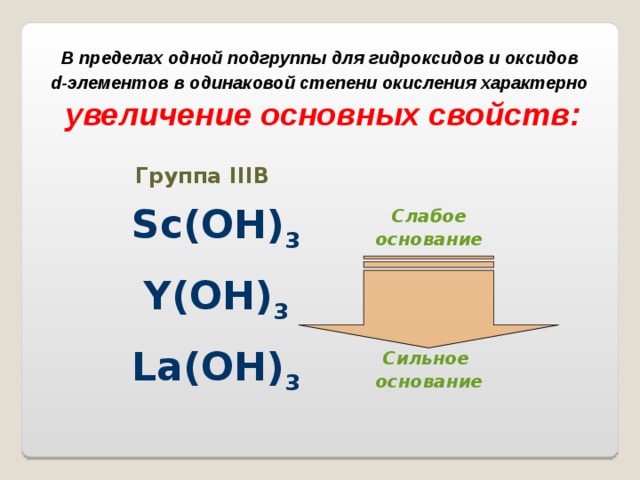
В пределах одной подгруппы для гидроксидов и оксидов
d -элементов в одинаковой степени окисления характерно
увеличение основных свойств:
Группа III В
Sc(OH) 3
Слабое
основание
Y(OH) 3
La(OH) 3
Сильное
основание

В периоде кислотные свойства гидроксидов в высшей степени окисления металла усиливаются:
Ti(OH) 4 – HVO 3 – H 2 CrO 4 – HMnO 4 – H 2 FeO 4
Читайте также:

