Сообщение на тему газообразные вещества
Обновлено: 02.07.2024
Характеристика и физические свойства газов. Особенности взаимодействия частиц. Законы обмена энергиями при столкновениях. Действие молекулярных структур в жидкости. Исследование процессов горения твердых и жидких веществ. Механизм образования пламени.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.12.2014 |
| Размер файла | 19,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Муниципальное общеобразовательное учреждение
Киришская средняя общеобразовательная школа №3
Реферат по предмету
Выполнила ученица школы №3
1. Газообразное состояние вещества
2. Капельно-жидкое состояние вещества
Список используемой литературы
Введение
Газообразное состояние вещества характеризуется главным образом весьма малыми молекулярными силами сцепления, вследствие чего газ стремится занять максимальный объем.
Газообразное состояние вещества наиболее доступно для понимания; жидкое состояние уже значительно менее понятно, а твердое вещество может, по-видимому, считаться наиболее сложным. Порошки часто называют четвертым состоянием вещества. Кроме того, явления на границах раздела твердое тело - твердое тело и твердое тело - газ 3 относятся к наименее изученным аспектам твердого состояния.
Газообразное состояние вещества в основном характеризуется весьма малыми межмолекулярными силами сцепления.
1. Газообразное состояние вещества
Газообразное состояние вещества характеризуется тем, что мельчайшие частицы вещества - атомы или молекулы - большую часть времени пребывают сравнительно далеко друг от друга. Силы взаимодействия между ними оказывают заметное действие только в течение весьма коротких промежутков времени, когда частицы газа сталкиваются между собой. Поэтому действие молекулярных сил выражается только в обмене энергиями при столкновениях. Чем меньше плотность газа, тем больше свободный пробег его молекул и, следовательно, тем меньше влияния оказывают молекулярные силы на общее поведение газа при тех или иных изменениях его состояния.
Газообразное состояние вещества очень распространено. Газы участвуют в важнейших химических реакциях, являются теплоносителями и источниками энергии. Он распространил закон сохранения энергии на тепловые явления, полагая, что частицы газов находятся в непрерывном хаотическом движении, сталкиваются и отталкиваются друг от друга в беспорядочной взаимности. Позже была развита теория газов на основе следующих положений:
1) газ состоит из огромного числа молекул, находящихся в непрерывном тепловом движении;
2) молекулы подчиняются законам механики, между ними отсутствует взаимодействие;
3) постоянно происходящие между молекулами столкновения подобны столкновениям между абсолютно упругими шарами и происходят без потери скоростей. Молекулы лишь меняют направление движения, а их общая кинетическая энергия остается постоянной.
Газообразное состояние вещества характеризуется малым взаимодействием между его частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых отношениях. При очень высоких давлениях, когда плотность газа приближается к плотности жидкости и газ нельзя считать идеальным даже приближенно, может наблюдаться ограниченная растворимость.
Газообразное состояние вещества ( газ) - агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, равномерно заполняя в отсутствие внешних полей весь предоставленный им объем.
Газообразное состояние вещества характеризуется беспорядочным тепловым движением молекул. Последние соударяются друг с другом и со стенками сосуда, в котором находится газ. Удары молекул о стенки сосуда создают давление, которое численно равно силе ударов, приходящихся на единицу поверхности стенок.
Газообразное состояние вещества является наиболее простым по своим свойствам, особенно при не слишком больших давлениях и не слишком низких температурах.
Если, например, при больших давлениях ( больше 100 атм) такие газы, как О2, N2 и Н2, взятые при одинаковых начальных температурах и давлениях, будут иметь заметные отличия по сжимаемости и тепловому расширению, то при давлениях, близких к одной атмосфере, индивидуальные различия указанных и других газов сглаживаются.
Газообразное состояние вещества характеризуется тем, что мельчайшие частицы вещества - атомы или молекулы - большую часть времени пребывают сравнительно далеко друг от друга. Силы взаимодействия между ними оказывают заметное действие только в течение весьма коротких промежутков времени, когда частицы газа сталкиваются между собой.
Поэтому действие молекулярных сил выражается только в обмене энергиями при столкновениях. Чем меньше плотность газа, тем больше свободный пробег его молекул и, следовательно, тем меньше влияния оказывают молекулярные силы па общее поведение газа при тех или иных изменениях его состояния.
Газообразное состояние вещества характеризуется тем, что мельчайшие частицы вещества - - атомы или молекулы - большую часть времени пребывают сравнительно далеко друг от друга. Силы взаимодействия между ними оказывают свое действие только в течение весьма коротких промежутков времени, когда частицы газа сталкиваются между собой.
Поэтому действие молекулярных сил выражается только в обмене энергиями при столкновениях. Чем меньше плотность газа, тем больше свободный пробег его молекул и, следовательно, тем меньше влияния оказывают молекулярные силы на общее поведение газа при тех или иных изменениях его состояния.
Газообразное состояние вещества характеризуется ничтожно малыми силами, действующими между молекулами этого вещества, причем размеры самих молекул по сравнению со средними расстояниями между ними также малы. Движение молекул газа в межмолекулярных пространствах до их столкновения совершается равномерно, прямолинейно и беспорядочно.
Газообразному состоянию вещества соответствует полный молекулярный беспорядок.
Газообразному состоянию вещества соответствует полный молекулярный беспорядок. Такому распределению молекул ( или атомов) соответствует очень большое число всевозможных перегруппировок молекул в пространстве. Однако физические свойства вещества при всех этих перегруппировках остаются неизменными. Поэтому им всем соответствует одно газообразное состояние.
Различают капельно-жидкое и газообразное состояние вещества.
Для газообразного состояния вещества, согласно закону Авогадро, при постоянной температуре и давлении количество атомов в единице объема постоянно.
Разновидность газообразного состояния вещества; отличается тем, что может находиться в равновесии с тем же веществом в конденсированном состоянии.
Различают капельно-жидкое и газообразное состояния вещества.
2. Капельно-жидкое состояние вещества
Капельно-жидким называется состояние, отличающееся почти полной несжимаемостью тела и весьма малой его температурной расширяемостью; плотность капельно-жидких тел остается почти неизменной, не зависящей от давления и температуры.
Под газообразным состоянием вещества понимается такое его состояние, которое характеризуется значительной подвижностью частиц. Вещество в газообразном состоянии вследствие большой подвижности молекул газа не может иметь определенного объема и формы; оно занимает всегда весь объем и имеет форму сосуда, в котором находится.
Под газообразным состоянием вещества понимается такое его состояние, которое характеризуется значительной подвижностью частиц. Вещество в газообразном состоянии вследствие большой подвижности молекул газа не может иметь определенного объема и формы: оно занимает всегда весь объем и имеет форму сосуда, в котором находится.
Адиабатическое расширение газа в пустоту. В газообразном состоянии вещества внутренняя энергия сравнительно просто может быть определена экспериментально. Для этого достаточно исследовать адиабатическое расширение газа в пустоту. Впервые такой опыт был проведен Гей-Люссаком, а затем Джоулем.
Характерной особенностью газообразного состояния вещества является то, что между его молекулами практически отсутствуют силы взаимного притяжения.
Различные состояния вещества. Если признаки газообразного состояния вещества очевидны (отсутствие собственного объема и, тем более, формы), то при оценке конденсированного состояния ( твердое или жидкое) могут возникнуть кажущиеся противоречия. Поэтому, указывая, в каком состоянии находится вещество, следует уточнять признаки, по которым это сделано.
Что касается газообразного состояния веществ при низких плотностях, то эта единая обобщающая зависимость, как видно из рисунка, не соблюдается.
И действительно, газообразное состояние вещества является примером существующего в природе полного, совершенного беспорядка во взаимном расположении и движении частиц. Нет такого микроскопа, который позволил бы увидеть движение газовых молекул, но, несмотря на это, физики могут достаточно детально описать жизнь этого невидимого мира.
В отличие от газообразного состояния вещества, в жидкостях, вследствие весьма большой концентрации молекул, происходит образование отдельных неустойчивых молекулярных структур. Образование молекулярных структур в жидкости усиливается по мере фазового перехода вещества из жидкого состояния в твердое. Наличие молекулярных структур в жидкостях приводит к тому, что молекулярное трение при течении жидкостей по сравнению с газами оказывается значительно большим. Динамическая вязкость у жидкостей больше, чем у газов. Однако вследствие значительно большей плотности жидкостей кинематическая вязкость у жидкостей меньше, чем у газов.
Изотермы в области газообразного состояния вещества представляют собой кривые, имеющие вблизи кривой насыщения положительный угловой коэффициент и обращенные выпуклостью вверх.
Изотермы в области газообразного состояния веществ представляют собой кривые, имеющие вблизи кривой насыщения положительный угловой коэффициент и обращенные выпуклостью вверх. Чем больше температура Т, тем выше располагается соответствующая изотерма.
Энтальпии сгорания и образования конденсированных бициклических углеводородов в ккал / моль при 25 С. Величина относится к газообразному состоянию вещества.
Этот случай соответствует газообразному состоянию вещества.
С молекулярно-кинетической точки зрения газообразное состояние вещества характеризуется большими средними расстояниями между молекулами, тепловое движение газовых молекул сводится к свободному движению на длине свободного пути, в несколько раз превышающего размеры самих молекул. В газах с заметной скоростью происходит диффузия. В жидкостях же молекулы располагаются значительно ближе друг к другу, чем в газах. Они проявляют большие силы взаимодействия. Диффузия в жидкостях происходит гораздо медленнее, чем в газах.
Участку а-б изотермы соответствует газообразное состояние вещества, которое также называют паром.
В термодинамике конденсированное и газообразное состояния вещества характеризуются функциями, которые зависят от таких макроскопических параметров, как давление, температура, объем и масса. Особое значение имеет условие термодинамического равновесия, при котором два состояния вещества, например конденсированная фаза и ее пар, существуют при одной и той же температуре в контакте друг с другом без каких-либо изменений во времени. Это означает, что количество испаряющегося вещества должно быть равно количеству конденсирующегося вещества за все время, пока поддерживается равновесие. При этих условиях твердые тела и жидкости характеризуются определенным давлением паров, которое зависят только от температуры.
Образование пламени связано с газообразным состоянием вещества. Даже при горении твердых или жидких веществ происходит их переход в газообразное состояние.
Образование пламени связано с газообразным состоянием веществ, поэтому горение жидких и твердых веществ предполагает их переход в газообразную фазу. В случае горения жидкостей этот процесс обычно заключается в простом кипении с испарением у поверхности. Большинство пожаров связано с горением твердых материалов, хотя начальная стадия пожара может быть связана с горением жидких и газообразных горючих веществ, широко используемых в современном промышленном производстве.
Образование пламени связано с газообразным состоянием вещества, поэтому горение жидких и твердых веществ, сопровождающееся возникновением пламени, предполагает их предварительный переход в газообразную фазу. В случае горения жидкостей этот процесс обычно заключается в простом кипении с испарением у поверхности, в товремя как при горении почти всех твердых веществ образование продуктов, способных улетучиваться с поверхности материалам попадать в область пламени, происходит путем химического разложения или пиролиза.
Пока эти методы ограничены только газообразным состоянием веществ и хорошо применимы главным образом к несложным молекулам или к молекулам, для которых благодаря их симметрии расчеты могут быть значительно упрощены. Выявившиеся в отдельных случаях расхождения оказались связанными с тонкими особенностями внутреннего строения и служат теперь для количественной термодинамической характеристики этих особенностей.
В лекционном материале о газообразном состоянии вещества для студентов агрономического профиля следует привести основные сведения о воздушном режиме почв в зависимости от условий увлажнения и его значении для плодородия этих почв.
Перегретым или ненасыщенным паром называют газообразное состояние вещества при температурах, больших температуры насыщения Ts при данном давлении.
Парами же принято считать такое газообразное состояние вещества, из которого оно при небольшом охлаждении или повышении давления сравнительно легко переходит в жидкое состояние.
В чем заключаются принципиальные отличия газообразного состояния вещества от его конденсированных состояний.
Как известно, при изучении газообразного состояния вещества было введено понятие об идеальном газе. Свойства этого газа точно описываются общеизвестными законами, называемыми законами идеального газа. Для реальных газов эти законы соблюдаются более или менее точно при некоторых условиях.
Поскольку в дальнейшем нами рассматривается лишь плазменное и газообразное состояние вещества, остановимся на обсуждении тех методов расчета критических параметров металлов, которые заимствованы из теории плотных газов. Возможно, по-видимому, применение для этой цели метода групповых разложений Майера. В этом случае, однако, требуется его обобщение на случай многокомпонентных систем с существенно различными потенциалами взаимодействия. В [116, 117] был выполнен расчет первых четырех групповых интегралов для паров натрия и лития, а также их термодинамических функций. Получено практически полное совпадение с экспериментальными данными [24] в области сравнительно низких давлений р 40 атм. Проанализирован рост относительного вклада высших групповых интегралов в термодинамические параметры с увеличением давления.
газ физический молекулярный энергия
Заключенние
Силы межмолекулярного взаимодействия проявляются лишь тогда, когда молекулы подходят друг к другу на достаточно близкое расстояние. Слабое межмолекулярное взаимодействие определяет малую плотность газа и его основные характерные свойства - стремление к безграничному расширению и способность оказывать давление на стенки сосуда, препятствующее этому стремлению.
При малых давлениях и высокой температуре все типичные газы ведут себя приблизительно одинаково. Но уже при обычных температурах и давлениях проявляются индивидуальные свойства газов. Существенные различия, связанные с природой составляющих газ частиц, особенно сильно проявляются при больших давлениях и температурах, то есть при условиях, в которых газы практически не используются в технике.
Состояние газа полностью характеризуется его температурой, давлением, объемом, массой и молярной массой.
Законы, которые связывают эти параметры, для всех газов очень близки, а абсолютно точны для идеального газа, у которого между частицами полностью отсутствует взаимодействие, и частицы которого представляют собой материальные точки.
Вспомним эти законы: закон объемных отношений, закон Авогадро, закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля и объединенный газовый закон Менделеева-Клайперона.
Список используемой литературы
1. Химия - Учебное пособие (Монич Т.П.)
Подобные документы
Физико–химические основы горения и взрыва. Тепловая, цепная и диффузная теории горения веществ, взрывчатые вещества. Свойства твердых топлив и продуктов сгорания, термодинамические свойства продуктов сгорания. Виды пламени и скорость его распространения.
курс лекций [1,7 M], добавлен 05.01.2013
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы - ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Содержание теории теплорода и описание атомного состава вещества. Раскрытие молекулярных свойств вещества. Природа хаотичного движения малых частиц взвешенных в жидкости или газе, уравнение броуновского движения. Свойства и объём молекул идеального газа.
презентация [127,2 K], добавлен 29.09.2013
Сущность топлива, его разновидности и применение. Основные процессы горения жидких, твердых и газообразных топлив. Содержание летучих веществ в ископаемом твердом топливе. Время протекания физических процессов. Температура кипения жидких топлив.
реферат [64,9 K], добавлен 04.12.2014
Понятие вещества и его состояния (твердое, жидкое, газообразное, плазменное), влияние изменения температуры. Физическое состояние газа, характеризующееся величинами: температура, давление, объем. Формулировка газовых законов: Бойля-Мариотта, Гей-Люссака.
презентация [1,1 M], добавлен 09.04.2014
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул - минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Математическая модель и решение задачи очистки технических жидкостей от твердых частиц в роторной круговой центрифуге. Система дифференциальных уравнений, описывающих моделирование процесса движения твердой частицы. Физические характеристики жидкости.

Соединение, находящееся в одном из основных агрегатных состояний, при котором составные частицы слабо связаны между собой, называется газом или газообразным веществом. Частицы газа движутся хаотично и в некоторых случаях могут переходить в жидкое и твёрдое состояния.
Получение
Существуют вещества, которые при нормальных условиях сохраняются в газообразном агрегатном состоянии. Их можно разделить на две группы:
- простые – азот, кислород, хлор;
- сложные – аммиак, метан, углекислый газ.
Газы выделяют из атмосферы или природного газа путём окисления и адсорбции примесей.
Образованию газообразного состояния веществ способствует изменение нормальных условий. Жидкие или твёрдые вещества нагревают, тем самым разрушая химические связи и высвобождая отдельные молекулы в воздух. Например, жидкая вода при нагревании легко превращается в водяной пар, а твёрдый йод выделяет фиолетовые пары.

Рис. 1. Фиолетовые пары йода.
В лабораториях газ получают путём разложения (сжигания) сложных веществ или реакцией жидких и твёрдых соединений. Способы получения некоторых газов:
Полученный газ обнаруживают разными способами. Например, пропускают через жидкость и наблюдают за изменением цвета, прозрачности (известковое молочко мутнеет в присутствии углекислого газа). Некоторые газы поддерживают горение или, наоборот, тушат тлеющую лучину.
Физические свойства
Молекулы газообразного вещества постоянно движутся, а расстояние между ними значительно превышает их диаметр. Благодаря такому расположению частиц газы не имеют формы, легко смешиваются и сжимаются.
Газообразные соединения приобретают форму сосуда, в котором находятся. Ударяясь о стенки сосуда с определённой скоростью, газы создают давление. Чем интенсивнее молекулы воздействуют на сосуд, тем выше давление.
Различные газообразные соединения смешиваются между собой в любых пропорциях. Природный газ – это смесь метана, водорода, сероводорода, углекислого газа, азота, гелия. Атмосфера состоит из смесей простых и сложных газообразных веществ – азота, кислорода, водорода, углекислого газа, водяного пара.

Рис. 3. Соотношение газов в атмосфере.
При сжатии объём газов становится значительно меньше. Например, объём кислорода уменьшается в 200 раз.
Описание некоторых газообразных веществ представлено в таблице.
Формула
Физические свойства
Нахождение в природе
Самый лёгкий газ, легче воздуха в 14,5 раз. Не имеет вкуса, запаха, цвета. Плохо растворяется в воде (18,8 мл/100 г), но хорошо растворяется в металлах, особенно в палладии. Сжижается при -252,76°C
В земной коре – 1 %, незначительное количество в атмосфере. Большая часть водорода присутствует в виде соединений
Не имеет вкуса, цвета, запаха. Немного тяжелее воздуха. Плохо растворяется в воде (4,9 мл/100 г) и спирте (2,78 мл/100 г), но хорошо растворяется в жидком серебре. Сжижается при -182,98°C
47 % земной коры состоит из кислорода. Моря и пресные водоёмы содержат 85 % кислорода. В атмосфере – 20 %
Бесцветный газ без запаха. Плохо растворим в воде (2,3 мл/100 г). Атомы азота связаны тройной трудно разрываемой связью. Сжижается при -195,8°C
Жёлто-зелёный газ с запахом. Легко сжижается уже при -34°C. При давлении в 0,8 МПа и комнатной температуре становится жидким. Плохо растворяется в воде (1,48 мл/100 г), хорошо растворяется в бензоле и хлороформе
Наиболее распространённый галоген. В природе встречается только в составе минералов
Бесцветный газ, не имеющий запаха при малых концентрациях. В большом количестве имеет кислый запах. В 1,5 раза тяжелее воздуха. Кристаллизуется при -78,3°С. Жидкое состояние получают при комнатной температуре и давлении в 6 МПа
В атмосфере содержится меньше 1 %
Бесцветный газ с резким запахом. В два раза тяжелее воздуха. Хорошо растворяется в воде
Образуется путём разложения азотсодержащих веществ
За счёт свободного движения молекул газ равномерно распространяется в ограниченном пространстве. Такое явление называется диффузией. Яркий пример диффузии – распространение запахов. При приготовлении пищи на кухне запах постепенно распространяется по всей квартире.
Что мы узнали?
Газ – вещество, состоящее из хаотично движущихся частиц – молекул или атомов. Газообразные соединения можно получить выделением из атмосферы путём адсорбции и окисления. Также газ получают из жидких и твёрдых веществ путём изменения условий или взаимодействием простых и сложных веществ. Газы не имеют формы, легко смешиваются между собой и равномерно распределяются в закрытом пространстве. Наиболее распространённый газ в атмосфере – азот. Самый лёгкий газ.
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ - это природные обитатели, формирующиеся естественным путем. Другая половина - искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.

Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы - это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород - О2, озон - О3, водород - Н2, хлор - CL2, фтор - F2, азот - N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен - С2Н4;
- ацетилен или этин - С2Н2;
- метиламин - CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия - одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение - жидкость превращается в пар, сублимация - твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких - сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов - процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
-
в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*10 23 молекул для 1 моль любого газа.
- Ферми - создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт - фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
- фосфор белый - одна из аллотропных модификаций данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон - О3). Тип связи - ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях - темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа - I2.

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений - важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием "газ" обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь - это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден - кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ - необходимый продукт "питания" для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ - важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы - это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены - газы. Бром - это жидкость при обычных условиях, а йод - легко возгоняющееся твердое вещество. Фтор и хлор - ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
В газообразное состояние Это агрегатное состояние вещества, в котором частицы удерживаются вместе за счет слабого взаимодействия, будучи способными двигаться во всех направлениях контейнера, в котором они находятся. Из всех физических состояний материи газообразное состояние проявляет наибольшую свободу и хаос.
Газы оказывают давление, переносят тепло и состоят из самых разных мелких частиц. Наша атмосфера и воздух, которым мы дышим, являются проявлением газообразного состояния здесь, на Земле.
Примерами газов являются парниковые газы, такие как водяной пар, двуокись углерода, метан или озон. Углекислый газ, который мы выдыхаем при дыхании, является еще одним примером газообразного вещества.
Например, жидкости и твердые тела не будут перемещаться за пределы их собственных материальных пределов, а газы этого не делают. Дым от сигарет, дымоходов и башен сам по себе демонстрирует, как газ поднимается и рассеивается в окружающей среде, не останавливая его.
Характеристики газообразного состояния
Не хватает объема или формы
Газообразное состояние характеризуется отсутствием определенной формы или объема. Если нет границ, чтобы сдерживать его, он распространится по атмосфере. Как и гелий, он улетит с Земли.
Газ может принимать только форму контейнера. Если баллон имеет цилиндрическую форму, газ будет иметь форму баллона.
Плохой проводник тепла
Это состояние также характеризуется плохим проводником тепла и электричества. Обычно он менее плотный по сравнению с твердым и жидким состояниями.
Поскольку большинство газов, таких как кислород и углекислый газ, бесцветны, вы можете определить их количество в контейнере, измерив их давление.
Реагенты
Газы, как правило, более реактивны, за исключением благородных газов, чем жидкости или твердые вещества, поэтому они потенциально опасны либо из-за опасности возгорания, либо из-за того, что они могут легко попасть в дыхательные системы людей.
Мелкие частицы
Газообразные частицы также обычно имеют небольшие размеры и представляют собой атомы или простые молекулы.
Например, водород, H2, представляет собой очень маленькую молекулу, состоящую из двух атомов водорода. У нас также есть гелий He, атомы которого еще меньше.
Взаимодействия
Взаимодействия в газообразном состоянии незначительны. В этом он сильно отличается от жидкого и твердого состояний, в которых его частицы обладают высокой степенью сцепления и сильно взаимодействуют друг с другом. В молекулах, образующих жидкое и твердое состояния, едва ли существует определенный молекулярный вакуум между ними.
Частицы в газообразном состоянии очень далеко друг от друга, между ними большой вакуум. Это уже не вакуум в молекулярном масштабе. Расстояние, которое их разделяет, настолько велико, что каждая частица в газе свободна, безразлична к своему окружению, если только по своей хаотической траектории она не сталкивается с другой частицей или о стенку контейнера.
Если предположить, что контейнера нет, вакуум между частицами газа может быть заполнен воздухом, который толкает и увлекает газ в направлении его потока. Вот почему воздух, состоящий из газовой смеси, способен деформировать и разносить газообразные вещества по небу, если они не намного плотнее его.
Общий закон газообразного состояния
Экспериментальное изучение поведения и механики газов привело к появлению нескольких законов (Бойля, Шарля, Гей-Люссака), которые объединены, чтобы можно было предсказать, какими будут параметры любой газовой системы или явления, то есть каковы будут ее температура, объем. и давление.
Этот общий закон имеет следующее математическое выражение:
Где K - постоянная величина, P - давление, V - объем, а T - температура газа по шкале Кельвина. Таким образом, зная две переменные (скажем, P и V), можно решить третью, которая станет неизвестной (T).
Этот закон позволяет нам узнать, например, какой должна быть температура газа, заключенного в контейнер объемом V, чтобы показать давление P.
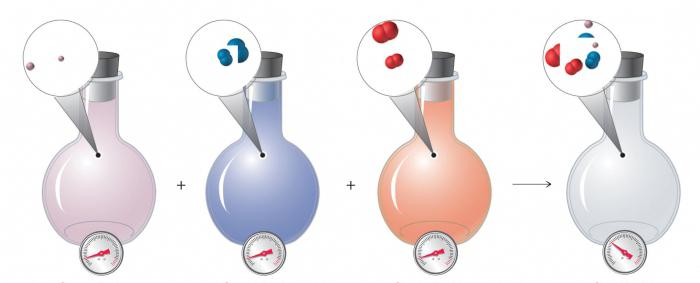
Если к этому закону мы добавим вклад Амадея Авогадро, то мы получим закон идеального газа, который также включает количество частиц, а вместе с ними и молярную концентрацию газа:
куда п соответствует количеству молей газа. Уравнение можно переписать как:
куда c - молярная концентрация газа (п/ V). Таким образом, из общего закона получается идеальный закон, который описывает, как связаны давление, концентрация, температура и объем идеального газа.
Примеры газообразного состояния
Газообразные элементы
Сама таблица Менделеева предлагает хороший репертуар примеров элементов, которые встречаются на Земле в виде газов. Между ними у нас есть:
Это не означает, что другие элементы не могут переходить в газообразное состояние. Например, металлы могут превращаться в газы, если они подвергаются температурам выше, чем их соответствующие точки кипения. Таким образом, могут быть газы из частиц железа, ртути, серебра, золота, меди, циркония, иридия, осмия; из любого металла.
Газообразные соединения
В следующем списке у нас есть несколько примеров газообразных соединений:
-Оксид углерода, CO
-Диоксид углерода, CO2 (газ, из которого мы выдыхаем)
-Ammonia, NH3 (жизненно важное вещество для бесконечных производственных процессов)
-Метан, CH4 (бытовой газ, на котором готовится)
-Диоксид азота, НЕТ2 (газ коричневого цвета)
-Фосген, COCl2 (очень ядовитое вещество)
-Воздух (представляющий собой смесь азота, кислорода, аргона и других газов)
-Водяной пар, H2Или (который входит в состав облаков, гейзеров, машинных испарителей и т. Д.).
-Пары йода, I2 (газ пурпурный)
-Гексафторид серы, SF6 (очень плотный и тяжелый газ)
-Хлористый водород, HCl (который при растворении в воде производит соляную кислоту)
Читайте также:

