Сообщение на тему аллотропные модификации кислорода
Обновлено: 02.07.2024
Самый распространенный элемент на Земле в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе.
Озон O 3
Озон - аллотропная модификация кислорода
Физические свойства
Газ, запах свежей хвои, бесцветный, растворим в воде; t° кип = -112°С; t° пл = -193°C.
Получение
Во время грозы ( в природе ), ( в лаборатории ) в озонаторе
Озон в природе
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы. Озон является постоянным компонентом атмосферы Земли и играет важную роль для поддержания на ней жизни. В приземных слоях земной атмосферы концентрация озона чрезвычайно мала и составляет величину порядка 10-7 — 10-6%. Однако с увеличением высоты концентрация озона резко возрастает, проходя через максимум на высоте 20—30 км. Общее содержание озона в атмосфере может быть охарактеризовано слоем озона, приведённого к нормальным условиям (0°С, 1 атм ), и составляет толщину около 0,4—0,6 см. Общее содержание озона в атмосфере переменное, и колеблется в зависимости от времени года и географической широты. Как правило, концентрация озона больше в высоких широтах и максимальна весной, а минимальна осенью. Известно, что атмосферный озон играет ключевую роль для поддержания жизни на земле, выступая в качестве защитной составляющей для живых организмов от жёсткого ультрафиолетового излучения Солнца. С другой стороны, озон является весьма эффективным парниковым газом, и, поглощая инфракрасное излучение поверхности Земли, препятствует её охлаждению. Установлено, что нахождение и перемещение масс озона в атмосфере Земли существенно влияет на метеорологическую обстановку на планете.
Применение озона обусловлено его свойствами
1. сильного окисляющего агента:
для стерилизации изделий медицинского назначения
при получении многих веществ в лабораторной и промышленной практике
для отбеливания бумаги
для очистки масел
2. сильного дезинфицирующего средства:
для очистки воды и воздуха от микроорганизмов (озонирование)
для дезинфекции помещений и одежды
Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие токсинов после обработки. Тогда как при хлорировании возможно образование существенного количества токсинов и ядов, например, диоксина.
Что такое аллотропные модификации?
Многие химические элементы могут существовать в двух, трех или более формах. Каждое из таких видоизменений образовано атомами одного вида. Ученый Я. Берцеллиус в 1841 году первым назвал такое явление аллотропией. Открытую закономерность первоначально применяли только для характеристики веществ молекулярного строения. Например, известны две аллотропные модификации кислорода, атомы которого образуют молекулы. Позже исследователи установили, что видоизменения могут быть среди кристаллов. По современным представлениям, аллотропия является одним из случаев полиморфизма. Различия между формами вызваны механизмами образования химической связи в молекулах и кристаллах. Такую особенность проявляют в основном элементы 13-16 групп периодической таблицы.

Как разное сочетание атомов отражается на свойствах вещества?
Аллотропные модификации кислорода и озона образованы атомами элемента с порядковым номером 8 и таким же количеством электронов. Но они отличаются по строению, что обусловило значительное расхождение в свойствах.

Острый, напоминающий о грозе, свежескошенном сене
Температура плавления (°С)
Растворимость в воде
Выводы по результатам сравнения: аллотропные модификации кислорода не отличаются по качественному составу. Структура молекулы отражается на физических и химических свойствах веществ.
Одинаковое ли количество кислорода и озона в природе?
Как получить кислород и озон?

Молекулярный кислород - важнейшее простое вещество на Земле. Образуется в зеленых частях растений на свету в процессе фотосинтеза. При электрических разрядах природного либо искусственного происхождения двухатомная молекула кислорода распадается. Температура, при которой начинается процесс, составляет около 2000 °С. Часть возникших радикалов соединяется вновь, образуя кислород. Некоторые активные частицы вступают в реакцию с двухатомными молекулами кислорода. В этой реакции получается озон, который также реагирует со свободными радикалами кислорода. При этом возникают двухатомные молекулы. Обратимость реакций приводит к тому, что концентрация атмосферного озона постоянно изменяется. В стратосфере образования слоя, состоящего из молекул O3, связано с ультрафиолетовым излучением Солнца. Без этого защитного экрана опасные лучи могли бы достигнуть поверхности Земли и уничтожить все формы жизни.
Аллотропные модификации кислорода и серы
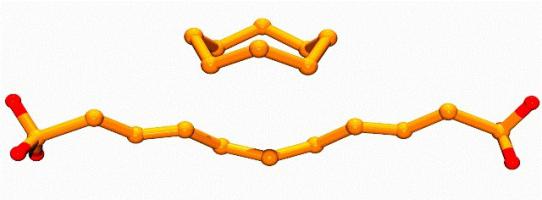
При температуре 119 °С моноклинная форма желтого цвета образует коричневую тягучую массу - пластическую модификацию. Изучение аллотропных видоизменений серы и кислорода имеет большое значение в теоретической химии и практической деятельности.

В промышленных масштабах используются окислительные свойства разных форм. Озон применяется для обеззараживания воздуха и воды. Но при концентрациях свыше 0,16 мг/м3 этот газ опасен для человека и животных. Молекулярный кислород необходим для дыхания, используется в промышленности и медицине. Важную роль в хозяйственной деятельности играют аллотропы углерода (алмаз, графит), фосфора (белый, красный) и других химических элементов.
Перечислите все аллотропные видоизменения кислорода. Дайте краткую характеристику каждому из них: укажите физические и химические свойства и области применения.
Аллотропные видоизменения кислорода насчитывают всего одну модификацию – озон.
При пропускании электрических искр через кислород или воздух появляется характерный запах, причиной которого является образование нового вещества – озона. Озон можно получить из совершенно чистого сухого кислорода; отсюда следует, что он состоит только из кислорода и представляет собой его аллотропическое видоизменение.
Молекулярная масса озона равна 48. Атомная же масса кислорода равна 16; следовательно, молекула озона состоит из трех атомов кислорода — .
Для получения озона пользуются действием тихих электрических разрядов на кислород. Приборы, служащие для этой цели называют озонаторами.
При обычных условиях озон – газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при .
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением:
.
Обратная же реакция – распад озона – протекает самопроизвольно, так как в ходе этого процесса энергия Гиббса системы уменьшается. Иначе говоря, озон – неустойчивое вещество.
Молекула озона построена в форме равнобедренного треугольника. Близость угла, при вершине которого к указывает на то, что центральный атом кислорода находится в состоянии — гибридизации.
Пожалуйста, зарегистрируйтесь или войдите, чтобы добавить ответ.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Выберите язык:
Более 500 авторов онлайн и готовы помочь тебе прямо сейчас! Цена от 20 рублей за задачу. Сейчас у нас проходит акция, мы дарим 100 руб на первый заказ.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

Ахрамович Наталья Михайловна
учитель химии ГБОУ СОШ № 450
Курортного района
Санкт – Петербурга
Аллотропия кислорода.
2013 год

Аллотропия.
Аллотропные модификации кислорода.
История открытия кислорода и озона.
Нахождение в природе.
Строение молекулы.
Физические свойства.
Химические свойства.
Получение в природе.
Значение кислорода и озона в природе.
Проверь себя.
Литература.

Аллотропия
(от греческих слов allos – другой и tropos – образ, способ)
Способность атомов одного элемента
образовывать несколько простых веществ.

Аллотропные модификации кислорода.
О3
озон
(простое вещество)
Х. Ф. Шёнбейн 1839 г.





( 1799 – 1868 )
Кристиан Фридрих Шёнбей
Термин озон предложен немецким химиком X.Ф. Шёнбейном в 1840 г., вошёл в словари в конце 19-ого века. Многие источники именно ему отдают приоритет открытия озона в 1839 г.

Нахождение в природе.
О2
Воздух – 21% по объёму
23% по массе.
О3
Атмосфера (верхний слой) – озоновый экран Земли.

Строение молекулы.
О2 О3
Mr = 32 Mr = 48
устойчив неустойчив


Химические свойства
О2
Сильный окислитель, но не окисляет Au и Pt, окисляет многие металлы, образуя оксиды.
2Cu + O2 = 2CuO
Взаимодействует со всеми неметаллами, кроме галогенов, за исключением F
S+ O2 = SO2
Горение сложных веществ:
2H2S + 3O2 = 2H2O + 2SO2
О3
Очень сильный окислитель, более реакционноспособнее, чем двухатомный кислород.
Окисляет почти все металлы (за исключением золота, платины и иридия).
2Ag + O3 = Ag2O + O2
(комнатная температура)
Окисляет многие неметаллы.
C + 2O3 = CO2+ 2O2
Окисление сложных веществ
2KI + O3 + H2O = 2KOH + I2 +O2

Получение в природе.
О2
6СО2 + 6Н2О = С6Н12О6 + 6О2
Процесс фотосинтеза.
3О2 ⇄ 2О3
Грозовые разряды.

Значение кислорода и озона
в природе.
О2
дыхание
(животные)
О2
гемоглобин
Н2О + СО2
Равновесие всего живого в
природе.
О3
Озоновый слой поглощает солнечные излучения, губительные для всего
живого на ЗЕМЛЕ.

Проверь себя!
1. Что такое аллотропия?
2. Назовите фамилии трех ученых, открывших кислород.
3. В результате какого процесса в природе образуется кислород?
4. Какая химическая реакция происходит при грозовых разрядах?
5. Газ, образующий защитную оболочку Земли.
6. В чём одна из причин многообразия веществ?
Элемент кислород образует две аллотропные модификации: кислород О2 и озон О3. (аллотропия – это способность атома одного элемента образовывать несколько простых веществ.). озон более сильный окислитель, чем кислород. Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел. В атмосфере Земли озоновый слой (на высоте 25 – 30 км) защищает живой мир от космического УФ-излучения. Слой разрушается под воздействием оксидов азота.
Сера образует несколько аллотропных модификаций. Наиболее распространенной является ромбическая сера, состоящая из коронообразных восьмиатомных молекул и образующая ромбоэдральные кристаллы. Она представляет собой твёрдое вещество жёлтого цвета, нерастворимое в воде, в воде не смачиваемое (плавает на поверхности), что используется при её добыче. Ромбическая сера плохо проводит тепло и электричество. Нерастворима в воде, но растворяется в органических растворителях. Лучшим её растворителем является сероуглерод(CS2).
Также существуют ещё две аллотропные модификации серы: моноклинная и пластическая. Моноклинная представляет собой тёмно-жёлтые иглы, а пластическая-коричневую резиноподобную (аморфную) массу, которая образуется, если расплавленную серу вылить в холодную воду. Структура пластической серы представляет собой длинные полимерные цепи, длина которых зависит от условий получения вещества.
При комнатной (или близкой к комнатной) температуре эти модификации превращаются в ромбическую.
Свойства первых двух модификаций приведены в таблице:
| модификация | плотность (кг/м3) | tплавл 0 С |
| ромбическая | 2070 | 112,8 |
| моноклинная | 1960 | 119 |
Фосфор образует несколько аллотропных видоизменений – модификаций. Явление аллотропных модификаций у фосфора вызвано образованием различных кристаллических форм. Белый фосфор (Р4) имеет молекулярную кристаллическую решетку, красный и черный – атомную. Различие в строении кристаллической решетки обуславливает и различие в их физических и химических свойствах. Белый фосфор – сильный яд, даже в малых дозах действует смертельно. В твердом состоянии получается при быстром охлаждении паров фосфора. В чистом виде совершенно бесцветен, прозрачен, по внешнему виду похож на воск: на холоде хрупок, при температуре выше 15 °C – мягкий, легко режется ножом; в воде нерастворим, но хорошо растворяется в сероуглероде – СS2 и в органических растворителях; легко плавится, летуч. Прочность связи в молекуле невелика, чем обусловлена высокая химическая активность. Белый фосфор быстро окисляется на воздухе, при этом светится в темноте – превращение химической энергии в световую; самовоспламеняется на воздухе, при слабом нагревании, незначительном трении. С кислородом реагирует без поджигания, даже под водой, образуя сначала Р2О3, затем P2O5:

При длительном нагревании белый фосфор превращается в красный. Белый фосфор применяется для изготовления боеприпасов артиллерийских снарядов, авиабомб, предназначенных для образования дымовых завес. Широкого применения не имеет.
Красный фосфор – порошок красно-бурого цвета, неядовит, нелетуч, нерастворим в воде и во многих органических растворителях и сероуглероде; не воспламеняется на воздухе и не светится в темноте. Только при нагревании до 260 °C воспламеняется. При сильном нагревании, без доступа воздуха, не плавясь (минуя жидкое состояние) испаряется – сублимируется. При охлаждении превращается в белый фосфор. Идет на изготовление спичек: красный фосфор в смеси с сульфидом сурьмы, железным суриком, с примесью кварца и клея наносят на поверхность спичечной коробки. Головка спичек состоит в основном из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево. Также красный фосфор применяется в приготовлении фармацевтических препаратов.
Черный фосфор получается при сильном нагревании и при высоком давлении белого фосфора. Черный фосфор тяжелее других модификаций. Применяется очень редко – как полупроводник в составе фосфата галлия и индия в металлургии.
Углерод (лат. carboneuia) известен с глубокой древности. В земной коре его содержится примерно 0,35% по массе. В природе углерод встречается в свободном и связанном состоянии, главным образом в виде карбонатов (мел, известняк, мрамор), в каменных и бурых углях, торфе. Углерод входит в состав нефти, природного газа, воздуха, растений, организмов человека и животных. Его соединения составляют основу живой природы - флоры и фауны.
Атом углерода имеет 6 электронов, 2 на внутреннем слое (1s2), а 4 (2s22р2) - на внешнем. С наиболее активными металлами углерод проявляет степень окисления -4. Углерод способен соединяться между собой с образованием прочных длинных цепей.
В отличие от кислорода и азота углерод при обычных условиях не образует молекул, у него атомная кристаллическая решетка. Существуют четыре аллотропных модификации углерода: алмаз, графит, карбин и букибол.
Кристаллическая решетка алмаза состоит из атомов углерода, соединенных между собой очень прочными s-связями. В кристалле алмаза все связи эквивалентны и атомы образуют трехмерный каркас из сочлененных тетраэдров. Алмаз - самое твердое вещество, найденное в природе.
Графит представляет собой темно-серое с металлическим блеском, мягкое, жирное на ощупь вещество. Хорошо проводит электрический ток. В графите атомы углерода расположены в параллельных слоях, образуя гексагональную сетку. Внутри слоя атомы связаны гораздо сильнее, чем один слой с другим, поэтому свойства графита сильно различаются по разным направлениям.
Карбин - получен искусственным путем. Существует два вида карбина: поликумулен =С=С=С=С= и полиин -C=C-C=C-C=C-.
Букибол - получен в 1985г., имеет сферическую форму (как футбольный мяч), состоит из 60 или 70 атомов углерода.
Углерод в виде сажи, кокса, древесного угля, костных углей широко используется в металлургии, синтезе органических веществ, как топливо, в быту.
Читайте также:

