Сообщение на тему аллотропия олова
Обновлено: 05.07.2024
Хотя у других простых элементов, таких как сера, селен, фосфор, железо тоже могут возникать схожие симптомы, проявление их столь маловероятны и незначительны, что они широко известны лишь в узких кругах специалистов химической промышленности.

Резкое ускорение процесса при низких температурах от -31 С° стало причиной всемирно известной катастрофы с экспедицией Скотта. Она имела запас топлива в баках с оловянными паянными швами, от которых на полярном морозе осталась только пыль. После этого, в олово стали добавлять легирующие добавки висмута, свинца, сурьмы или других металлов. Благодаря им, аллотропия олова полностью нейтрализуется или же максимально замедляется. С чистым металлом данный процесс начинает протекать уже при 13 С°, а значит остерегаться его стоит всем, кроме что разве жителей субтропических и тропических стран.
Что же касается химических способов обернуть реакцию вспять, то они попросту нерентабельны, хотя для современной химии и высокотехнологического оборудования невозможного осталось мало. Серое олово перегоняют в белое путём простой переплавки и отлива нужной формы.
Менее известной и разрушительной является высокотемпературная аллотропия олова при 161-232 С°, когда привычный стойкий металл, именуемый Р-5п модификацией, переходит в свою ромбическую форму, которая именуется ромбическим у — оловом.
Металл олово был открыт раньше железа, а его сплав с медью — самый первый, созданный людьми.
Люди отметили значимость бронзы, назвав эпоху своего развития Бронзовым веком.
Неизвестная история
История открытия олова и сплавов из него покрыта пылью времен. Никто не назовет имени первооткрывателя металла, никто не знает — кто догадался первым сплавить олово с медью. Зато известно, что еще 6000 лет назад люди пользовались изделиями из металла.

Происхождение латинского названия ученые выводят из санскритского sta — прочный.
Русское наименование относят к греческим корням. Alophoys по-гечески белый, что указывает на цвет металла.
Свойства Sn

Stannum (Sn) — латинское наименование этого гибкого, пластичного, легкоплавкого металла. Имеет № 50 в периодической таблице Менделеева.
В реакциях проявляет степени окисления +2, +4.
С водой или воздухом не реагирует. Причина этому — пленка оксида на поверхности металла.
Растворяется в разбавленных кислотах; с неметаллами реагирует при нагреве.
Физические свойства олова:
- плотность β-Sn 7,3 г/см3;
- плотность жидкого олова 6,98 г/см³;
- удельная электропроводность 8,69 МСм/м.
Металл обладает редким свойством: плавится при низкой температуре (232°С), а кипит при высокой (2620°С).
| Свойства атома | |
|---|---|
| Название, символ, номер | О́лово / Stannum (Sn), 50 |
| Атомная масса (молярная масса) | 118,710(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p2 |
| Радиус атома | 162 пм |
| Химические свойства | |
| Ковалентный радиус | 141 пм |
| Радиус иона | (+4e) 71 (+2) 93 пм |
| Электроотрицательность | 1,96 (шкала Полинга) |
| Электродный потенциал | −0,136 |
| Степени окисления | +4, +2 |
| Энергия ионизации (первый электрон) | 708,2 (7,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,31 г/см³ |
| Температура плавления | 231,91 °C[2] |
| Температура кипения | 2893 K, 2620 °C[3] |
| Уд. теплота плавления | 7,19[2]; кДж/моль |
| Уд. теплота испарения | 296[4] кДж/моль |
| Молярная теплоёмкость | 27,11[4] Дж/(K·моль) |
| Молярный объём | 16,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | тетрагональная |
| Параметры решётки | a=5,831; c=3,181 Å |
| Отношение c/a | 0,546 |
| Температура Дебая | 170,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 66,8 Вт/(м·К) |
| Номер CAS | 7440-31-5 |
Аллотропные свойства олова
Аллотропия — свойство элемента менять свою кристаллическую решетку при изменении температуры. Модификация альфа (серое олово) устойчиво при низких температурах (ниже 13 °С). Имеет кубическую решетку, по типу алмаза. Практического применения не имеет.
Бета-модификация (белое, металлическое олово), из которого делают солдатиков, им же покрывают консервные банки. Кристаллическая структура тетрагональная.

В гамма-модификацию металл переходит при температуре 161-232°С.
Печально: в музее А.В. Суворова случилось несчастье. В запаснике, где хранилась ценная коллекция оловянных солдатиков, зимой лопнули трубы отопления, и коллекция просто рассыпалась в пыль.
Маркировка металла
Промышленность выпускает металл в проволоке, чушках, прутках.
Месторождения оловянных руд
Д.И. Менделеев писал:
Олово относится к редким рассеянным металлам. В природе среди элементов занимает 47-е место по распространенности.
Мировые запасы оловянных руд расположены в:
- Китае;
- Малайзии;
- Индонезии;
- Бразилии;
- Перу;
- Австралии.
Значимые месторождения российских оловянных руд сосредоточены на Дальнем Востоке (в Приморском крае, в Якутии, в Хабаровском крае). Добыча металла большей частью происходит в подземных шахтах.
Основные руды:
-
оловянный камень, касситерит — содержит до 78% металла;

Печально: по подсчетам ученых, оловосодержащих минералов на Земле осталось лет на 30. Потом придется добывать его из лома, или искать замену…
Сплавы
По своей классификации оловянные сплавы делятся на припои, подшипниковые и легкоплавкие.
- Баббиты. В них добавляют свинец, медь, сурьма. Баббиты могут иметь легирующие присадки. Маркировки баббитов: Б88, Б83, Б83С.
- Бронза — сплав меди с оловом. Любая бронза содержит небольшие добавки фосфора, цинка, свинца, никеля и других элементов. Марки бронзы: Бр ОФ 6,5-0,15; Бр.ОЦ 4-3; Бр.ОЦ10-2; Бр.ОФ 10-1; Бр.ОНС 11-4-3.
- Пьютер. Сплав с висмутом, сурьмой, медью, изредка со свинцом.
- Припои. Бывают твердые и легкоплавкие. В сплав добавляют свинец и другие элементы. Марки припоев: ПОС-30, ПОС-40, ПОС-90.
Плюсы и минусы олова
К достоинствам относим:
Производство изделий из олова и его сплавов
Продукция из олова была востребована с давних времен. Дети играют в оловянных солдатиков уже 4000 лет.
- Электроника с ее платами сейчас повсюду, и любые контакты соединяются припоем из олова и его сплавов. Оловянное напыление для медных проводов полезно, это защита от воздействия серы (она входит в состав резиновой изоляции).
- Оловянные сплавы баббиты обладают прекрасными антифрикционными свойствами. Ни один из механизмов (от велосипеда до могучего КРАЗа) не обходится без подшипников.
- Используют металл в типографском сплаве гарте. Полиграфическое производство невозможно без оловянных сплавов.

Воздействие на организм оловянных изделий минимально. Поэтому применение металла в пищевой промышленности вполне оправдано.
Простая консервная банка и гибель полярной экспедиции
Французский повар Франсуа Аппер придумал, как долго хранить пищу. Он предложил герметично закрывать продукты в банки из белой жести (это тонкий лист из железа, покрытый оловянным напылением). Теперь мы не можем представить жизни без баночки вкусных консервов.
Стоимость олова
Главная мировая площадка инвесторов в металлы находится в Лондоне. Это LME (Лондонская биржа металлов).
Цена тонны олова на LME составляла 15590,0 US$ за тонну (данные на 28.05.2020).

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Причины многообразия органических соединений - способность атомов углерода образовывать различные цепи и циклы, соединяясь между собой. То есть явление изомерии. А в чем причина многообразия простых неорганических веществ? Оказывается, на этот вопрос можно ответить, рассмотрев, что такое аллотропия. Именно с этим природным явлением в мире химических элементов связывают существование разных форм простых соединений.
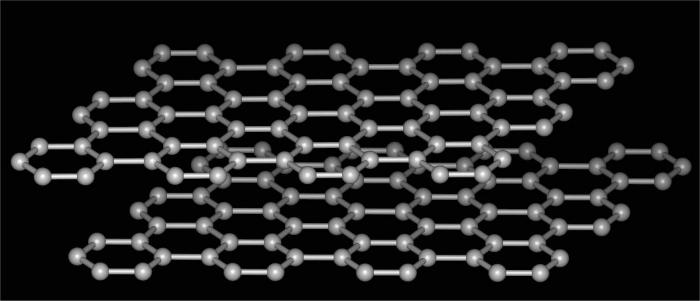
Что такое аллотропия?
Ответить на этот вопрос можно так. Это явление существования одного и того же химического элемента в виде нескольких простых веществ. То есть если ячеек в таблице Менделеева 118, то это не означает, что и в природе атомов столько же. Каждый из элементов (почти все) имеют по одной или несколько разновидностей, или аллотропных модификаций.
Чем же различаются такие вещества? Причин у рассматриваемого явления основных две:
- различное число атомов в молекуле (аллотропия состава);
- неодинаковое строение кристаллической решетки (аллотропия формы).
Часто это понятие сопряжено с термином полиморфизм. Однако между ними есть отличие. Что такое аллотропия? Это видоизменения химического элемента в разные простые вещества, независимо от того, в каком агрегатном состоянии оно находится. В то время как полиморфизм - это понятие, применимое лишь для твердых кристаллических веществ.
Различные аллотропные модификации соединений принято обозначать латинскими буквами перед их названием. Альфа всегда ставится перед той формой, которая имеет минимальную температуру плавления, кипения. Дальше по алфавиту и увеличению показателей соответственно.
Несмотря на то что химический элемент в основе простых веществ один и тот же, свойства модификаций значительно отличаются друг от друга, причем как физические, так и химические. Проще всего формируют аллотропные формы:
- неметаллы (кроме галогенов и инертных газов);
- полуметаллы.
Меньше всего изучена аллотропия металлов, так как они подобные модификации образуют неохотно и не все. Всего на сегодняшний день известно более 400 различных форм простых веществ. Чем больше степеней окисления характерно для элемента, тем выше количество известных для него аллотропных видоизменений.

Видоизменения углерода
Аллотропия углерода - это самый распространенный и яркий пример, иллюстрирующий рассматриваемое явление. Ведь именно этот элемент способен формировать несколько разновидностей соединений, различающихся строением кристаллической решетки. При этом образующиеся простые вещества настолько полярны по своим свойствам, что остается только удивляться решениям природы.
Итак, аллотропия углерода включает в себя следующие модификации.
- Что такое аллотропия углерода, можно проследить и на следующей его форме, которая кардинально отличается от предыдущей. Это графит. Очень мягкое вещество, способное легко отслаиваться и оставлять характерный след на бумаге. Поэтому его используют для изготовления грифелей простых карандашей. Структура данной формы - гексагональная слоистая. Связи между прослойками слабые, легко рвутся, плотность вещества низкая. Используется графит для получения синтетических алмазов, как твердый смазочный материал, для изготовления электродов, как наполнитель пластмасс, а также в ядерных реакторах.
- Фуллерены - еще одно доказательство того, что существует аллотропия. Химия этих соединений схожа с таковой у ароматических углеводородов. Ведь структура их представлена выпуклыми замкнутыми многогранниками, напоминающими футбольный мяч. Применяются фуллерены в технике как полупроводник, для производства сверхпроводящих соединений, как фоторезист и прочее.
- Лонсдейлит и церафит - еще две кристаллические аллотропные модификации углерода. Открыты были сравнительно недавно. По свойствам очень схожи с алмазом, при отсутствии примесей способны быть даже в несколько раз тверже.
- Уголь и сажа - аморфная аллотропия веществ. Используются в качестве топлива, смазочных материалов, в фильтрах и так далее. По содержанию в природе самые распространенные из всех модификаций углерода.

Алмаз
Самое твердое из всех известных на сегодня веществ, оценивающееся в 10 баллов по шкале Мооса. Кристаллическая форма углерода, структура которой имеет вид правильно соединенных между собой в сеть тетраэдрических образований.
Алмаз способен очень хорошо рассеивать свет, что позволяет использовать его в качестве ювелирного украшения (бриллианты). Благодаря своей чрезвычайной твердости, используется для резки и сварки, бурения, полировки и шлифования. На сегодняшний день налажено производство искусственных алмазов, используемых в промышленности.
Другие разновидности
Также существует еще несколько разновидностей данного элемента:
- нанотрубки;
- нанопены;
- астролены;
- нановолокна;
- стеклоуглерод;
- графены;
- карбин;
- нанопочки.
Неподтвержденные, но предполагаемые формы существования простых соединений углерода: чаоит, металлический углерод и диуглерод.
Аллотропия кислорода
Данный неметалл образует два простых вещества:
- газ кислород (при обычных условиях), формула которого О2;
- газообразный озон, эмпирическое отражение состава которого О3.
Очевидно, что здесь самая главная причина существования модификаций - состав молекулы. Обычный кислород - основа жизни всех живых существ (за исключением анаэробных бактерий). Он является активным участником газообмена, источником энергии для всех процессов жизнедеятельности. В химическом отношении - окислитель, при помощи которого осуществляется множество реакций.
Озон же образуется в природе или специальных лабораторных установках озонаторах из кислорода воздуха под действием сильного разряда электричества. В естественных условиях - это молния. В низких рассеянных концентрациях имеет приятный запах свежести (после грозы всегда ощущается в воздухе). Является очень сильным окислителем, отбеливателем, химически активен.

Видоизменения фосфора
Аллотропия кислорода схожа с таковой и у фосфора. Он также имеет около 11 различных модификаций, различающихся числом атомов в молекуле, а значит, химической связью и свойствами. Выделяют три устойчивые формы и остальные, в природе практически не встречающиеся и распадающиеся.
- Белый фосфор. Формула его Р4. Вещество, напоминающее мягкий парафин белого или слегка желтоватого цвета. Легко плавится, переходя в ядовитый газ.
- Красный фосфор - пастообразная масса, имеющая неприятный запах. Формула - Рn. Это полимерная структура.
- Черный фосфор - жирная на ощупь масса, которая имеет черный цвет и совершенно не растворяется в воде.
Видоизменения металлов
Что такое аллотропия металлов, можно узнать на примере железа. Оно существует в виде:
- альфа-;
- бета-;
- гамма-;
- сигма-формы.
Каждая отличается от предыдущей строением кристаллической решетки и, соответственно, свойствами. Например, альфа-форма - ферромагнетична, а бета -парамагнетик.
Вообще, из всех известных металлов аллотропные модификации образуют всего 27 химических элементов.

Аллотропия олова
Интересна тем, что альфа-форма - это серый порошок, который существует лишь при низких температурах. Бета-форма, напротив, металл, серебристо-белый, мягкий и пластичный. Существует при высоких показателях температур - до 161 о С. Одна форма легко переходит в другую в естественных условиях, если будет градусный перепад.

Смесь таких металлов, как олово и медь — бронза, известна людям еще с 4-го тысячелетия до нашей эры. А данные про чистый металл появились примерно во 2-м тысячелетии до н. э. В те времена из этого металла создавались украшения и посуда. Тем не менее вследствие низкой доступности и дороговизны, оловянные изделия не часто попадаются в числе римских и греческих предметов древности. Информация об этом металле присутствует даже в Библии.
История
Олово как металл упоминают книги Библии и энциклопедист раннего Средневековья Роджер Бэкон.
Происхождение названия
Что представляет собой
Олово – элемент периодической таблицы Менделеева.
Это легкий серебристо-белый блестящий металл. Состоит из десяти изотопов.

Оловянный куб
Олово относится к группе легких цветных металлов.
Международное обозначение – Sn (Stannum).
Мировая цена тонны сырья на Лондонской бирже металлов – $21 000.
Нахождение в природе
По распространенности на планете олово на 47-й позиции, в земной коре его массовое содержание исчисляется тысячными долями процента.
Основной минерал-носитель металла в природе – касситерит (второе название оловянный камень) – почти 80% состава.

Формы нахождения в породах и минералах – рассеянная и минеральная (оксиды, гидроксиды, силикаты, сульфиды, шпинелиды).
Месторождения есть на всех континентах, запасы исчисляются миллионами тонн.
В России регионы залежей – Хабаровский, Приморский края, Якутия, Чукотка.
Физико-химические характеристики
Металл наделен многими достоинствами: пластичен, легок, ковок, нетоксичен.
Химические свойства при обычных температурах не проявляются.
| Свойства атома | |
| Название, символ, номер | О́лово / Stannum (Sn), 50 |
| Атомная масса (молярная масса) | 118,710(7) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p2 |
| Радиус атома | 162 пм |
| Химические свойства | |
| Ковалентный радиус | 141 пм |
| Радиус иона | (+4e) 71 (+2) 93 пм |
| Электроотрицательность | 1,96 (шкала Полинга) |
| Электродный потенциал | −0,136 |
| Степени окисления | +4, +2 |
| Энергия ионизации (первый электрон) | 708,2 (7,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,31 г/см³ |
| Температура плавления | 231,91 °C |
| Температура кипения | 2893 K, 2620 °C |
| Уд. теплота плавления | 7,19; кДж/моль |
| Уд. теплота испарения | 296 кДж/моль |
| Молярная теплоёмкость | 27,11 Дж/(K·моль) |
| Молярный объём | 16,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | тетрагональная |
| Параметры решётки | a=5,831; c=3,181 Å |
| Отношение c/a | 0,546 |
| Температура Дебая | 170,00 K |
При нормальном давлении металл принимает одну из двух модификаций:
- α-Sn. Температура менее +13,2°С. Серый тусклый порошок (серое олово).
- β-Sn. Температура выше +13,2°С. Металл, белое олово.

Серое и белое олово
При температуре воздуха ниже +13,2°С β-олово переформатируется в α-модификацию. Структура решетки меняется, серебристый металл становится серым порошком.
Физические свойства.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов. Оловосодержащие сплавы обладают прекрасными антифрикционными свойствами в присутствии смазки, поэтому широко используются как материал подшипников.
Технология получения
Исходником для получения металла служит касситерит.

Кристаллы касситерита — оловянная руда
- Руду дробят до частиц не крупнее сантиметра.
- Методом флотации отделяют пустую породу. Содержание металла повышается до 42-68%.
- Серу и мышьяк удаляют кислородным обжигом концентрата.
- Полученным продуктом загружают плавильную печь, чередуя послойно концентрат с древесным углем. Получается восстановленное олово.
- Второй вариант восстановления – алюминием либо цинком.

Оловянная руда
При необходимости металл дополнительно очищают зонной плавкой либо электрохимическим рафинированием.
Коренные месторождения.
Отдельные жильные месторождения могут разрабатываться открытым способом. Но чаще проходится наклонная штольня в косогоре, наклоном которой обеспечивается непрерывное дренирование воды. В некоторых случаях необходим вертикальный шахтный ствол. Щековые дробилки и мельницы размельчают необогащенную руду до крупности песка. Методы дальнейшего концентрирования зависят от характера руды. Отделение породных хвостов и пирита обычно осуществляется методами гравитационного и флотационного обогащения. Некоторые комплексные сульфидные руды обжигают и выщелачивают в два этапа для улавливания серебра, золота, меди и свинца. После обжига может проводиться магнитное отделение олова от железа и вольфрама. За обжигом и выщелачиванием следует гравитационное обогащение отходов. Концентраты коренных месторождений беднее, чем концентраты россыпных. Так, содержание олова в типичных боливийских концентратах составляет 18–60%. Восстановление и рафинирование требуют более значительных затрат, так как процессы осложняются присутствием больших количеств других минералов.
Марки олова
Металлурги выплавляют металл нескольких марок:
| Марка | Количество примесей (%) |
| ОВЧ-000 | 0,001 |
| О1пч | 0,085 |
| О1 | 0,010 |
| О2 | 0,435 |
| О3 | 1,51 |
| О4 | 3,51 |
Первые четыре марки олова выпускаются в форме чушек, проволоки, прутков. Из О3 и О4 выплавляют чушки. Это исходник для продукции из олова.
Покрытия из олова и его сплавов.
Олово легко образует сплавы со многими металлами. Оловянные покрытия имеют хорошее сцепление с основой, обеспечивают хорошую коррозионную защиту и красивый внешний вид. Оловянные и оловянно-свинцовые покрытия можно наносить, погружая специально приготовленный предмет в ванну с расплавом, однако большинство оловянных покрытий и сплавов олова со свинцом, медью, никелем, цинком и кобальтом осаждают электролитически из водных растворов. Наличие большого диапазона составов для покрытий из олова и его сплавов позволяет решать многообразные задачи промышленного и декоративного характера.
Где используется
Металл востребован как самостоятельный материал, в сплавах, соединениях.
Его химические и физические свойства позволяют изготавливать безопасные, стойкие к ржавению изделия и покрытия.

Оловянный солдатик в форме после литья
Металл
Чистый металл востребован как:
- Тара пищевых продуктов.
- Упаковочная фольга.
- Анод в химических источниках тока.

Оловянный кубок из г. Гданьска (Польша)
Олово – самый экологически чистый из легких цветных металлов.
Соединения
Соединения металла нашли применение в разных сегментах хозяйственного комплекса:
Изомеры искусственного происхождения используют в медицине как источник гамма-излучения.
Перспективы
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1—2)· 10−4 % олова, а его ежедневное поступление с пищей составляет 0,2—3,5 мг. Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Станнан (оловянистый водород) — сильнейший яд. Также очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух рабочей зоны в объёмах, превышающих предельно допустимую концентрацию в соответствии с ГОСТ. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Сплавы
Металлургией олово используется как компонент сплавов. По сфере применения различают подшипниковые, легкоплавкие составы и припои.

Расплавленное олово
Выработана классификация сплавов по видам:
Баббиты
Сплав на основе олова либо свинца. Применяется как слой, созданный напылением либо заливкой.
Бронза
Медно-оловянный сплав с доминированием меди. Плюсы: твердость, легкоплавкость, устойчивость к обработке, ржавчине, механическим повреждениям, атмосферным катаклизмам.
Используется как литейный металл, в химической промышленности, автопроме, внешнем декоре зданий.
Припои
Бывают легко- и твердоплавкими. Главный компонент сплава – олово.
Существует несколько марок, в зависимости от соотношения элементов. Сплавы применяются для пайки всего: от посуды, медицинской аппаратуры, радиодеталей, радиаторов отопления до электронного оборудования.
Пьютеры
Сплав с медью, сурьмой, висмутом. Декоративный, эстетичный вариант. Из него делают посуду, мелкие предметы, украшающие жизнь. Но применение ограничивает токсичность.
В некоторых странах использование сплава запрещено. Такие изделия можно найти только у антикваров.
Выплавка.
Для восстановления касситерит плавят с углеродсодержащими материалами в отражательных или особого типа шахтных печах. Шахтные оловоплавильные печи применяются с давних времен; в них с использованием дутья сжигается служащий восстановителем древесный уголь, который загружается слоями, чередующимися со слоями касситерита. В более распространенных отражательных печах в качестве топлива используется каменный уголь; они действуют аналогично мартеновским сталеплавильным печам, причем руда смешивается с антрацитом и известняком. Печи обоих типов дают шлаки, богатые оловом (до 25%). Шлаки подвергают доработке переплавкой при значительно более высокой температуре с добавлением новых количеств восстановителя. В результате получается черновое олово с высоким содержанием железа – так называемая железистая печная настыль. Процесс требует строгого контроля, иначе и вторичные шлаки будут содержать слишком большой процент олова.
Значение для человека
Микроэлемент – участник метаболизма, содействует росту скелетных тканей.
Рацион
Оловом богаты продукты нескольких групп:
- Мясо – курятина, индюшатина, говядина, свинина.
- Молочные продукты, включая сыры твердых сортов.
- Бобовые.
- Овощи – картофель, свекла.
- Семечки подсолнечника.
Ежесуточно человеку необходимо 3-11 мг вещества. Их он получает из пищи. Избыток утилизируется естественным путем, поэтому отравление исключено.
Симптомы нехватки
Нехватка микроэлемента нарушает минеральный баланс организма.
Результатом становятся следующие симптомы:
- Немотивированное истощение.
- Торможение роста.
- Ухудшение слуха.
- Тусклость, ломкость, выпадение волос.
Дефицит элемента – явление редкое. Так же, как переизбыток.
Переизбыток
Случается у людей, контактирующих с веществом (добыча на рудниках, работа на металлургическом предприятии) или фанатов консервированных продуктов.

Консервная банка с оловянным покрытием
Целостность оболочки консервных банок при длительном хранении нарушается. Часть олова переходит в содержимое.
Читайте также:

