Сообщение аллотропные модификации углерода карбин графен фуллерен нанотрубки
Обновлено: 03.05.2024
Основные понятия и положения нанотехнологии
Нанотехнология — междисциплинарная технологическая область (электроника, оптика, машиностроение, энергетика, биофизика и др.), оперирующая процессами сборки на атомарном и кластерном** уровнях, которые позволяют придать неорганическому или органическому материалу принципиально новые физико-механические, химические и эксплуатационные свойства.
Нано — 10~9 — миллиардная доля; 1 нм = 10-9 м. **
Кластер (англ. cluster — скопление) — объединение нескольких однородных элементов, которое может рассматриваться как самостоятельная единица, обладающая определенными свойствами.
Лауреат Нобелевской премии академик Ж. И. Алферов показал, что нанотехнология держится на трех китах: зондовой атомарной сборке с использованием сканирующего туннельного микроскопа (SPM) и оптического пинцета; росте сверхтонких пленок и самосборке гетероструктур на поверхности кристаллов (гетероструктура — комбинация нескольких контактов между разными по химическому составу веществами).
Графен, углеродные нанотрубки и фуллерены
Наноструктуры собирают не только из отдельных атомов, но и из молекулярных блоков. Наиболее перспективным химическим элементом для такой сборки является графит, из которого получают графен, углеродные нанотрубки и фуллерены.
Графен (от англ. graphene) — это одиночный плоский лист, состоящий из атомов углерода, связанных между собой и образующих решетку правильного шестигранника. Расстояние между ближайшими атомами углерода в графене составляет около 0,14 нм.
Графит представляет собой стопу листов графена. Графены в графите очень плохо связаны между собой и могут скользить друг относительно друга. Существуют три способа получения графена.
Механический способ основан на механическом отщеплении или отшелушивании слоев графита. Он позволяет получать наиболее качественные образцы с высокой подвижностью носителей. Этот способ наиболее трудоемкий. Термический способ основан на термическом разложении подложки карбида кремния.
Химический способ основан на использовании раствора аммиака в дистиллированной воде (для образования слабощелочной среды). Повышение pH раствора приводит к увеличению электростатического заряда на поверхности углеродных чешуек — графенов. Они начинают отталкиваться и больше не слипаются.
Высокая подвижность носителей тока при комнатной температуре делает графен перспективным материалом для использования в самых различных приложениях, в частности как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.
Углеродные нанотрубки. Одно из перспективных направлений в нанотехнологиях — использование углеродных нанотрубок.
Углеродные нанотрубки — это каркасные структуры или гигантские молекулы, состоящие только из атомов углерода.
Углеродную нанотрубку можно представить, если мысленно свернуть в трубку графен. Нанотрубки образуются самостоятельно, например, на поверхности угольных электродов при дуговом разряде между ними. При разряде атомы углерода испаряются с поверхности и, соединяясь между собой, образуют однослойные и многослойные нанотрубки. Диаметр однослойных нанотрубок, как правило, около 1 нм, а их длина около 40 мкм. Они нарастают на катоде, перпендикулярно плоской поверхности его торца. Происходит так называемая самосборка углеродных нанотрубок из атомов углерода.
В зависимости от угла закручивания и строения нанотрубки могут обладать высокой, как у металлов, проводимостью, а могут иметь свойства полупроводников. Поэтому углеродные нанотрубки — перспективный материал для изготовления электрических проводов, интегральных микросхем (наносхем) и для соединения логических элементов внутри микроэлектронных устройств (сопротивление однослойной нанотрубки не зависит от ее длины). Потенциальный диапазон применения распространяется от электронных дисплеев и сенсоров до наноэлектронных устройств и батарей.
Атомы углерода, испарившиеся с разогретой поверхности графита, соединяясь друг с другом, могут образовывать не только нанотрубки, но и другие молекулы — выпуклые замкнутые многогранники в виде сферы или эллипсоида. В этих молекулах атомы углерода расположены в вершинах правильных шести- и пятиугольников, из которых составлена поверхность сферы или эллипсоида. Все эти молекулярные соединения атомов углерода названы фуллеренами по имени американского инженера, дизайнера и архитектора Р. Бакминстера Фуллера, применявшего для постройки куполов своих зданий пяти- и шестиугольники.
Молекулы самого симметричного и наиболее изученного фуллерена, состоящего из 60 атомов углерода (С60), образуют многогранник, состоящий из 20 шестиугольников и 12 пятиугольников и напоминающий футбольный мяч.
Изображение фуллерена Сбо многие считают символом нанотехнологий. Главной особенностью фуллеренов является их повышенная реакционная активность. Они легко захватывают атомы других веществ и образуют материалы с принципиально новыми свойствами. На их основе возникла новая стереохимия углеродов, позволяющая целенаправленно создавать новые органические молекулы и, следовательно, вещества с заданными формами и свойствами.
Фуллерен — структуры, содержащие щелочные металлы К3С6о; Rb3C60; Cs3C6o (фуллериды), обладают сверхпроводимостью. Температура фазового перехода зависит от постоянной решетки фуллерида. Температура сверхпроводящего перехода для системы Rb — Т1 — Сбо превышает 40 К, для системы Си — С60 превышает температуру кипения азота.
Таким образом, фуллериды при простом составе являются одними из самых высокотемпературных сверхпроводников. Фуллерены могут применяться при производстве новых классов:
• сверхпроводников, полупроводников, магнетиков, сегнетоэлектриков, нелинейных оптических материалов;
• полимеров с заданными механическими, оптическими, электрическими, магнитными свойствами для записи и хранения ин формации;
• антифрикционных покрытий и смазок, в том числе на основе фторсодержащих соединений фуллеренов;
• соединений для фармакологии и медицины, в том числе противовирусные и нейротропные препараты, сорбенты для гемо сорбции; а так же при создании:
• новых технологий синтеза алмазов и алмазоподобных соединений сверхвысокой твердости (уже получены алмазоподобные структуры твердостью 150 ООО МПа, тогда как твердость алмаза не превышает 100 ООО МПа);
• новых типов катализаторов и сенсоров для определения состава жидких и газовых сред;
• новых видов топлив и добавок к топливам;
• капсул для безопасного захоронения радиоактивных отходов.
Атом углерода, будучи элементом четвертой группы главной подгруппы Периодической Системы, имеет в своем обычном состоянии два неспаренных валентных р-электрона на внешнем электронном уровне: 1s22s22p2. При переходе в возбужденное состояние один.
Структурные особенности графена
Итак, графен - это плоская однослойная структура, которая является основой как трехмерного графита, так и двумерных фуллеренов и нанотрубок. Графен оказался устойчив при комнатной температуре. Находясь на ровной подложке, он механически стабилен.
Получение графена
Высокий интерес к применению графена заставляет исследователей искать новые методы его получения. Изготовление графена микромеханическим методом оказалось довольно трудоемким, поэтому большую популярность в последнее время приобретает альтернативный.
Фуллерены
Фуллерены - полициклические полые структуры сферической формы, состоящие из атомов углерода, связанных в шести- и пятичленные циклы. Это новая модификация углерода, для которой, в отличие от других известных модификаций (алмаза, графита, карбина.
Строение фуллеренов
Молекулы фуллеренов могут содержать от 20 до 540 углеродных атомов, расположенных на сферической поверхности. Наиболее устойчивое и лучше изученное из этих соединений - C60-фуллерен (60 атомов углерода) состоит из 20 шестичленных и 12 пятичленных.
Получение фуллеренов
Лазерные испарения графита в потоке гелия Термическое испарение графита Дуговой контактный разряд. путём сжигания графитовых электродов в электрической дуге в атмосфере гелия при низких давлениях. Этот метод Кретчмера и Хаффмана долгое время.
Углеродные нанотрубки
Углеродные нанотрубки - полые цилиндрические структуры, образованные сворачиванием графена в цилиндр с соединением его сторон без шва. Считается, что первооткрывателем углеродных нанотрубок является сотрудник японской корпорации NEC Сумио Ииджима.
Получение нанотрубок
Термическое распыление графитового электрода в плазме дугового разряда Термическое распыление графита в присутствии катализатора Лазерное распыление графита Электролитический синтез Каталитический крекинг ацетилена Применение нанотрубок Капиллярные.
Заключение
Литература
Самсонов, Г.В. Силициды и их использование в технике / Г.В. Самсонов. - Киев, АН УССР, 1959.- 204 с. Воронков, М.Г. Удивительные элементы жизни / М.Г. Воронков, И.Г. Кузнецов - Иркутск, 1983.- 107 с. Воронков, М.Г. Биохимия, фармакология и.
Важная область практического применения новейших открытий в области физики, химии и даже астрономии — создание и исследование новых материалов с необычными, подчас уникальными свойствами. О том, в каких направлениях ведутся эти работы и чего уже сумели добиться ученые, мы расскажем в серии статей, созданных в партнерстве с Уральским федеральным университетом. Первый наш текст посвящен необычным материалам, которые можно получить из самого обычного вещества — углерода.
Наша статья посвящена многообразным обличьям этого элемента: оказывается, только из его атомов можно построить десятки различных материалов — от графита до алмаза, от карбина до фуллеренов и нанотрубок. Хотя все они состоят из абсолютно одинаковых атомов углерода, их свойства радикально отличаются — а главную роль в этом играет расположение атомов в материале.
Графит
Чаще всего в природе чистый углерод можно встретить в форме графита — мягкого черного материала, легко расслаивающегося и словно скользкого на ощупь. Многие могут вспомнить, что из графита делаются грифели карандашей — но это не всегда верно. Часто грифель делают из композита графитовой крошки и клея, но встречаются и полностью графитовые карандаши. Интересно, но на карандаши уходит больше одной двадцатой всей мировой добычи естественного графита.
Чем необычен графит? В первую очередь, он хорошо проводит электрический ток — хотя сам углерод и не похож на другие металлы. Если взять пластинку графита, то окажется, что вдоль ее плоскости проводимость примерно в сто раз больше, чем в поперечном направлении. Это напрямую связано с тем, как организованы атомы углерода в материале.
Отдельные слои соединяются между собой благодаря ван-дер-ваальсовым силам — они гораздо слабее, чем обычная химическая связь, но достаточны для того, чтобы кристалл графита не расслаивался самопроизвольно. Такое несоответствие приводит к тому, что электронам гораздо сложнее перемещаться перпендикулярно плоскостям — электрическое сопротивление возрастает в 100 раз.
Благодаря своей электропроводности, а также возможности встраивать атомы других элементов между слоями, графит применяется в качестве анодов литий-ионных аккумуляторов и других источников тока. Электроды из графита необходимы для производства металлического алюминия — и даже в троллейбусах используются графитовые скользящие контакты токосъемников.
Кроме того, графит — диамагнетик, причем обладающий одной из самых высоких восприимчивостей на единицу массы. Это означает, что если поместить кусочек графита в магнитное поле, то он всячески будет пытаться вытолкнуть это поле из себя — вплоть до того, что графит может левитировать над достаточно сильным магнитом.
И последнее важное свойство графита — невероятная тугоплавкость. Самым тугоплавким веществом на сегодняшний день считается один из карбидов гафния с температурой плавления около 4000 градусов Цельсия. Однако если попытаться расплавить графит, то при давлениях около ста атмосфер он сохранит твердость вплоть до 4800 градусов Цельсия (при атмосферном давлении графит сублимирует — испаряется, минуя жидкую фазу). Благодаря этому материалы на основе графита используют, например, в корпусах ракетных сопел.
Алмаз
Многие материалы под давлением начинают менять свою атомарную структуру — происходит фазовый переход. Графит в этом смысле ничем не отличается от других материалов. При давлениях в сто тысяч атмосфер и температуре в 1–2 тысячи градусов Цельсия слои углерода начинают сближаться между собой, между ними возникают химические связи, а когда-то гладкие плоскости становятся гофрированными. Образуется алмаз, одна из самых красивых форм углерода.
Свойства алмаза радикально отличаются от свойств графита — это твердый прозрачный материал. Его чрезвычайно сложно поцарапать (обладатель 10-ки по шкале твердости Мооса, это максимум твердости). При этом электропроводность алмаза и графита отличается в квинтиллион раз (это число с 18 нулями).

Известно ли вам, что один и тот же химический элемент может образовать несколько веществ? Причем свойства этих веществ будут абсолютно разными. Из нашей статьи вы узнаете, сколько аллотропных модификаций имеет углерод, в чем их отличие и какова область применения.
Понятие аллотропии
Как это возможно? Существует два вида аллотропии: состава и формы. В первом случае она обусловлена разным количественным составом молекул простого вещества. К примеру, при соединении двух атомов оксигена образуется кислород, трех — озон.
При аллотропии формы молекула образована одинаковым количеством атомов. Отличается способ их расположения в кристаллической решетке. Так, в состав молекулы серы входит восемь атомов. Если они образуют замкнутую кольцевую структуру, получается самая устойчивая модификация — ромбическая сера. Когда циклическая структура приобретает форму короны, формируется моноклинная сера. А в случае образования полимерных цепочек — пластическая.
Физические свойства аллотропных модификаций углерода, как и других элементов, имеют характерные отличия. К примеру, белый фосфор визуально напоминает воск, а черный — графит. Кислород — это бесцветный прозрачный газ, а озон — голубого цвета с резким запахом. Существенные отличия имеют аллотропные модификации углерода — алмаз и графит.
Свойство аллотропии характерно только для элементов, которые имеют переменное значение степени окисления и способны образовывать цепочки из атомов — гомоцепные структуры.

Сколько аллотропных модификаций имеет углерод
В нашей статье речь пойдет о химическом элементе, который образует наибольшее количество аллотропных форм. На данный момент их известно более десяти. Углерод — активный элемент. Разные модификации он может образовывать благодаря наличию четырех свободных связей. Молекулярная формула аллотропных модификаций углерода будет абсолютно одинакова для всех форм — С. А вот структура кристаллической решетки отличается.
По характеру химической связи различают несколько форм углерода. Примерами тетраэдрической являются алмаз и его гексагональный аналог — лонсдейлит. В кристаллических решетках этих веществ центральный углерод в узлах связан с другими атомами.
Наиболее многочисленными являются тригональные формы. В этом случае углерод образует шестиугольники, слои которых связаны между собой. Примерами таких модификаций являются графит, фуллерены, нанотрубки, стеклоуглерод, графены и другие вещества. В случае образования цепочек углерода формируется линейная аллотропная форма. Ее примером является карбин.
Алмаз
Начнем характеристику аллотропных модификаций углерода с самого твердого вещества по шкале Мооса. Алмаз получил в ней самую высокую оценку — 10 баллов. Это вещество режет стекло. Близок по твердости к алмазу только искусственно созданный материал эльбор. В естественных условия вещества с подобными свойствами не найдено. Оценку девять баллов по данной шкале по праву заслужил корунд, который царапает стекло. А заслуженную восьмерку получает топаз, легко поддающийся обработке алмазом.
Кроме твердости, к характеристикам алмаза можно отнести самые высокие показатели теплопроводности, износостойкости на стирание и модуля упругости. Такие уникальные свойства объясняются особой структурой кристаллической решетки. Каждый атом углерода в ней связан с четырьмя другими при помощи ковалентных связей. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Если алмаз без доступа воздуха нагреть до 1000 градусов, то он постепенно превратится в графит. Существует и обратный процесс. Из графита можно получить искусственные алмазы, если разогреть его до температуры свыше 1200 градусов под высоким давлением в присутствии катализатора.
Еще одним уникальным свойством алмазов является их способность к люминесценции. При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. Причем необработанный алмаз не обладает такими качествами. Способность к многократному отражению ему придает огранка, после которой алмаз называют бриллиантом.

Лонсдейлит
Согласитесь, из всех названий аллотропных модификаций углерода это является самым причудливым. Лонсдейлит получил название в честь британского кристаллографа Кэтлин Лонсдей. Его еще называют гексагональным алмазом. Первый удачный синтез данной модификации из графита был произведен еще в 1966 году. В то же время лонсдейлит обнаружили в кратерах метеоритов. Позже ученые сумели получить это вещество из традиционного кубического алмаза.
Элементарная ячейка лонсдейлита состоит из четырех атомов углерода с двухслойной упаковкой. В то время как у обычного алмаза их восемь, а упаковка — трехслойного типа.
Лонсдейлит — коричнево-желтый прозрачный металлоид с алмазным блеском. Его твердость максимально достигает 8 единиц по Моосу. Кристаллы лонсдейлита видны только под микроскопом. Широкого практического применения это вещество пока не получило ввиду трудоемкости его получения.
Графит
Мы редко задумываемся, из какого вещества состоит стержень простого карандаша. А ведь это графит — одна из важнейших аллотропных модификаций углерода. Максимальный показатель твердости этого вещества — 2 балла. Цвет — серый, блеск — металловидный, структура — слоистая. На поверхности оставляет черные черты. К физическим характеристикам также относят хорошую электро- и теплопроводность, стойкость при нагревании в вакууме. На ощупь графит жирный и скользкий.
Как из одного вещества возможно образование настолько разных веществ? Дело в том, что в графите атомы углерода располагаются слоями. Связи в них очень прочные. А вот расстояние между слоями гораздо больше. Соответственно, и связи между ними слабые. Каждый раз проводя грифелем простого карандаша по бумаг, мы оставляет на ней графитовый слой. А вот разрушить такой стержень вдоль оси будет очень сложно.

Графены
Эта аллотропная модификация углерода представляет собой монослой графита. Толщина такого слоя — один атом. Основой получения графита является ручное механическое отщепление в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при нагревании кремниевых пластин. Их верхний слой состоит из карбида кремния. При действии высоких температур атомы углерода отщепляются и остаются на пластинке в виде графена. А кремний испаряется. Впервые это вещество было получено в 2004 году. Физик Константин Новоселов со своим учеником Андреем Геймом были удостоены за это открытие Нобелевской премии.
Графен — тонкое и прочное вещество с высокими показателями электропроводности. В настоящее время он широко используется в микроэлектронике и автомобилестроении.

Нановолокна
Такая структура и состав обеспечивает нановолокнам исключительные свойства при низкой цене. Это высокие тепло- и электропроводность, механическая прочность, устойчивость к деформации. Нановолокна служат армирующими элементами в композитных материалах и наполнителями резин.

Стеклоуглерод
Это вещество в конце 20 века в Манчестере получил нидерландский химик Бернард Редферн. Стеклоуглерод — это аллотропная модификация углерода, сочетающая электропроводность графита и твердость стекла. В условиях вакуума он не разрушается даже при температуре в несколько тысяч градусов. А вот на воздухе плавится уже при 500 °С. Еще одна характерная черта — устойчивость к коррозии при действии щелочей и кислот. Применяют стеклоуглерод для изготовления электродов и тиглей.

Карбин
Данная модификация является примером линейной формы аллотропии. Карбин состоит из углеродных цепочек с одинарными, двойными или тройными связями между атомами. Такие линейные структуры могут превращаться в циклические.
По физическим свойствам карбин — черный порошок, состоящий из мелких кристаллов. Он является полупроводником. Причем это свойство усиливается под воздействием света, что обусловливает использование карбина в фотоэлементах.
Еще одно удивительное качество этого вещества — совместимость с тканями человеческого организма. Поэтому карбин применяют еще и в медицине для изготовления искусственных кровеносных сосудов.

Итак, углерод — это вещество, которое образует несколько простых веществ — аллотропных модификаций. Они обусловлены различным расположением атомов в кристаллической решетке. Аллотропные формы углерода обладают широким спектром физических свойств, многие из них имеют практическое значение и широко используются в разных отраслях человеческой деятельности.

Соединения, образованные атомами углерода, но отличающиеся строением и свойствами, называются аллотропными модификациями углерода. Основными модификациями углерода являются графит, алмаз, карбин.
Классификация
Возможность присоединять четыре атома делает углерод активным элементом. Помимо присоединения атомов других элементов углерод может образовывать различные модификации, отличающиеся структурой и свойствами.
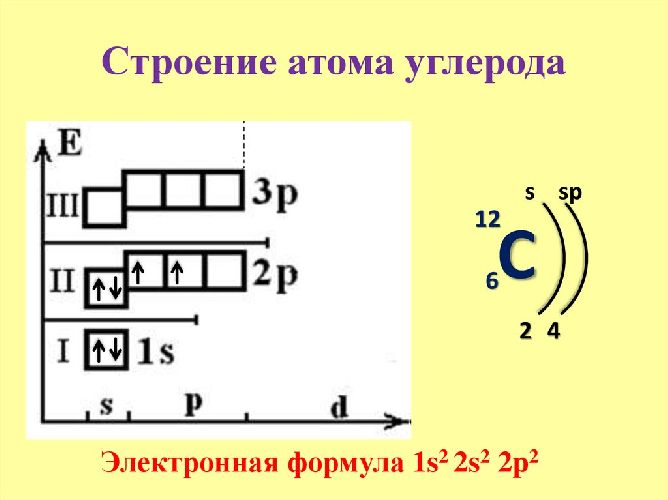
Рис. 1. Строение атома углерода.
Выделяют два вида углерода в зависимости от образования модификаций:
- кристаллический – входит в состав твёрдых веществ;
- аморфный – образует мягкие вещества.
Кристаллические формы углерода:
- алмаз;
- лонсдейлит;
- наноалмаз;
- графит;
- графен;
- карбин;
- фуллерены;
- фуллерит;
- углеродное волокно;
- углеродные нановолокна;
- углеродные нанотрубки.
В соответствии с геометрическим строением кристаллической решётки выделяют три типа аллотропных модификаций:
- тетраэдрическая (sp 3 -гибридизация) – один атом углерода, находящийся в центре, связан с атомами в узлах тетраэдра;
- тригональная (sp 2 -гибридизация) – атомы углерода образуют шестиугольники, связанные друг с другом послойно;
- линейная (sp-гибридизация) – атомы углерода образуют цепочки, связанные одинарными, двойными, тройными связями.
Аморфный углерод образует следующие модификации:
- активированный уголь;
- древесный уголь;
- ископаемый уголь;
- кокс каменноугольный;
- стеклоуглерод;
- углеродная нанопена;
- техуглерод;
- сажа.
Лонсдейлит является гексагональной модификацией алмаза. Наноалмазы, фуллерены, нанотрубки, нанографиты объединены в семейство наноуглеродных кластеров. Они образованы вложенными друг в друга углеродными сферами.
Основные модификации
Наиболее изучены твёрдые формы углерода – алмаз, графит и карбин. Особенности строения и свойства аллотропных модификаций углерода представлены в таблице.
Модификация
Строение решётки
Свойства
Применение
Относительно мягкий жирный минерал, обладающий электропроводностью. Имеет серый цвет, металлический блеск. Плотность – 2,23 г/см 3 . Не плавится. Реагирует со щелочными металлами, солями, кислородом
Смазка в прокатном производстве. За счёт отслоения тригональной решётки используется в качестве стержня карандаша
Мелкокристаллический порошок с небольшой плотностью. Полупроводник
Используется в фотоэлементах
Прозрачный минерал, обладающий наибольшей твёрдостью. Обладает теплопроводностью, является полупроводником. Имеет большой показатель преломления. Плавится при температуре 3700°C
Драгоценный камень, абразив. Из алмаза изготавливают свёрла, ножи, резцы

Рис. 3. Графит, карбин и алмаз.
При сильном нагревании графит переходит в алмаз, а алмаз – в графит.
Что мы узнали?
Углерод имеет множество аллотропных модификаций. Основные из них – графит, алмаз, карбин. Они отличаются друг от друга физическими, химическими свойствами, строением кристаллической решётки. Наиболее твёрдая модификация – алмаз – используется для изготовления промышленных инструментов. Графит – мягкий минерал – применяется в прокатной промышленности. Благодаря строению способен отслаиваться, оставляя след, поэтому используется в качестве карандашного стержня. Карбин – порошок, который используется в фотоэлементах.
Читайте также:

