Реакция тримеризации ацетилена в бензол была открыта выдающимся русским химиком сообщение
Обновлено: 17.05.2024
Опубликован механизм знаменитой реакции Зелинского. Получение бензола из ацетилена с помощью автокаталитического каскада на углеродных наночастицах
Российские исследователи показали, что карбеновые центры на зигзагообразных краях графеновых структур могут представлять собой альтернативную платформу для создания эффективных каталитических систем. В частности впервые был представлен механизм реакции Зелинского: тримеризации ацетилена с образованием такого важного продукта как бензол. В большинстве промышленных химических процессов применяются катализаторы на основе переходных металлов. Высокие цены на драгоценные металлы и неизбежное вымывание токсичных металлов, приводящее к загрязнению окружающей среды, делают каталитические системы без переходных металлов особенно важными. (doi: 10.1021/jacs.9b10887).
В 1924 году великий русский химик Николай Зелинский показал, что бензол может быть легко синтезирован с хорошим выходом при пропускании ацетилена над обычным древесным углём. До этого поиск катализаторов тримеризации ацетилена в бензол проводился в основном среди металлов и сплавов. Метод, предложенный Зелинским, был одним из первых примеров, когда традиционно используемые металлические катализаторы заменили углеродом для ускорения реакции. В рамках современных концепций данный подход может быть отнесен к такой передовой и практически важной области как карбокатализ. Последние годы карбокаталитические системы привлекают внимание исследователей по всему миру как перспективный путь к более простой, доступной и экологичной химии. Не смотря на это, механизмы карбокаталитических реакций остаются одними из наиболее загадочных явлений в химии.
Несмотря на кажущуюся простоту реакции Зелинского, как и для многих других карбокаталитических процессов, точный каталитический путь для сборки бензола из трех молекул ацетилена оставался неизвестным, загадочным и непонятным. Как ожидается, такие химические превращения будут иметь высокий уровень сложности, связанный с участием метастабильных активных центров на поверхности углерода.
Группа российских исследователей из Института органической химии им. Н.Д. Зелинского сообщила о создании модели карбокаталитического цикла тримеризации ацетилена в бензол. Таким образом, впервые был описан химический механизм реакции Зелинского. Ключом к пониманию загадки реакции Зелинского оказались карбеновые активные центры, локализованные на атомах углерода у зигзагообразного края графена. Такие активные центры могут присутствовать во многих углеродных материалах на основе графеновых листов, и они представляют собой идеальную платформу для эффективного каталитического формирования углерод-углеродных связей при синтезе бензола.
Квантово-химические расчеты механизма реакции позволили реконструировать профили свободных энергий и изменения пространственного распределения спиновой плотности для каждой стадии реакции циклотримеризации ацетилена. Было обнаружено, что поэтапному присоединению молекул ацетилена к каталитически активному центру способствует постоянная миграция спиновой плотности на β-атом углерода присоединяемой частицы C2. Кроме того, обратимые колебания спиновой плотности облегчают образование продукта и восстанавливают каталитически активные центры. В то же время движущая сила свободной энергии обеспечивает доминирование циклотримеризации над линейной олигомеризацией после добавления трех частиц ацетилена.
Помимо своей фундаментальной важности, карбокаталитические реакции привлекают большое внимание по причине необходимости обеспечения экологических требований и соответствия требованиям концепции устойчивого развития. Ключевым моментом в этом отношении является отказ от использования катализаторов на основе переходных и, особенно, благородных металлов. Их высокая стоимость наряду с неизбежным вымыванием токсичных металлосодержащих частиц являются их известными недостатки. В отличие от металлических катализаторов углеродные аналоги дешёвые и нетоксичные. Кроме того, реакция тримеризации ацетилена является эффективным атомно-экономическим подходом для получения ароматического кольца - исключительно важной трансформации в органическом синтезе и промышленности.
Открытый механизм процесса выходит за рамки изучения конкретной реакции. Опубликованная работа открывает новые возможности использования π-электронно-сопряженных 2D-систем, таких как графен, в каталитических и синтетических приложениях. Очень важно, чтобы разработка новых карбокатализаторов сопровождалась пониманием механизмов их работы. Поэтому в ближайшем будущем без сомнения появится множество новых исследований в данной области.
Ссылка: J. Am. Chem. Soc. 2020, 142, 8, 3784-3796
DOI: 10.1021/jacs.9b10887

Рисунок 1. Реакция тримерицазии ацетилена в бензол в присутствии древесного угля, исследованная Н.Д. Зелинским.
Реакция Зелинского — каталитическая тримеризация ацетилена с образованием бензола при нагревании.
В 1866 г. французский химик М. Бертло, пропуская ацетилен через раскаленные трубки (550-600 0 С), получил с небольшим выходом бензол.
Позднее, в 1927 г. Н.Д. Зелинский и Б.А. Казанский, показали, что эта реакция идет очень хорошо при пропускании ацетилена через нагретый до 600-650 0 С активированный уголь.
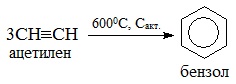
В 1948 году немецкий химик В. Реппе нашёл гораздо более эффективный катализатор – комплексное соединение никеля. Он позволяет проводить реакцию в бензоловом растворе при 60 0 –70 0 , но требует повышенного давления. Выход бензола достигает 88%. В качестве побочного продукта образуется стирол (винилбензол).
Получение бензола тримеризацией ацетилена при 600 0 С — это реакция Зелинского, или Бертло — Зелинского.
Не нужно путать реакцию Бертло — Зелинского с реакцией Зелинского – Казанского. В обоих случаях получают бензол, только в первом — из ацетилена, а во втором — из циклогексана.

Рубрики: ИМЕННЫЕ РЕАКЦИИ
РЕАКЦИЯ ЗЕЛИНСКОГО (необратимый катализ, катализ Зелинского)
Каталитическое диспропорционирование циклогексадиена и циклогексена (1911):
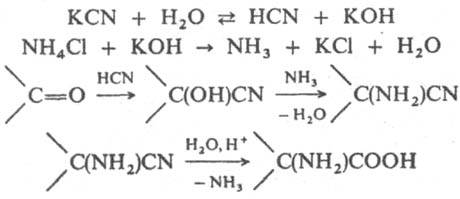
Реакция Зел и нского — Ст а дникова - метод синтеза α-аминокислот из альдегидов и кетонов. Например,
где R и R' = H, алифатический, алициклический или ароматический радикал. Реакцию проводят в водных средах при 0—20°С в течение нескольких часов. С выходами 60—90% образуются α-аминонитрилы (I), гидролизуемые далее в α-аминокислоты (II). Зелинского — Стадникова реакция — усовершенствованный метод циангидринного синтеза α-аминокислот, разработанного немецким химиком А. Штреккером (1850). Реакция открыта Н. Д. Зелинским и Г. Стадниковым в 1906.
Не исключено, что вместо первых двух стадий происходит взаимодействие KCN и NH4Cl с образованием неустойчивого NH4CN, которыйрый разлагается на HCN и NH3. Реакция Зелинского - Стадникова представляет собой развитие циангидринного способа синтеза аминокислот , в котором в качестве исходных продуктов используют карбонильные соединения, HCN и NH3 (см. Штреккера реакции ). Реакция открыта Н. Д. Зелинским и Г. Л. Стадниковым в 1906.
Реакция Зелинского–Казанского (метод Зелинского–Казанского)
Тримеризация ацетилена (полимеризация ацетилена) на активированном угле при нагревании (1924):

Ацетилен (C2H2) — газообразный (при нормальных условиях) углеводород, в котором два атома углерода связаны тройной связью. Ацетилен очень легко вступает в реакции и широко используется в органическом химическом синтезе как исходное соединение для получения многих веществ. А в начале XX века (до того, как химики освоили крекинг нефти и научились получать всё из нее) значение ацетилена было еще больше, поскольку это было одно из немногих органических веществ, которые можно было получать из неорганических: ацетилен умели синтезировать из карбида кальция и воды при помощи реакции Вёлера. Поэтому превращение ацетилена в различные вещества активно изучалось учеными по всему миру.
В частности, в 1924 году российский химик Николай Дмитриевич Зелинский вместе со своим коллегой Борисом Александровичем Казанским показал, что ацетилен можно превратить в другой углеводород бензол (C6H6). Бензол — жидкий циклический углеводород (все атомы углерода в его молекуле соединены в один шестичленный цикл). Это одно из важнейших веществ в органической химии, оно до сих пор используется как исходное соединение для многих промышленно важных реакций. Чтобы получить бензол, Зелинский нагревал ацетилен до температуры 600 градусов Цельсия над раскаленным активированным углем — пористым углеродным материалом, который был впервые получен в его лаборатории в 1915 году. Зелинский ожидал, что благодаря большой площади поверхности активированный уголь будет хорошо адсорбировать ацетилен и таким образом препятствовать детонации при нагревании. При этом на поверхности активированного угля молекулы ацетилена будут соединяться по три штуки (тримеризоваться), превращаясь в молекулы бензола. А вот активированный уголь ни во что превращаться не будет, в данной реакции он является катализатором — веществом, которое ускоряет протекание реакции, но не расходуется в ней.
Эксперименты Зелинского показали, что с помощью такого процесса можно превратить около 35% ацетилена в бензол, а еще часть ацетилена разлагается с образованием твердых продуктов, которые оседают на поверхность катализатора. Однако точный механизм этой реакции (и, в частности, роль в нем угольного катализатора) Зелинский в своих работах не описал, и с тех пор его так и не удавалось полностью изучить. В 1948 году немецкий химик Реппе предложил более выгодный способ превращать ацетилен в бензол (использование катализаторов из соединений никеля при 60°C), а в наши дни бензол в основном получают крекингом нефти. Реакция Зелинского утратила свое прикладное значение, но ее механизм продолжал интересовать ученых — как занимательная химическая загадка. Время от времени выходили статьи с описанием предполагаемого механизма (см., например, G. Jones, Z. Krebs, 2017. The trimerization of acetylenes involves a cascade of biradical and pericyclic processes), но окончательной ясности не было.
Дело в том, что механизмы катализа — не самая простая тема для изучения. С известной долей упрощения можно сказать, что катализатор реагирует с исходными веществами (реагентами), образуя более реакционноспособные промежуточные продукты, которые потом легче вступают в последующие превращения. Но вот как именно действует тот или иной катализатор понять непросто, ведь все они не похожи между собой и даже один и тот же катализатор может в разных процессах вести себя по-разному.
Полностью описать механизм тримеризации ацетилена на угольном катализаторе ученые сумели только в этом году. Этот большой шаг в изучении работы углеродных катализаторов сделала группа российских химиков из Института органической химии им. Зелинского под руководством Валентина Павловича Ананикова (см. Ananikov Lab). В их работе были использованы теоретические расчеты с использованием теории функционала электронной плотности. В таких расчетах главным параметром изучаемой системы (молекулы, иона, фрагмента твердого тела и т. д.) является ее электронная плотность — распределение вероятности нахождения электрона в данной точке пространства. Искомые свойства системы — строение (взаимное расположение ее частей), энергия, и некоторые другие — могут быть записаны как функционал (то есть функция от функций) от электронной плотности. Сама же плотность связана взаимно однозначным соответствием с внешним потенциалом, который действует на электроны. Метод функционала плотности хорошо показал себя в изучении механизмов химических реакций и при этом позволяет проводить расчеты относительно быстро.

Рис. 2. Схематичное изображение фрагмента графенового листа. Каждый атом в глубине листа образует четыре связи. Атомы на нижнем и верхнем краях (так называемые зигзагообразные края) имеют по два свободных электрона; атомы на левом и правом краях — по одному свободному электрону


Рис. 3. Энергетический профиль реакции тримеризации ацетилена. Промежуточные продукты обозначены цифрами, переходные состояния — буквами TS (transition state). Величина изменения свободной энергии на каждом шаге подписана под номером шага. После девятого шага возможны два пути дальнейших превращений. Менее выгодный ассоциативный путь (через присоединение еще одной молекулы ацетилена) показан красным цветом, более выгодный диссоциативный путь — синим. Рисунок из обсуждаемой статьи в Journal of American Chemical Society
Затем авторы разбили реакцию тримеризации ацетилена на стадии. Для каждой стадии превращения они рассчитали два параметра — изменение свободной энергии Гиббса и энергию активации.
Первый параметр — свободная энергия Гиббса — показывает какая часть от полной внутренней энергии системы может быть использована для химических превращений или получена в их результате, и таким образом позволяет определить, возможно ли в данных условиях протекание процесса. Если изменение энергии Гиббса отрицательно (ΔG 0, то для протекания процесса необходим приток энергии извне (например, в виде тепла). Чем больше изменение, тем больше энергии надо подвести и тем труднее осуществить такой процесс.
Второй параметр — энергия активации реакции или активационный барьер — величина, которая показывает, сколько энергии в среднем не хватает молекулам исходных реагентов для того, чтобы между ними произошло взаимодействие. Дело в том, что в процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией, чем исходное (например, необходимо преодолеть межмолекулярное отталкивание, разорвать связи для создания новых связей и т. д.). То есть молекулы должны преодолеть некий энергетический барьер, а если этого не произойдет, то реакция не начнётся. Отметим, что этот параметр характеризует не принципиальную возможность процесса, а только его скорость. Даже если средний уровень свободной энергии намного ниже, чем необходимо — например, температура системы очень низкая, — взаимодействие все равно возможно. Всегда найдутся молекулы с энергией выше средней, которые смогут преодолеть активационный барьер, просто их будет немного, поэтому процесс будет очень медленным. В отличие от изменения энергии Гиббса, которое может быть и положительным, и отрицательным, энергия активации всегда только положительная. Чем она меньше, тем легче и быстрее протекает превращение.
Если затем отложить все полученные значения на одном графике — получится так называемый энергетический профиль реакции (он и показан на рис. 3). Чем ниже расположено вещество на графике, тем оно стабильнее и тем выгоднее его образование. Промежуточные состояния для каждого шага на этом профиле представлены небольшими холмиками (максимумами), чем выше холмик — тем больше энергетический барьер данного превращения.
Итак, вернемся к нашим частицам катализатора и ацетилену. Рассчитав строение исходных частиц, авторы стали добавлять в систему по одной молекуле ацетилена и отслеживать, какие продукты при этом могут образоваться.
Оказалось, что первая молекула ацетилена присоединяется к реакционному центру очень легко: активационный барьер процесса всего 11,3 ккал/моль, а разница относительной энергии образования составляет −29,7 ккал/моль. На образование связи с ацетиленом нужно два электрона (любая связь — это два электрона): один из той самой пары на катализаторе, а другой предоставит ацетилен, разорвав свою тройную связь. В итоге в получившемся промежуточном продукте (на рис. 3 у него номер 3), один неспаренный электрон будет локализован на концевом атоме углерода, а второй — делокализован (размазан) по частице катализатора. Атом на конце цепи с неспаренным электроном тоже будет реакционноспособным, поэтому вторая молекула ацетилена присоединится к нему. Этот шаг пройдет так же легко, как и первый (барьер 10,5 ккал/моль, разница относительной энергии образования −35,8 ккал/моль). После этого реакционный центр снова мигрирует на концевой атом (промежуточный продукт номер 5). Третий шаг в точности повторяет первые два — цепь удлиняется еще на два атома, реакционный центр опять переместится на ее конец. Величина энергетического барьера 11,2 ккал/моль, разница относительной энергии образования −35,1 ккал/моль — оба значения также близки к соответствующим значениям двух предыдущих шагов. А вот дальше начинается самое интересное.
Кроме того, авторы сравнили между собой графеновые хлопья разного размера и строения и показали, что для некоторых из них обновление реакционного центра и вовсе невозможно. Только частицы с реакционным центром, который расположен на графеновом крае и имеет два электрона, способны к перераспределениям электронной плотности и в итоге — к обновлению карбенового центра. Если же реакционный центр располагается на другом крае и изначально имеет один электрон, такого не происходит. Поэтому реакция останавливается после первого цикла.


Рис. 4. (a) — фото экспериментальной установки, (b) — ее схема: ацетилен пропускают через толстую трубу, которая заполнена большим количеством тонких стеклянных трубочек, середина трубы помещена в печь, внизу находится термометр. (c) — фото стеклянных трубочек до и после реакции; (d) и (e) — СЭМ-снимки стеклянных трубочек после реакции; (f) — ПЭМ-снимки черного налета, извлеченного из трубочек. Рисунок из обсуждаемой статьи в Journal of American Chemical Society
И конечно, нельзя не отметить историческую значимость этой работы. Один из наиболее известных русских химиков-органиков, Николай Зелинский, был не только выдающимся ученым, но и талантливым педагогом. Он всю жизнь уделял большое внимание воспитанию новых поколений исследователей, в том числе активно участвовал в организации Института Органической Химии — того самого, в котором сейчас работают Анаников и его научная группа. Это безусловно знаковый момент, что именно ученым из института имени Н. Д. Зелинского удалось в конце концов прояснить механизм этой реакции. Можно сказать, что новая статья прокладывает своеобразный мостик между работами этого выдающегося ученого и использованием углеродных катализаторов в будущем.
Источник: Evgeniy G. Gordeev, Evgeniy O. Pentsak, and Valentine P. Ananikov. Carbocatalytic Acetylene Cyclotrimerization: A Key Role of Unpaired Electron Delocalization // Journal of the American Chemical Society. 2020. DOI: 10.1021/jacs.9b10887.

Ацетилен (C2H2) — газообразный (при нормальных условиях) углеводород, в котором два атома углерода связаны тройной связью. Ацетилен очень легко вступает в реакции и широко используется в органическом химическом синтезе как исходное соединение для получения многих веществ. А в начале XX века (до того, как химики освоили крекинг нефти и научились получать всё из нее) значение ацетилена было еще больше, поскольку это было одно из немногих органических веществ, которые можно было получать из неорганических: ацетилен умели синтезировать из карбида кальция и воды при помощи реакции Вёлера. Поэтому превращение ацетилена в различные вещества активно изучалось учеными по всему миру.
В частности, в 1924 году российский химик Николай Дмитриевич Зелинский вместе со своим коллегой Борисом Александровичем Казанским показал, что ацетилен можно превратить в другой углеводород бензол (C6H6). Бензол — жидкий циклический углеводород (все атомы углерода в его молекуле соединены в один шестичленный цикл). Это одно из важнейших веществ в органической химии, оно до сих пор используется как исходное соединение для многих промышленно важных реакций. Чтобы получить бензол, Зелинский нагревал ацетилен до температуры 600 градусов Цельсия над раскаленным активированным углем — пористым углеродным материалом, который был впервые получен в его лаборатории в 1915 году. Зелинский ожидал, что благодаря большой площади поверхности активированный уголь будет хорошо адсорбировать ацетилен и таким образом препятствовать детонации при нагревании. При этом на поверхности активированного угля молекулы ацетилена будут соединяться по три штуки (тримеризоваться), превращаясь в молекулы бензола. А вот активированный уголь ни во что превращаться не будет, в данной реакции он является катализатором — веществом, которое ускоряет протекание реакции, но не расходуется в ней.
Эксперименты Зелинского показали, что с помощью такого процесса можно превратить около 35% ацетилена в бензол, а еще часть ацетилена разлагается с образованием твердых продуктов, которые оседают на поверхность катализатора. Однако точный механизм этой реакции (и, в частности, роль в нем угольного катализатора) Зелинский в своих работах не описал, и с тех пор его так и не удавалось полностью изучить. В 1948 году немецкий химик Реппе предложил более выгодный способ превращать ацетилен в бензол (использование катализаторов из соединений никеля при 60°C), а в наши дни бензол в основном получают крекингом нефти. Реакция Зелинского утратила свое прикладное значение, но ее механизм продолжал интересовать ученых — как занимательная химическая загадка. Время от времени выходили статьи с описанием предполагаемого механизма (см., например, G. Jones, Z. Krebs, 2017. The trimerization of acetylenes involves a cascade of biradical and pericyclic processes), но окончательной ясности не было.
Дело в том, что механизмы катализа — не самая простая тема для изучения. С известной долей упрощения можно сказать, что катализатор реагирует с исходными веществами (реагентами), образуя более реакционноспособные промежуточные продукты, которые потом легче вступают в последующие превращения. Но вот как именно действует тот или иной катализатор понять непросто, ведь все они не похожи между собой и даже один и тот же катализатор может в разных процессах вести себя по-разному.
Полностью описать механизм тримеризации ацетилена на угольном катализаторе ученые сумели только в этом году. Этот большой шаг в изучении работы углеродных катализаторов сделала группа российских химиков из Института органической химии им. Зелинского под руководством Валентина Павловича Ананикова (см. Ananikov Lab). В их работе были использованы теоретические расчеты с использованием теории функционала электронной плотности. В таких расчетах главным параметром изучаемой системы (молекулы, иона, фрагмента твердого тела и т. д.) является ее электронная плотность — распределение вероятности нахождения электрона в данной точке пространства. Искомые свойства системы — строение (взаимное расположение ее частей), энергия, и некоторые другие — могут быть записаны как функционал (то есть функция от функций) от электронной плотности. Сама же плотность связана взаимно однозначным соответствием с внешним потенциалом, который действует на электроны. Метод функционала плотности хорошо показал себя в изучении механизмов химических реакций и при этом позволяет проводить расчеты относительно быстро.

Рис. 2. Схематичное изображение фрагмента графенового листа. Каждый атом в глубине листа образует четыре связи. Атомы на нижнем и верхнем краях (так называемые зигзагообразные края) имеют по два свободных электрона; атомы на левом и правом краях — по одному свободному электрону

Рис. 3. Энергетический профиль реакции тримеризации ацетилена. Промежуточные продукты обозначены цифрами, переходные состояния — буквами TS (transition state). Величина изменения свободной энергии на каждом шаге подписана под номером шага. После девятого шага возможны два пути дальнейших превращений. Менее выгодный ассоциативный путь (через присоединение еще одной молекулы ацетилена) показан красным цветом, более выгодный диссоциативный путь — синим. Рисунок из обсуждаемой статьи в Journal of American Chemical Society
Затем авторы разбили реакцию тримеризации ацетилена на стадии. Для каждой стадии превращения они рассчитали два параметра — изменение свободной энергии Гиббса и энергию активации.
Первый параметр — свободная энергия Гиббса — показывает какая часть от полной внутренней энергии системы может быть использована для химических превращений или получена в их результате, и таким образом позволяет определить, возможно ли в данных условиях протекание процесса. Если изменение энергии Гиббса отрицательно (ΔG 0, то для протекания процесса необходим приток энергии извне (например, в виде тепла). Чем больше изменение, тем больше энергии надо подвести и тем труднее осуществить такой процесс.
Второй параметр — энергия активации реакции или активационный барьер — величина, которая показывает, сколько энергии в среднем не хватает молекулам исходных реагентов для того, чтобы между ними произошло взаимодействие. Дело в том, что в процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией, чем исходное (например, необходимо преодолеть межмолекулярное отталкивание, разорвать связи для создания новых связей и т. д.). То есть молекулы должны преодолеть некий энергетический барьер, а если этого не произойдет, то реакция не начнётся. Отметим, что этот параметр характеризует не принципиальную возможность процесса, а только его скорость. Даже если средний уровень свободной энергии намного ниже, чем необходимо — например, температура системы очень низкая, — взаимодействие все равно возможно. Всегда найдутся молекулы с энергией выше средней, которые смогут преодолеть активационный барьер, просто их будет немного, поэтому процесс будет очень медленным. В отличие от изменения энергии Гиббса, которое может быть и положительным, и отрицательным, энергия активации всегда только положительная. Чем она меньше, тем легче и быстрее протекает превращение.
Если затем отложить все полученные значения на одном графике — получится так называемый энергетический профиль реакции (он и показан на рис. 3). Чем ниже расположено вещество на графике, тем оно стабильнее и тем выгоднее его образование. Промежуточные состояния для каждого шага на этом профиле представлены небольшими холмиками (максимумами), чем выше холмик — тем больше энергетический барьер данного превращения.
Итак, вернемся к нашим частицам катализатора и ацетилену. Рассчитав строение исходных частиц, авторы стали добавлять в систему по одной молекуле ацетилена и отслеживать, какие продукты при этом могут образоваться.
Оказалось, что первая молекула ацетилена присоединяется к реакционному центру очень легко: активационный барьер процесса всего 11,3 ккал/моль, а разница относительной энергии образования составляет −29,7 ккал/моль. На образование связи с ацетиленом нужно два электрона (любая связь — это два электрона): один из той самой пары на катализаторе, а другой предоставит ацетилен, разорвав свою тройную связь. В итоге в получившемся промежуточном продукте (на рис. 3 у него номер 3), один неспаренный электрон будет локализован на концевом атоме углерода, а второй — делокализован (размазан) по частице катализатора. Атом на конце цепи с неспаренным электроном тоже будет реакционноспособным, поэтому вторая молекула ацетилена присоединится к нему. Этот шаг пройдет так же легко, как и первый (барьер 10,5 ккал/моль, разница относительной энергии образования −35,8 ккал/моль). После этого реакционный центр снова мигрирует на концевой атом (промежуточный продукт номер 5). Третий шаг в точности повторяет первые два — цепь удлиняется еще на два атома, реакционный центр опять переместится на ее конец. Величина энергетического барьера 11,2 ккал/моль, разница относительной энергии образования −35,1 ккал/моль — оба значения также близки к соответствующим значениям двух предыдущих шагов. А вот дальше начинается самое интересное.
Кроме того, авторы сравнили между собой графеновые хлопья разного размера и строения и показали, что для некоторых из них обновление реакционного центра и вовсе невозможно. Только частицы с реакционным центром, который расположен на графеновом крае и имеет два электрона, способны к перераспределениям электронной плотности и в итоге — к обновлению карбенового центра. Если же реакционный центр располагается на другом крае и изначально имеет один электрон, такого не происходит. Поэтому реакция останавливается после первого цикла.

Рис. 4.(a) — фото экспериментальной установки, (b) — ее схема: ацетилен пропускают через толстую трубу, которая заполнена большим количеством тонких стеклянных трубочек, середина трубы помещена в печь, внизу находится термометр. (c) — фото стеклянных трубочек до и после реакции; (d) и (e) — СЭМ-снимки стеклянных трубочек после реакции; (f) — ПЭМ-снимки черного налета, извлеченного из трубочек. Рисунок из обсуждаемой статьи в Journal of American Chemical Society
И конечно, нельзя не отметить историческую значимость этой работы. Один из наиболее известных русских химиков-органиков, Николай Зелинский , был не только выдающимся ученым, но и талантливым педагогом. Он всю жизнь уделял большое внимание воспитанию новых поколений исследователей, в том числе активно участвовал в организации Института Органической Химии — того самого, в котором сейчас работают Анаников и его научная группа. Это безусловно знаковый момент, что именно ученым из института имени Н. Д. Зелинского удалось в конце концов прояснить механизм этой реакции. Можно сказать, что новая статья прокладывает своеобразный мостик между работами этого выдающегося ученого и использованием углеродных катализаторов в будущем.
Источник: Evgeniy G. Gordeev, Evgeniy O. Pentsak, and Valentine P. Ananikov. Carbocatalytic Acetylene Cyclotrimerization: A Key Role of Unpaired Electron Delocalization // Journal of the American Chemical Society. 2020. DOI: 10.1021/jacs.9b10887.
Читайте также:

