Применение углерода в медицине сообщение по химии
Обновлено: 05.07.2024
Углерод - биогенный элемент. Его соединения играют особую роль в жизнедеятельности растительных и животных организмов (среднее содержание углерода 18%).
Соединения углерода (углеводы, белки, жиры, ДНК и РНК, гормоны, амино- и карбоновые кислоты ) участвуют в построении всех тканей организма, обеспечении жизнедеятельности животных и растений.
Главной функцией углерода является формирование разнообразия органических соединений, тем самым обеспечивая биологическое разнообразие, участие во всех функциях и проявлениях живого. Столь существенная физиологическая роль углерода определяется тем, что этот элемент входит в состав всех органических соединений и принимает участие практически во всех биохимических процессах в организме.
Окисление соединений углерода под действием кислорода приводит к образованию воды и углекислого газа; этот процесс служит для организма источником энергии.
Двуокись углерода CO2 (углекислый газ) образуется в процессе обмена веществ, является стимулятором дыхательного центра, играет важную роль в регуляции дыхания и кровообращения.
Применение соединений углерода
В фармакологии и медицине широко используются различные соединения углерода - производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции газов и выведения из организма различных токсинов; графит (в виде мазей) - для лечения кожных заболеваний; радиоактивные изотопы углерода - для научных медицинских исследований и
УГЛЕРОД
Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Виде соединений: нефть, природный газ, каменный угль, гранит, мрамор, магнезит. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов. Углерод входит в состав растений и животных (~18 %). В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ УГЛЕРОДА.
| алмаз | графит | карбин |
| sp3-гибридизация, форма тетраэдрические Ϭ -связи прочные, ковалентные, поэтому очень твердый. Бесцветное прозрачное кристаллическое вещ -во | sp2-гибридизация, слоистая структура, большое расстояние и непрочные связи между слоями, поэтому мягкий Темно-серые кристаллы, с металл. блеском. Хорошо проводит эл. ток | sp-гибридизация линейный полимер, твердое вещество, обладает полупроволниковыми св-ми. |
Получение углерода Получают нагреванием без доступа воздуха из древесины и каменног угля, а также при крекинге метана: CH4=C+2H2
Химические свойства
1. Взаимодействие с кислородом: C+O2=CO2
2. Взаимодействие с водой: С+H2O=CO+H2
3.Восстанавливает металлы из их оксидов: CuO+C=Cu+CO -при нагревании
4. С конц. серной и азотной кислотой: 4HNO3+3C=3CO2+4NO+2H2O
1С металлами при нагревании с образованием карбидов Ca+2C=CaC2
2 С водородом с образованием углеводородов: H2+C=CH4
АЛЮМИНИЙ
По распространенности в природе алюминий занимает 3 место среди химических элементов (после кислорода и кремния) и первое место среди металлов, составляет более 9% массы земной коры. Он входит в состав силикатов и глин. Из соединений наибольшее значение имеют: Оксид алюминия Al2O3- корунд, сапфир, рубин; бокситы и алюмосиликаты. Получают алюминий путем электролиза Al2O3
ХИМИЧЕСКИЕ СВОЙСТВА
3.С серой и углеродом при нагревании 2Al+3S=Al2S3 4Al+3C=Al4C3
4.Алюминотермия- получение металлов стоящ. В ряду напряжения после Al: 8Al+3Fe3O4=4Al2O3+9Fe
5. С водой (после разрушения оксидной пленки) 2Al+6H2O=2Al(OH)3+3H2
6. Растворяется в щелочах 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
7. Реагирует с кислотами 2Al+6HCl=2AlCl3+3H2
8. С азотной и концентрированной серной кислотами на холоду не реагируют. При нагревании: Al+6H2SO4(конц.)=Al2(SO4)3+3SO2+6H2O Al+6HNO3=Al(NO3)3+3NO2+3H2O
| Оксид алюминия Al2O3 - очень твердый (корунд, рубин), тугоплавкий Не растворяется в воде. Получение:2Al(OH)3=Al2O3+3H2O Свойства: амфотерный оксид Al2O3+6HCl=2AlCl3+3H2O Al2O3+2NaOH+3H2O=2Na[Al(OH)4] Для перевода в растворимое состояние используют сплавление с сухими щелочами с образованием(метаалюминатов): Al2O3+2NaOH=2NaAlO2 | Гидроксид Al(OH)3 Получение: AlCl3+3(NH3·H2O)=Al(OH)3+NHCl Свойства: амфотерное основание Al(OH)3+HCl=AlCl3+3H2O Al(OH)3+NaOH=Na[Al(OH)4] |
Амфотерность(двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия: а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
В реакциях (а) Al(OH)3 и Al2О3 проявляют свойства оснóвных гидроксидов и оксидов, то есть они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий является катионом Al 3+. , а с щелочами аллюминаты
Напротив, в реакциях (б) Al(OH)3 и Al2О3 выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом алюминия Al III входит в состав аниона (кислотного остатка) AlО2 − .
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный элемент.
Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные свойства наиболее ярко проявляются для промежуточной степени окисления.
Углерод - биогенный элемент. Его соединения играют особую роль в жизнедеятельности растительных и животных организмов (среднее содержание углерода 18%).
Соединения углерода (углеводы, белки, жиры, ДНК и РНК, гормоны, амино- и карбоновые кислоты ) участвуют в построении всех тканей организма, обеспечении жизнедеятельности животных и растений.
Главной функцией углерода является формирование разнообразия органических соединений, тем самым обеспечивая биологическое разнообразие, участие во всех функциях и проявлениях живого. Столь существенная физиологическая роль углерода определяется тем, что этот элемент входит в состав всех органических соединений и принимает участие практически во всех биохимических процессах в организме.
Окисление соединений углерода под действием кислорода приводит к образованию воды и углекислого газа; этот процесс служит для организма источником энергии.
Двуокись углерода CO2 (углекислый газ) образуется в процессе обмена веществ, является стимулятором дыхательного центра, играет важную роль в регуляции дыхания и кровообращения.
Применение соединений углерода
В фармакологии и медицине широко используются различные соединения углерода - производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции газов и выведения из организма различных токсинов; графит (в виде мазей) - для лечения кожных заболеваний; радиоактивные изотопы углерода - для научных медицинских исследований и
УГЛЕРОД
Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Виде соединений: нефть, природный газ, каменный угль, гранит, мрамор, магнезит. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов. Углерод входит в состав растений и животных (~18 %). В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ УГЛЕРОДА.
| алмаз | графит | карбин |
| sp3-гибридизация, форма тетраэдрические Ϭ -связи прочные, ковалентные, поэтому очень твердый. Бесцветное прозрачное кристаллическое вещ -во | sp2-гибридизация, слоистая структура, большое расстояние и непрочные связи между слоями, поэтому мягкий Темно-серые кристаллы, с металл. блеском. Хорошо проводит эл. ток | sp-гибридизация линейный полимер, твердое вещество, обладает полупроволниковыми св-ми. |
Получение углерода Получают нагреванием без доступа воздуха из древесины и каменног угля, а также при крекинге метана: CH4=C+2H2
Химические свойства
1. Взаимодействие с кислородом: C+O2=CO2
2. Взаимодействие с водой: С+H2O=CO+H2
3.Восстанавливает металлы из их оксидов: CuO+C=Cu+CO -при нагревании
4. С конц. серной и азотной кислотой: 4HNO3+3C=3CO2+4NO+2H2O
1С металлами при нагревании с образованием карбидов Ca+2C=CaC2
2 С водородом с образованием углеводородов: H2+C=CH4
АЛЮМИНИЙ
По распространенности в природе алюминий занимает 3 место среди химических элементов (после кислорода и кремния) и первое место среди металлов, составляет более 9% массы земной коры. Он входит в состав силикатов и глин. Из соединений наибольшее значение имеют: Оксид алюминия Al2O3- корунд, сапфир, рубин; бокситы и алюмосиликаты. Получают алюминий путем электролиза Al2O3
ХИМИЧЕСКИЕ СВОЙСТВА
3.С серой и углеродом при нагревании 2Al+3S=Al2S3 4Al+3C=Al4C3
4.Алюминотермия- получение металлов стоящ. В ряду напряжения после Al: 8Al+3Fe3O4=4Al2O3+9Fe
5. С водой (после разрушения оксидной пленки) 2Al+6H2O=2Al(OH)3+3H2
6. Растворяется в щелочах 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
7. Реагирует с кислотами 2Al+6HCl=2AlCl3+3H2
8. С азотной и концентрированной серной кислотами на холоду не реагируют. При нагревании: Al+6H2SO4(конц.)=Al2(SO4)3+3SO2+6H2O Al+6HNO3=Al(NO3)3+3NO2+3H2O
| Оксид алюминия Al2O3 - очень твердый (корунд, рубин), тугоплавкий Не растворяется в воде. Получение:2Al(OH)3=Al2O3+3H2O Свойства: амфотерный оксид Al2O3+6HCl=2AlCl3+3H2O Al2O3+2NaOH+3H2O=2Na[Al(OH)4] Для перевода в растворимое состояние используют сплавление с сухими щелочами с образованием(метаалюминатов): Al2O3+2NaOH=2NaAlO2 | Гидроксид Al(OH)3 Получение: AlCl3+3(NH3·H2O)=Al(OH)3+NHCl Свойства: амфотерное основание Al(OH)3+HCl=AlCl3+3H2O Al(OH)3+NaOH=Na[Al(OH)4] |
Амфотерность(двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия: а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
В реакциях (а) Al(OH)3 и Al2О3 проявляют свойства оснóвных гидроксидов и оксидов, то есть они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий является катионом Al 3+. , а с щелочами аллюминаты
Напротив, в реакциях (б) Al(OH)3 и Al2О3 выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом алюминия Al III входит в состав аниона (кислотного остатка) AlО2 − .
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный элемент.
Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные свойства наиболее ярко проявляются для промежуточной степени окисления.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Вы можете изучить и скачать доклад-презентацию на тему Углерод - новые грани его использования в медицине. Презентация на заданную тему содержит 19 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!



















Углерод в живой природе Углерод является одним из важнейших химических элементов на Земле, являясь элементом 4-й группы Периодической системы химических элементов таблицы Д.И.Менделеева с атомным номером 6.
Использование углерода в медицине Широкое распространение углерода в природе, его высокая биологическая совместимость обусловили большой интерес к нему при разработке различных технологий изготовления медицинских изделий, искусственных органов и тканей. Исследователи, обратившие внимание на углерод и его высокое содержание в организме человека постарались ответить на вопрос: если углерод является составной частью органических соединений разных тканей, то почему он не используется в качестве имплантатов? Логически рассуждая, углерод должен вписываться в структуру органов и тканей, следовательно, из него можно изготавливать изделия медицинского назначения, а именно имплантаты.
В настоящее время в медицине используют большое количество различных имплантатов. Следует отметить, что применение любых инородных тканей, к которым относятся имплантаты, - вынужденная мера, и, прибегая к ней, необходимо помнить, что любой имплантат обладает определённы При всех положительных характеристиках имплантатов, изготовленных из титана, керамики и полимеров, в процессе их применения выявился ряд недостатков, касающихся инфекционных осложнений, аллергических проявлений, реакций отторжения или явлений металлоза. ми отрицательными качествами. В настоящее время в медицине используют большое количество различных имплантатов. Следует отметить, что применение любых инородных тканей, к которым относятся имплантаты, - вынужденная мера, и, прибегая к ней, необходимо помнить, что любой имплантат обладает определённы При всех положительных характеристиках имплантатов, изготовленных из титана, керамики и полимеров, в процессе их применения выявился ряд недостатков, касающихся инфекционных осложнений, аллергических проявлений, реакций отторжения или явлений металлоза. ми отрицательными качествами.
Большая хрупкость имплантатов из керамики и высокий модуль упругости ограничивают возможность применения их в зонах значительной механической нагрузки. Недостаточные механические характеристики подобных материалов не позволяют создавать большие по размерам нагружаемые керамические имплантаты. Большая хрупкость имплантатов из керамики и высокий модуль упругости ограничивают возможность применения их в зонах значительной механической нагрузки. Недостаточные механические характеристики подобных материалов не позволяют создавать большие по размерам нагружаемые керамические имплантаты. Полимеры в процессе биологического старения могут выделять низкомолекулярные продукты, оказывающие токсическое и канцерогенное воздействие на организм человека. Высокий модуль упругости имплантатов, изготовленных из металлов, является одной из причин резорбции кости. В процессе их использования ионы металлов, диффундируя в окружающие ткани, приводят к развитию явлений металлоза.
На поиск материалов, которые приближались бы по своим медико-биологическим характеристикам к кости человека, были направлены исследования, проводимые в последние десятилетия в России и за рубежом. Как показал анализ работ ряда авторов и собственный опыт, такими материалами, обладающими высокой биологической совместимостью и одновременно необходимыми прочностными характеристиками, являются углеродные композиционные материалы. На поиск материалов, которые приближались бы по своим медико-биологическим характеристикам к кости человека, были направлены исследования, проводимые в последние десятилетия в России и за рубежом. Как показал анализ работ ряда авторов и собственный опыт, такими материалами, обладающими высокой биологической совместимостью и одновременно необходимыми прочностными характеристиками, являются углеродные композиционные материалы.
Идея выбора углерода в качестве материала для изготовления медицинских изделий базируется на его уникальном природном свойстве – высокой биологической совместимости. Поэтому, на наш взгляд, углеродные имплантаты не будут иметь конкурентов по степени удовлетворения биохимических и физико-механических требований, предъявляемых к медицинским изделиям. Возвращение интереса к углероду обусловлено созданием нового поколения углеродных композиционных наноструктурных материалов, механические свойства которых могут быть заданы и регулироваться в значительных пределах. Идея выбора углерода в качестве материала для изготовления медицинских изделий базируется на его уникальном природном свойстве – высокой биологической совместимости. Поэтому, на наш взгляд, углеродные имплантаты не будут иметь конкурентов по степени удовлетворения биохимических и физико-механических требований, предъявляемых к медицинским изделиям. Возвращение интереса к углероду обусловлено созданием нового поколения углеродных композиционных наноструктурных материалов, механические свойства которых могут быть заданы и регулироваться в значительных пределах.
Использование углеродных имплантатов в стоматологии Практическое применение углеродных имплантатов раньше других начато в стоматологической практике. Это связано, видимо с тем, что в стоматологии использовались небольшие по объёму имплантаты, которые легче адаптировались в организме человека и не вызывали побочных реакций.
Использование углеродных имплантатов в хирургии скелета Изучение результатов экспериментальных исследований замещения костных дефектов показало, что углеродный материал и кость образуют прямое соединение. Через 3 месяца поры и неровности материала заполняются костной тканью, обеспечивая имплантатам биологическую фиксацию с формированием прочного костно-углеродного блока. Доказано, что имплантаты из УУКМ не уступают по своим механическим и биологическим характеристикам другим искусственным материалам и значительно ниже по себестоимости. Принципиальная возможность использования углеродных имплантатов для замещения костных дефектов доказана экспериментально. Результаты исследования успешно прошли клиническую апробацию (А.Ролик, 1987). А.Тяжелов, В.Органов, Л.Горидова (Институт патологии позвоночника и суставов им. М.Ситенко АМН Украины, Харьков, 2001) сообщают о проведённых ими клинико-биомеханических исследованиях при использовании углеродных имплантатов в медицине.
Углеродные наноструктурные имплантаты выпускаются изделиями шести видов: 1. Параллелепипед в качестве опорного элемента при дефектах и клиновидных переломах тел позвонков, кифотических деформациях позвоночника, в качестве опорного элемента в комбинации с костным аутотрансплантатом из ребра или кортикальной пластинки. 2. Эллипсовидной или скошенной формы – для замены межпозвонковых дисков. Для усиления фиксации и предупреждения выдавливания из межпозвонкового канала на их поверхностях имеется пирамидальная остроконечная нарезка. 3. Цилиндрические - разной длины (от 10 до 100 мм с шагом 10 мм) и разных диметров (от 5 до 35 мм с шагом 5 мм). На боковых поверхностях цилиндров имеется продольная и поперечная резьбовая нарезка, увеличивающая площадь поверхности для усиления фиксации за счёт прорастания костной ткани в поры изделия. На торцах цилиндрических имплантатов имеются выступы диаметром и высотой 5-8 мм, которые вводятся в костномозговые каналы отломков. Этим обеспечивается их фиксация в послеоперационном периоде.
4. Клиновидные – с разной высотой клина. Для фиксации в межфрагментарном пространстве на поверхности скосов имеются продольные, поперечные или пирамидальной формы остроконечные нарезки. 5. Фигурные - с полостью и без для остеоиндуктивных наполнителей для получения межтелового спондилодеза при переломах и остеопорозе тел позвонков. 6. Округлой или продольной формы, двухуровневые – для замещения дефектов плоских костей черепа. 4. Клиновидные – с разной высотой клина. Для фиксации в межфрагментарном пространстве на поверхности скосов имеются продольные, поперечные или пирамидальной формы остроконечные нарезки. 5. Фигурные - с полостью и без для остеоиндуктивных наполнителей для получения межтелового спондилодеза при переломах и остеопорозе тел позвонков. 6. Округлой или продольной формы, двухуровневые – для замещения дефектов плоских костей черепа.
Углеродные наноструктурные имплантаты могут применяться у пациентов всех возрастов; не рекомендованы у детей в возрасте до 1 года и пациентов старше 80 лет. Для пациентов с различными массой тела и антропометрическими данными ограничения не установлены. Углеродные наноструктурные имплантаты могут применяться у пациентов всех возрастов; не рекомендованы у детей в возрасте до 1 года и пациентов старше 80 лет. Для пациентов с различными массой тела и антропометрическими данными ограничения не установлены. выраженные психические расстройства, хронические декомпенсированные заболевания внутренних органов, выраженный нагноительный процесс в зоне реконструкции позвоночника с невозможностью полного удаления патологических тканей и восстановления опорности позвоночника, наличие у больного травматического шока, обусловленного наличием тяжёлой скелетной или сочетанной травмы, дерматозы и поверхностная кожная инфекция кожных покровов в зоне предполагаемого вмешательства.
Порядок работы с изделием: При полном или частичном замещении дефектов тел позвонков используются углеродные наноструктурные имплантаты 1-15-го типов. Для доступа к повреждённому телу позвонка грудного отдела производят торакотомию. Рассекается паравертебральная плевра над травмированным телом позвонка. Производятся парциальная или субтотальная корпорэктомия и резекция прилежащих межпозвонковых дисков. В полученный межтеловой дефект вводится углеродный имплантат соответствующего размера.

Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
История открытия углерода
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…

Круговорот углерода в природе
Аллотропные модификации углерода
Углерод — уникальный химический элемент, который образует так называемые аллотропные модификации, или, проще говоря, различные формы. Эти модификации подразделяются кристаллические, аморфные и в виде кластеров.

Аллотропные формы углерода: a) лонсдейлит; б) алмаз;
в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Аморфные формы образованы углеродом с небольшими примесями других химических элементов. Основные представители этой группы: уголь (каменный, древесный, активированный), сажа, антрацит.
Самыми сложными и высокотехнологичными являются соединения углерода в виде кластеров. Кластеры — это особая структура, при которой атомы углерода расположены таким образом, что образуют полую форму, которая заполнена изнутри атомами других элементов, например, воды. В этой группе не так уж и много представителей, в неё входят углеродные наноконусы, астралены и диуглерод.
Применение углерода
Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле — природный газ и нефть. Соединения углерода широко применяются в химической и металлургической промышленности, в строительстве, в машиностроении и медицине. Аллотропные модификации в виде алмазов используют в ювелирном деле, фуллерит и лонсдейлит в ракетостроении. Из соединений углерода изготавливаются различные смазки для механизмов, техническое оборудование и многое другое. Промышленность в настоящее время не может обойтись без углерода, он используется везде!

Презентация посвящена значению углерода, т.к. он имеет различные аллотропные модификации, которые лучше представлять в виде наглядного материала. Презентация поможет охватить больший объём материала и даёт наглядность.
Содержимое разработки

Значение углерода в природе и жизни человека.
Автор презентации: учитель химии МБОУ СОШ № 131 города Новосибирска Цирина Т.А.

Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО 2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
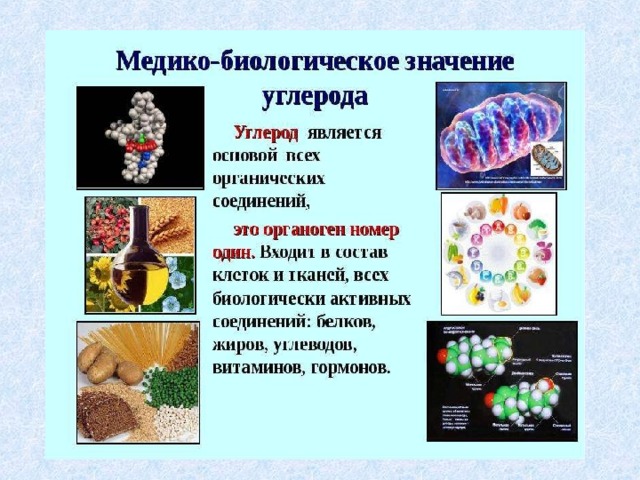

Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле – природный газ и нефть.

Углерод в виде ископаемого топлива: угля и углеводородов — один из важнейших источников энергии для человечества.
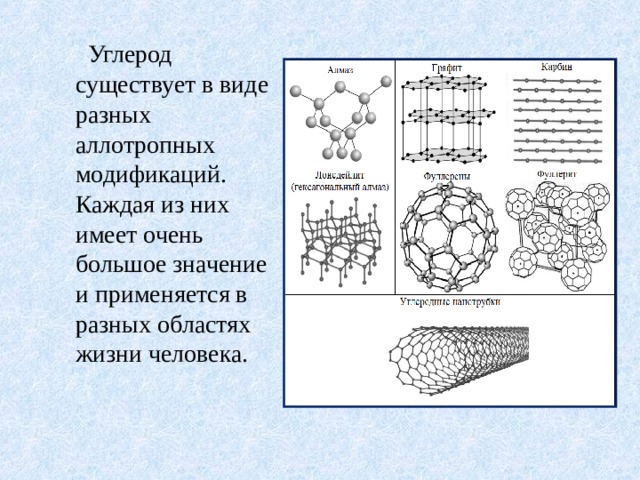
Углерод существует в виде разных аллотропных модификаций. Каждая из них имеет очень большое значение и применяется в разных областях жизни человека.

Алмазы используются для обработки различных твердых материалов, для резки, шлифования, сверления и гравировки стекла, для бурения горных пород.

Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин.

Алмазы после шлифования и огранки превращаются в бриллианты, используемые в качестве украшений.

Графит – ценнейший материал для современной промышленности. Из графита изготавливают литейные формы, плавильные тигли и другие огнеупорные изделия. Благодаря высокой химической устойчивости графит применяется для изготовления труб и аппаратов, выложенных изнутри графитовыми плитами.

Графит используется в карандашной промышленностиТакже его используют в качестве смазки при особо высоких или низких температурах.

Значительные количества графита используют в электротехнической промышленности, например при изготовлении электродов. Графит используется для изготовления некоторых красок. Очень чистый графит используют в ядерных реакторах для замедления нейтронов.
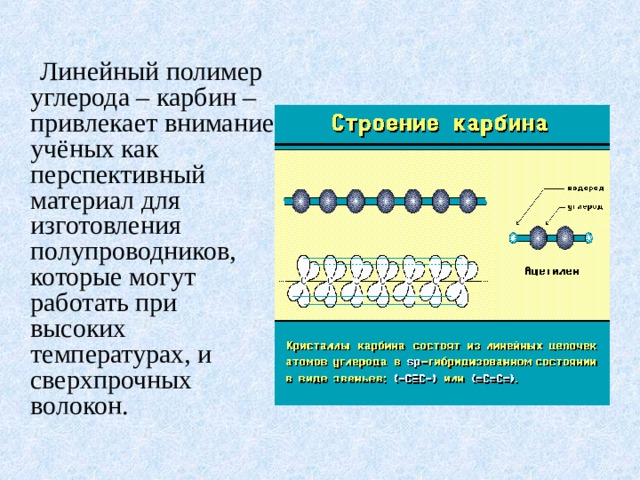
Линейный полимер углерода – карбин – привлекает внимание учёных как перспективный материал для изготовления полупроводников, которые могут работать при высоких температурах, и сверхпрочных волокон.

Древесный уголь используется в металлургической промышленности, в кузнечном деле.

Кокс применяется в качестве восстановителя при выплавке металлов из руд.

Сажа применяется в качестве наполнителя резин для повышения прочности, поэтому автомобильные шины – чёрного цвета. Используют сажу и как компонент печатных красок, туши, крема для обуви.

Активированные угли используются для очистки, извлечения и разделения различных веществ. Активированные угли применяются в качестве наполнителей противогазов и как сорбирующее средство в медицине.

В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения.
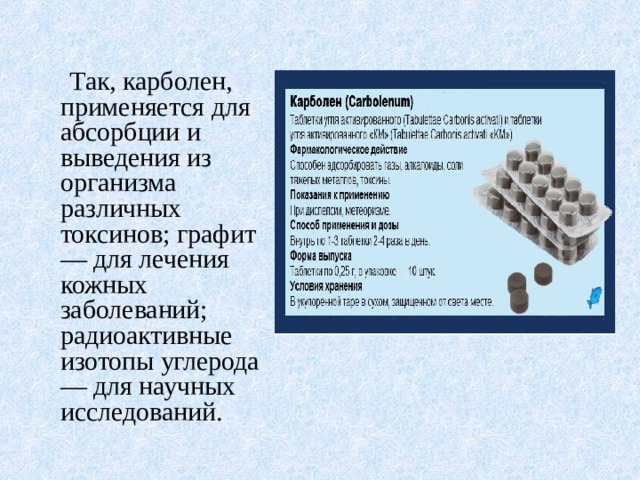
Так, карболен, применяется для абсорбции и выведения из организма различных токсинов; графит — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований.

Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали и чугуна


Спасибо за внимание!

-75%
Читайте также:

