Подготовьте сообщение об истории открытия свойствах и применении одного из галогенов аргументируйте
Обновлено: 02.07.2024
2 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение 5. Проверка знаний Главная Галогены 6. Домашнее задание. Итоги урока.
3 Фтор История открытия галогенов Хлор Бром Йод Астат
5 В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал "дефлогистированной соляной кислотой". В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлороз" - желто- зеленый). В 1812 году Гей-Люсеок дал газу название хлор. История открытия хлора Карл Вильгельм Шееле (1742 – 1786)
7 В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров). История открытия йода Бернар Куртуа (1777 – 1838 )
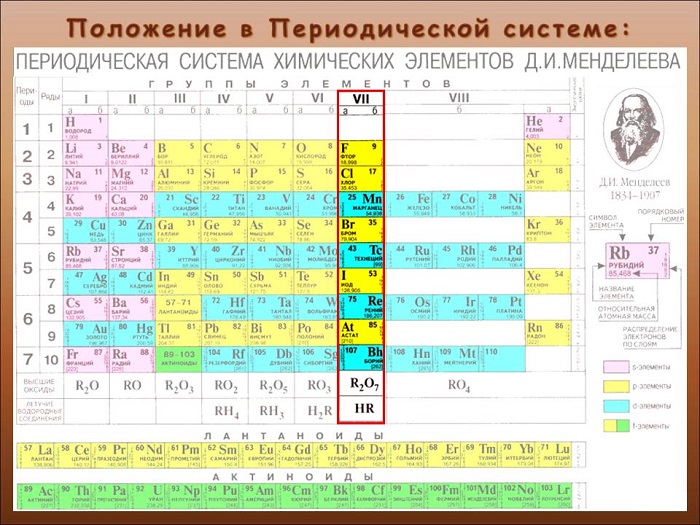
9 Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIVIIIIVVVIVII II I III VII VI V IV Li Литий 3 6,939 Периоды Ряды K Калий Na Натрий 11 22,9898 Cu Медь В Бор Ne Неон ,18 Be Вериллий 4 9,012 Ca Кальций 20 40,08 Ag Серебро Ra Радий 88 [226] La Лантан Al Алюминий 13 26,9815 O Кислород N Азот Ge Германий C Углерод 6 12,011 F фтор Br Бром H Водород Se Селен I Иод Cl Хлор ,453 As Мышьяк He Гелий 2 4,003 Ar Аргон ,948 Xe Ксенон ,3 Kr Криптон 36 83,8 Te Теллур Fe Железо Mg Магний ,312 S Сера ,064 P Фосфор ,9738 Si Кремний ,086 Ti Титан Mo Молибден TсTс Технеций V Ванадий Cr Хром Mn Марганец SсSс Скандий Ga Галлий Re Рений Rh Родий Ir Иридий Ru Рутений Os Осмий Pt Платина Pd Палладий At Астат Rn Радон 8686 [222] Mt Мейтнерий 109 [266 ] Hs Хассий 108 [265 ] Ba Барий Sr Стронций Rb Рубидий In Индий Cs Цезий Fr Франций 87 [223] 9 8 Zn Цинк W Вольфрам Po Полоний Zr Цирконий Nb Ниобий Ta Тантал Cd Кадмий Sb Сурьма Hf Гафний Sn Олово Pb Свинец Bi Висмут Co Кобальт Ni Никель Y Иттрий Au Золото Tl Таллий Hg Ртуть Ac Актиний Bh Борий 107 [262] Sg Сиборгий 106 [263] Db Дубний 105 [262] Rf Резерфордий 104 [261] Галогены
10 Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIVIIIIVVVIVII II I III VII VI V IV Периоды Ряды Фтор/Fluorum (F) Внешний вид простого вещества Бледно-жёлтый газ. Очень ядовит. Электронная коефигуранция [He] 2s 2 2p 5 ЭО (по Полингу) 3,98 Степень окисления 1 Плотность(при 189 °C)1,108 г/см ³ Температура плавления 53,53К Температура кипения 85,01 К
11 Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIVIIIIVVVIVII II I III VII VI V IV Периоды Ряды Хлор / Chlorum (Cl) Внешний вид простого вещества Газ жёлто-зеленого цвета с резким запахом. Ядовит. Электронная коефигуранция [Ne] 3s 2 3p 5 ЭО (по Полингу) 3.16 Степень окисления 7, 6, 5, 4, 3, 1, 1 Плотность(при 33.6 °C)1,56 г/см ³ Температура плавления К Температура кипения К
12 Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIVIIIIVVVIVII II I III VII VI V IV Периоды Ряды Бром / Bromum (Br) Внешний вид простого вещества красно-бурая жидкость с сильным неприятным запахом Электронная конфигурация [Ar] 3d 10 4s 2 4p 5 ЭО (по Полингу) 2,96 Степень окисления 7, 5, 3, 1, -1 Плотность 3,12 г/см³ Температура плавления 265,9 К Температура кипения 331,9 К
13 Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIVIIIIVVVIVII II I III VII VI V IV Периоды Ряды Ио́д / Iodum (I) Внешний вид простого вещества Черно-фиолетовые кристаллы с металлическим блеском Электронная конфигурация [Kr] 4d 10 5s 2 5p 5 ЭО (по Полингу) 2,66 Степень окисления 7, 5, 3, 1, -1 Плотность 4,93 г/см³ Температура плавления 386,7 К Температура кипения 457,5 К
14 Периодическая система химических элементов Д.И.Менделеева Группы элементов IIIIIIVIIIIVVVIVII II I III VII VI V IV Периоды Ряды Аста́т / Astatium (At) Внешний вид простого вещества Нестабильные чёрно-синие кристаллы Электронная конфигурация [Xe] 4f 14 5d 10 6s 2 6p 5 ЭО (по Полингу) 2,2 Степень окисления 7, 5, 3, 1, 1 Плотностьn/a г/см Температура плавления 517 К Температура кипения 582 К
15 Химические свойства 45 F 2 - наиболее реакционно способен, реакции идут на холоду, при нагревании – даже с участием Au, Pt. С простыми веществами: С металлами С неметаллами Na + F 2 H 2 + F 2 Mo + F 2 Xe + F 2 Со сложными веществами: H 2 O + F 2 KCl + F 2 KBr + F 2 KI + F 2 Проверить
16 Химические свойства 45 F 2 - наиболее реакционно способен, реакции идут на холоду, при нагревании – даже с участием Au, Pt. С простыми веществами: С металлами С неметаллами 2Na + F 2 2NaF H 2 + F 2 2HF Mo + 3F 2 MoF 6 Xe + 2F 2 XeF 4 Со сложными веществами: 2H 2 O + F 2 4HF + O 2 2KCl + F 2 Cl 2 + 2NaF 2KBr + F 2 Br 2 + 2КF 2KI + F 2 I 2 + 2КF
17 Химические свойства Cl 2 - сильно реакционно способен (искл. C, O 2, N 2 и не кот. др.) С простыми веществами: С металлами С неметаллами Fe + Cl 2 H 2 + Cl 2 Cu + Cl 2 P + Cl 2 Со сложными веществами: H 2 O + Cl 2 NaOH + Cl 2 KBr + Cl 2 KI + Cl 2 Проверить Горение железа в хлоре
18 Химические свойства Cl 2 - сильно реакционно способен (искл. C, O 2, N 2 и не кот. др.) С простыми веществами: С металлами С неметаллами 2Fe + 3Cl 2 2FeCl 3 H 2 + Cl 2 2HCl (tº, hυ) Cu + Cl 2 Cu Cl 2 2P + 5Cl 2 2PCl 5 ( tº, в изб. Сl 2 ) Со сложными веществами: H 2 O + Cl 2 HCl+HClO хлорная вода 2NaOH + Cl 2 NaOCl + NaCl + H 2 O жавелевая вода 2KBr + Cl 2 Br 2 + 2КCl 2KI + Cl 2 I 2 + 2КCl
19 Химические свойства Br 2 - реакционно способен С простыми веществами: С металлами С неметаллами Al + Br 2 H 2 + Br 2 Cu + Br 2 P + Br 2 Со сложными веществами: Br 2 + H 2 O KI + Br 2 Проверить
20 Химические свойства Br 2 - реакционно способен С простыми веществами: С металлами С неметаллами 2Al + 3Br 2 2AlBr 3 H 2 + Br 2 2HCl Cu + Br 2 Cu Br 2 2P + 5Br 2 2PBr 5 Со сложными веществами: Br 2 + H 2 O HBr + HBrO бромная вода 2KI + Br 2 I 2 + 2КCl
21 Химические свойства I 2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg + I 2 H 2 + I 2 Al + I 2 P + Br 2 Со сложными веществами: I 2 + H 2 O I 2 + р-р крахмала Проверить Действие крахмала на йод
22 Химические свойства I 2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg + I 2 HgI 2 H 2 + I 2 2HCl (tº) 2Al + 3I 2 2AlI 3 2P + 3Br 2 2PI 3 Со сложными веществами: I 2 + H 2 O HI + HIO I 2 + р-р крахмала темно-синее окрашивание
23 F Кости, зубы СlСl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
24 Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
25 Применение хлора О тбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических веществ Получение неорганических хлоридов
26 Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
27 Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
28 Физические свойства галогенов Заполни пропуски Фтор -, в воде, так как интенсивно с ней взаимодействует. Хлор -, раствор хлора в воде практически бесцветен -. Бром -. Йод - с с металлическим блеском. Кристаллический йод легко - переходит из твердого в газообразное состояние. Астат похож на, но имеет более ярко выраженный металлический характер. Все галогены обладают запахом, вдыхание их вызывает сильнейшее раздражение дыхательных путей и тяжелые. черно-фиолетовые кристаллы нерастворим светложелтый газ хлорная вода желто-зеленый газ бурая жидкость йод резким отравления
29 Химические свойства галогенов Поставь коэффициенты Na + Cl 2 = NaCl S + F 2 = SF 6 Fe + Br 2 = FeBr 3 P + Cl 2 = PCl 5 NaI + Cl 2 = NaCl + I 2 F 2 + H 2 O = HF + O 2 NaBr + Cl 2 = NaCl + Br 2 KOH + Cl 2 = KCl + KClO 3 + H 2 O
30 Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Xe + 2F 2 = H 2 + F 2 = 2Au + 3Cl 2 = 2NaCl + 2H 2 O = 2NaI + Cl 2 = 2H 2 O + 2F 2 =2NaOH + H 2 +Cl 2 2NaCl + I 2 XeF 4 4 HF + O 2 2HF 2AuCl 3
31 Спасибо за урок! Благодарю за сотрудничество.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

ИСТОРИЯ ОТКРЫТИЯ ГОЛОГЕНОВ Выполнила Обитоцкая С.М. Г. Владивосток


ИСТОРИЯ ОТКРЫТИЯ ГОЛОГЕНОВ - Фтор - Хлор - Бром - Йод - Астат

ХЛОР - Хлор был открыт шведским химиком Карлом Шееле в 1774 г. В 1810 году сэр Гемфри Дэви назвал газ "хлорином" (Chlorine ), от греческого "зелёный". -Этот термин используется в английском языке, а в других языках закрепилось название "хлор". - Газ желто-зеленого цвета с резким запахом, ядовит в 2,5 раза тяжелее воздуха - в 1 объеме воды при 20 °С растворяется около 2 объемов хлора

БРОМ - От греч. bromos – зловоние - Единственный неметалл, жидкий при комнатной температуре - Тяжелая красно-бурая жидкость с неприятным запахом - Пары брома имеют желто-бурый цвет - При температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском

ЙОД - От греч. iodes—имеющий фиалковый цвет - В парообразное состояние переходит при комнатной t°, не плавясь (сублимация); - Пары -фиолетового цвета - Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент - Известны 37 изотопов иода с массовыми числами от 108 до 144


СПАСИБО ЗА ВНИМАНИЕ!
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 25 человек из 18 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 602 928 материалов в базе
Материал подходит для УМК
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 04.08.2017 2919
- PPTX 1.6 мбайт
- 17 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Обитоцкая Светлана Михайловна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
Школы граничащих с Украиной районов Крыма досрочно уйдут на каникулы
Время чтения: 0 минут
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Минпросвещения России подготовит учителей для обучения детей из Донбасса
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Что такое галогены
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Физические свойства

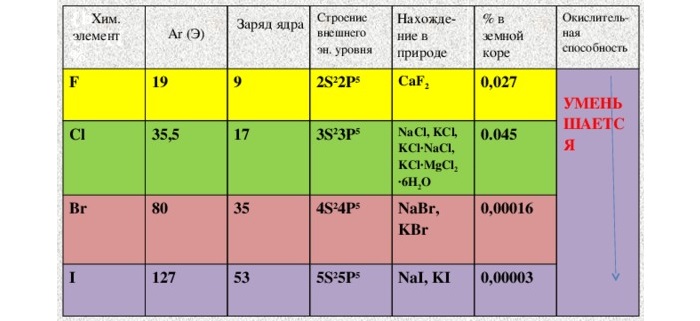
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Общее уравнение:
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Одна из дорог, ведущих в Рим к местам соледобычи, так и называлась – Via Salaria (Соляная дорога). Это древнее название сохранилось и по сей день. Почему же обычной поваренной соли, знакомой каждому с детства, воздают такие почести?

В древности соль добывали из соляных озёр, расположенных неподалеку от устья реки Тибр. Позже ее стали получать из морской воды. Для этого участки суши, затопляемые во время прилива, специально огораживали. По мере испарения воды первой кристаллизовалась поваренная соль. Ее собирали, а остававшийся рассол, содержащий прочие соли, выливали обратно в море.
Соляную кислоту HCl в Средние века называли соляным спиртом. Впервые она упоминается в сочинениях немецкого алхимика Василия Валентина во второй половине XV в. Им описан метод получения соляного спирта сухой перегонкой смеси, состоящей из купороса, квасцов и поваренной соли. Алхимики изучали действие соляного спирта на металлы и оксиды. А вот состав этого вещества долгое время был для учёных загадкой.
Как открывали галогены

Заветной мечтой многих поколений химиков было выделить фтор в свободном виде. Одним из первых такую попытку предпринял Дэви, однако проведенный им электролиз плавиковой кислоты не принёс результатов. Скорая смерть помешала учёному продолжить начатые исследования. Химики, посвятившие себя вслед за Дэви проблеме выделения свободного фтора, получили серьёзные отравления, так и не достигнув желаемого, ведь многие из них не представляли, насколько сильным окислителем является этот газ. Профессор Политехнической школы в Париже Эдмонд Фреми даже наблюдал в 1854 – 1856 гг., как образуются отдельные пузырьки фтора при электролизе расплавленного флюорита, но не сумел его собрать. Впервые это удалось в 1886 г. французскому химику Анри Муассану, который в 1887 г. выделил жидкий фтор. Незадолго до смерти Муассану присудили Нобелевскую премию за получение химически чистого фтора.
Бром открыт в 1826 г. французским химиком А.Ж. Баларом. Это была его первая самостоятельная работа, и так случилось, что она увенчалась выдающимся результатом – обнаружением нового химического элемента. Пропуская хлор через соляной рассол, полученный при упаривании морской воды, Балар заметил, что раствор окрашивается в бурый цвет. Современный химик без труда объяснит это явление: хлор вытесняет бром из бромидов, содержащихся в морской воде: 2KBr + Cl2 = 2KCl + Br2.

Позднее бром стали получать кипячением подкисленного рассола с пиролюзитом MnO2:
Общие физические и химические свойства галогенов
Молекулы простых веществ-галогенов при обычных условиях имеют состав Г2, т.е. F2, Cl2, Br2, I2. Все галогены имеют характерный запах, ядовиты.
Сверху вниз в подгруппе с ростом порядкового номера закономерно изменяются физические свойства простых веществ-галогенов: температура кипения и плавления, агрегатное состояние.
Фтор – газ светло – зеленого цвета; хлор – легко сжижающийся газ желто-зеленого цвета; бром – тяжелая жидкость красно-бурого цвета; йод – твердое кристаллическое вещество с металлическим блеском. Растворимость простых веществ-галогенов в воде в подгруппе сверху вниз уменьшается. Фтор активно взаимодействует с водой, хлор – сравнительно мало растворим в воде, еще менее растворимы в воде бром и йод.
Так как у атомов галогенов на внешнем электронном слое имеется один неспаренный электрон, для них характерна валентность I.
Кроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, а поэтому соответственно числу неспаренных электронов атомы галогенов в соединениях могут проявлять валентность III, V, VII.
Окислительная способность атомов и молекул галогенов сверху вниз в подгруппе уменьшается от фтора к йоду, так как с увеличением радиуса атома способность галогена присоединять электроны уменьшается, т.е. уменьшаются неметаллические свойства галогенов. Фтор – самый сильный окислитель, так как атом фтора имеет наименьший радиус по сравнению с атомами других галогенов.
Окислительную активность галогенов несложно сопоставить, изучив реакции вытеснения одних галогенов другими из водных растворов галогенидов. Наблюдается такая закономерность: галоген с меньшим порядковым номером вытесняет из солей галоген с большим порядковым номером. Например, бром вытесняет йод из йодидов: Br2 + 2KI = I2 + 2KBr, но не реагирует с хлорид-ионами.
Ионы галогенов (кроме F — ) способны отдавать электроны, поэтому они являются восстановителями. Восстановительная способность галогенид-ионов увеличивается от хлорид-иона к йодид-иону: Cl — →Br — → I — .
Все галогены легко взаимодействуют с водородом по уравнению: Г2 + Н2 = 2НГ
Галогеноводороды (HF – фтороводород, HCl – хлороводород, HBr – бромоводород, HI – йодоводород) – это газообразные соединения, легко растворяются в воде. Водные растворы галогеноводородов являются кислотами: HF – фтороводородная (плавиковая), HCl – хлороводородная (соляная), HBr – бромоводородная, HI – йодоводородная.
В ряду кислот HF→ HCl→ HBr→ HI происходит усиление кислотных свойств. Это можно объяснить тем, что сверху вниз в подгруппе галогенов с увеличением заряда ядра атома увеличиваются радиусы атомов. Из всех бескислородных кислот йодоводородная кислота является самой сильной.

В ряду кислородсодержащих кислот HClO→ HClO2→ HClO3→ HClO4 наблюдается усиление кислотных свойств.
Читайте также:

