Оловянная чума кратко сообщение
Обновлено: 04.07.2024
О́лово (лат. Stannum ) — химический элемент, расположенный в пятом периоде в IVА группе периодической системы Менделеева; атомный номер 50, атомная масса 118,69; белый блестящий металл, тяжёлый, мягкий и пластичный (в аллотропной модификации β-олово).
Содержание
История
Происхождение названия
Нахождение в природе
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Распространённость в природе
Распространённость в природе отражается в таблице [2] :
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество (% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 00 1·10 −4 | 0 5·10 −5 | 0 1,5·10 −4 | 0000 − | 000 3·10 −4 | 1·10 −3 | 0 7·10 −7 | 0000 5·10 −5 | 1·10 −3 | 00 5·10 −4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на дм³, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особености его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах [3] .
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма; конкретная форма нахождения олова в этом виде не известна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм в месте с Sn выявлены Fe, Al, Cu, Ti, Cd и т. д., не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и др., а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие [4] , [5] .
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях [5] :
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и т. д.; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и т. д. [6] .
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и пр.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn +4 .
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зерна минерала достигают в размере 3 — 4 мм и даже больше.
Плотность 6040-7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов). Твердость 6½. Блеск — матовый, на гранях — алмазный. Спайность несовершенная. Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (Приморье), коломорфные и криптокристаллические выделения и скопления (Приморье); кристаллическая форма — главная форма выделения касситерита. В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и др.
Гидроокисные соединения
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5] [8] ; пабститом Ba(Sn, Ti)Si3O9 [7] , стоказитом Ca2Sn2Si6O18x4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16О32 (Peterson E.U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождения халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде местрождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.

.
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2SnkO2k+1, SnkO2k−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек HmSn2nSinOp, причём m ≤ 8 [9] , или Hs[SiO2n(SnOm)d] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову (1928—1992) [3]
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяюся подгруппы:
Довольно часто группы (ОН) -1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4-kF k или Sn(OH)4-kFk-n n . В целом соединение Sn(OH)3F устойчиво при Т = 25 — 50 °C, а Sn(OH)2F² при Т = 200 °C.
4. Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4 -4 или SnS3 -2 при рН > 9; SnS2O -2 (pH = 8 — 9) и Sn(SH)4 (pH = 6). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде. 2.Комплексные соединения олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2 -2 будет преобладать при Т = 200 °C. 3.Коллоидные и олово-кремнистые соединения. Об их существании говорит присутствие на многих месторождениях коломорфных выделений касситерита. Смотреть выше.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
- штокверковое олово-вольфрамовое оруденение;
- рудные тела квар-касситерит-арсенопиритового типа;
- продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа;
Добыча
Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Боливии, Перу, Бразилии) и Австралии. В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационном методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановления древесного угля, слои которого укладываются поочередно со слоями руды.
Физические и химические свойства
Оловянная чума
Применение
Цены на металлическое олово в 2006 году составили в среднем 12—18 долл/кг, двуокись олова высокой чистоты около 25 долл/кг, монокристаллическое олово особой чистоты около 210 долл/кг.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 Sn (5,94 %). Этот элемент обладает наибольшим числом стабильных изотопов, что связано с фактом, что 50 (число протонов в ядрах олова) является магическим числом — оно составлет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра.
Изотопы олова 117 Sn и 119 Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Физиологическое действие
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 ºС, не выделяются в воздух рабочей зоны в объёмах, превышающих предельно допустимую концентрацию в соответствии с ГОСТ. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Процесс распада олова, проявление эффекта "оловянная чума"
История явления для лучшего понимания процесса
Итак, прежде чем приступить к описанию самого процесса немного рассмотрим историю олова. Так вот, про олово человечество знает уже не одну тысячу лет, и в свое время являлся даже стратегически важным металлом.
Так как металл достаточно пластичен, то в свое время его активно применяли, например, при производстве пуговиц, для украшений и т. п.
Так в 1910 году полярный исследователь Р. Скотт организовал и лично возглавил полярную экспедицию на Южный полюс с одной целью – покорение. Так путешествие растянулось на несколько месяцев, и проходящая экспедиция на своем пути делала небольшие схроны с необходимым провиантом и топливом в канистрах, которые были запечатаны пробками, выполненными из олова.
Полярная экспедиция
Экспедиция в 1912 году все-таки добралась до полюса, но они были не первыми (их опередил Р. Амундсен). Но не это оказалось важным. Так направившаяся в обратный путь группа шла по своему же пути, но их ждал неприятный сюрприз. Канистры с топливом в ближайшем схроне были вскрыты и, естественно, пусты. Такая же картина ждала путешественников и в следующем запаснике.
К сожалению, экспедиция так и не добралась обратно и замерзла, не сумев согреться.
Еще больше фактов про олово
Так в конце 19-го века из Голландии в тогда еще Российскую империю был отправлен целый состав, который был загружен оловом в слитках. Но вот по пришествию в Москву при осмотре состава в вагонах был найден только порошок серого цвета.
Примерно в это же время была собрана экспедиция для изучения Сибирских просторов. Но при первом же серьезном сибирском морозе случилось неожиданное явление: вся посуда из олова, которая была с членами экспедиции, так же распалась на серый порошок.
В начале 20-го века было зафиксировано ЧП: со всех мундиров пропали оловянные пуговицы и на их месте был найден только серый порошок. После изучения состава порошка было сделано заключение, что металл был поражен оловянной чумой.
Так что же такое оловянная чума
На протяжении долгого времени ученые не могли найти объяснение, что же такое оловянная чума. И только после гибели экспедиции и тщательного расследования был разгадан секрет.
Металл и его структура
Только благодаря использованию рентгеновских аппаратов ученым удалось, наконец, рассмотреть кристаллическую решетку металлов. И уже на основании этого было дано научное объяснение феномену.
Было установлено, что олово обладает достаточно пластичной и вязкой структурой при температуре равной и выше комнатной. Но как только температура металла опускается до -13 градусов по Цельсию кристаллическая структура олова начинает преобразовываться.
При этом атомы начинают располагаться в пространстве на большем расстоянии, и формируется следующая модификация металла – серое олово.
При этом металл полностью теряет свои первоначальные свойства и превращается в полупроводник. Внутри металла растет внутреннее напряжение и это приводит к тому, что олово буквально начинает распадаться и превращается в порошок. Именно так и протекает так называемая оловянная чума.
Скорость течения данной трансформации напрямую зависит от температуры. И наиболее скоротечен процесс распада при температуре в -33 градуса по Цельсию. Так вот именно этот эффект и послужил основной причиной гибели экспедиции, уничтожил целый состав олова и разрушил множество экспонатов и т. п.
Как избавились от оловянной чумы
Научное сообщество работало над решением проблемы оловянной чумы достаточно продолжительное время, и вот спустя время решение было найдено британской ассоциацией производителей.
Это все, что я хотел вам рассказать про такое явление, как оловянная чума. Понравился материал? Тогда оцените его и не забудьте подписаться на канал. Спасибо за ваше внимание!
Олово – лёгкий и пластичный металл серебристого цвета, который обладает одной интересной особенностью, известной как оловянная чума. И да, она заразна!

Оловянная чума – довольно опасная штука, из-за которой даже гибли люди и, говорят, потерпел поражение Наполеон
Олово относится к группе лёгких металлов. При нормальных условиях это пластичный, ковкий и легкоплавкий блестящий металл серебристого цвета. Известны также четыре аллотропические модификации олова: ниже +13,2 градусов — α-олово (серое олово) с кубической решёткой типа алмаза, выше +13,2 градусов — β-олово (белое олово) с тетрагональной кристаллической решёткой, а при высоких давлениях — γ-олово и σ-олово.
Простое олово полиморфно: в обычных условиях оно существует в виде β-модификации, устойчивой выше +13,2 градусов. При охлаждении белое олово переходит в α-модификацию – причём чем ниже температура окружающей среды, тем быстрее. При -33 градусах скорость превращения становится максимальной. Белое олово также превращается в серое под действием ионизирующего излучения.

Дорогая, любимая. Мне непросто писать из-за холода — 70 градусов ниже ноля и только палатка защищает… Мы оказались в тупике, и я не уверен, что мы справимся. Во время короткого завтрака я пользуюсь небольшой толикой тепла, чтобы написать письма, готовясь к возможной кончине. Если с мной что-то случится, я бы хотел, чтобы ты знала, как много ты значила для меня. Заинтересуй сына естественными науками, если сможешь. О, моя дорогая, моя дорогая, как я мечтал о его будущем. И все же, моя девочка, я знаю, что ты справишься. Ваши портреты найдут у меня на груди. Я мог бы многое рассказать тебе об этом путешествии. Какие истории ты смогла бы поведать нашему мальчику, но, ох, какой ценой. Лишиться возможности увидеть твое милое, милое лицо. Я думаю, что шансов нет. Мы решили не убивать себя, и бороться до конца, чтобы добраться до лагеря. Смерть в борьбе безболезненна, так что не волнуйся за меня.
Аллотропия
Рассмотрим три характерных примера аллотропной модификации:
Озон и кислород

Обе этих молекулы состоят из атомов кислорода, но плотность озона в 1,5 раза больше, чем у кислорода, и химическая активность также выше. Например, возможна прямая реакция озона с серебром, которая между кислородом и серебром происходить не будет:
Кислород жизненно необходим для человека, а озон в больших концентрациях вреден, хотя, в малых полезен. Озон обладает сильным приятным запахом, а кислород нет.
Графит и алмаз

Как известно, алмаз имеет максимальную твердость по шкале Мооса (10), а графит минимальную (1). Из иллюстрации понятно, что связи между атомами углерода в горизонтальных слоях графита остаются сильными, а в вертикальном разрезе очень слабые, благодаря чему графит снимается послойно, и им удобно писать.
Белый и красный фосфор


Температура плавления красного фосфора составляет 600 °C, тогда как температура плавления белого – всего 44 °C. При этом красный фосфор не воспламеняется до 250 °C, а белый фосфор воспламеняется уже при 45 °C, а при трении – и при более низких температурах.
Таким образом, поразительные отличия разных аллотропных модификаций у фосфора и углерода связаны с тем, что кристаллическая решетка этих элементов может упорядочиваться принципиально разным образом. Фосфор и углерод находятся в центральной части своих периодов в таблице Менделеева, однако являются полноценными неметаллами, будучи расположены в правом верхнем углу таблицы, где сосредоточены элементы с неметаллическими свойствами:

Здесь желтым цветом обозначены неметаллы, зеленым – переходные металлы, розово-желтым – полуметаллы. И также есть олово, которое, в отличие от сурьмы и германия, правильнее считать полноценным металлом. Но оно находится на три периода ниже углерода, поэтому тоже проявляет ярко выраженные аллотропные свойства.
Оловянная чума
Белое олово – это типичный металл, напоминающий свинец, но легче и тверже. Олово известно с глубокой древности и входит в состав бронзы – одного из первых сплавов, изобретенным человеком (олово + медь). Как олово, так и медь – достаточно мягкие и легкоплавкие металлы, а бронза гораздо прочнее, благодаря чему отлично подошла для изготовления оружия, посуды и инструментов, дав начало Бронзовому Веку. Тем не менее, белое олово существует в достаточно узком температурном режиме, между 161 и 13,2 °C. При более низких температурах олово начинает спонтанно переходить в серую аллотропную форму, напоминающую порошок или даже пыль. Максимальной интенсивности этот процесс достигает примерно при -39 °C, и от металлического олова ничего не остается.

Наиболее опасной чертой такой аллотропной модификации олова является заразность. Серое олово при контакте превращает белое олово в серое, если температура остается достаточно низкой. Так, принесенная с мороза оловянная миска, поставленная в шкаф в неотапливаемом помещении, может заразить всю остальную оловянную посуду.
Очень странно, что Роберт Скотт не учел этого обстоятельства – ведь оловянная чума известна давно; есть даже предположение, что именно из-за оловянной чумы, поразившей пуговицы наполеоновской армии в ходе отступления из Москвы, французы оказались в особенно незавидном положении.
Поразительно, но в недавнем прошлом для оловянной чумы нашлось практическое применение, связанное с очисткой лабораторной и промышленной оптики от капелек олова. Капельки чистейшего олова используются в качестве мишеней для плазмы, которая применяется для получения глубокого ультрафиолета, а глубокий ультрафиолет – для вытравливания микросхем. При этом для сборки ультрафиолета в действующий луч используется тончайшая оптика, которая быстро тускнеет, так как на ней конденсируется олово. Оказалось, что именно обработка оптики серым оловом позволяет полностью очистить стекло, не оставив на нем ни малейших царапин. В результате срок службы такого собирающего зеркала значительно увеличивается.

Но оловянная чума – лишь наиболее известная аллотропная болезнь металла. Есть и значительно более экзотические и не менее опасные метаморфозы, о которых я также хочу здесь рассказать.
Цинковая чума

Чума, подобная оловянной, поражает такой сплав не просто при изменении физических условий, но и, по-видимому, неизбежно, если доли металлов в ЦАМ отмерены неправильно. Цинковая чума начинается с характерных вздутий на поверхности металла.

Затем микроструктурные изменения проникают в глубину металла, и он крошится.
Прямая аналогия таких повреждений с оловянной чумой не доказана, хотя, по данным частных экспериментов, прочность металлических моделей после замораживания действительно падает в разы. Согласно другой версии (изложенной здесь, где показаны фотографии с последовательной деградацией модели), ЦАМ заболевает чумой, если в его составе оказывается хотя бы минимальное количество олова или свинца. Если бы эта версия подтвердилась, то означала бы, что оловянная чума заразна даже для цинка, являющегося переходным металлом.
Чаще цинковую чуму связывают с технологическим браком при производстве. Например, в сплаве может быть слишком велика доля алюминия, как в китайских моделях, либо в него могут попадать примеси никеля или сурьмы. То есть, такой сплав уже нельзя считать ЦАМ.
Пурпурная чума
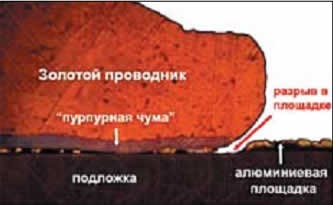
Опять же, эта болезнь устраняется достаточно легко: проводник нужно легировать, достаточно 1% платины или палладия.
Вместо заключения

Чтобы продлить жизнь этих скульптур, их пришлось искусственно покрывать очень тонким слоем закиси меди, имитирующей благородную патину. Возможно, она позволит продлить жизнь этим красавцам.
Вышеизложенный экскурс при всей пестроте приведенных примеров был подготовлен, чтобы продемонстрировать, насколько больно бывает учиться на ошибках. Я не симпатизирую Скотту, который при всей отваге и силе духа последовательно действовал как карьерист и увел с собой в могилу еще нескольких людей, при этом вдохновив своим примером целое поколение полярников. Но мне кажется очень странной гримасой судьбы, что смерть Скотта, напрасная с точки зрения географического подвижничества, могла настолько подстегнуть развитие металлургии и химии металлов, именно в силу своей нелепости и неизбежности.
Читайте также:

