Гелий сообщение по химии
Обновлено: 05.07.2024
Гелий — практически инертный химический элемент. Возглавляет группу изотопов: 4 He ( водорода). Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд. На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма. Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье
Содержание
История
Открытие гелия началось с 1868 года, когда при наблюдении солнечного затмения два астронома — француз 1871 году Локьер объяснил её происхождение присутствием на Солнце нового элемента. В 1895 году англичанин У. Рамзай выделил из природной радиоактивной руды Происхождение названия
Получение
В настоящее время гелий выделяют из природных гелийсодержащих газов, пользуясь методом глубокого охлаждения (гелий сжижается труднее всех остальных газов). Месторождения таких газов имеются в России, США, Канаде, Китае, Алжире, Польше и Катаре. Гелий содержится также в некоторых минералах (монаците, Свойства в газовой фазе
Гелий —— наименее химически активный элемент восьмой группы (инертные газы) таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или УФ излучения на смесь гелия газа и фтора (хлора)). При стандартных температуре и давлении гелий ведёт себя практически как идеальный газ. Фактически при всех условиях гелий моноатомный. Он обладает теплопроводностью большей, чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока. Гелий также менее растворим в воде, чем любой другой известный газ. Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода. Примерный диаметр молекулы He2 — 0,20 коэффициент Джоуля-Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля-Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры, гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи Свойства конденсированных фаз
Гелий используют для создания инертной и защитной атмосферы при дирижаблей и аэростатов, как компонент активной среды гелий-неоновых лазеров. Гелий-3 используется для наполнения газовых нейтронных детекторов, как рабочее тело гелиевых жидкость на Земле, — уникальный хладагент в экспериментальной физике, позволяющий использовать электрической сверхпроводимости). Благодаря тому, что гелий очень плохо растворим в крови, его используют как составную часть газовой смеси, подаваемой для дыхания азота воздуха на гелий предотвращает воздуха содержащийся в нём азот под повышенным давлением растворяется в крови, а при падении давления выделяется из неё в виде пузырьков, закупоривающих мелкие сосуды).
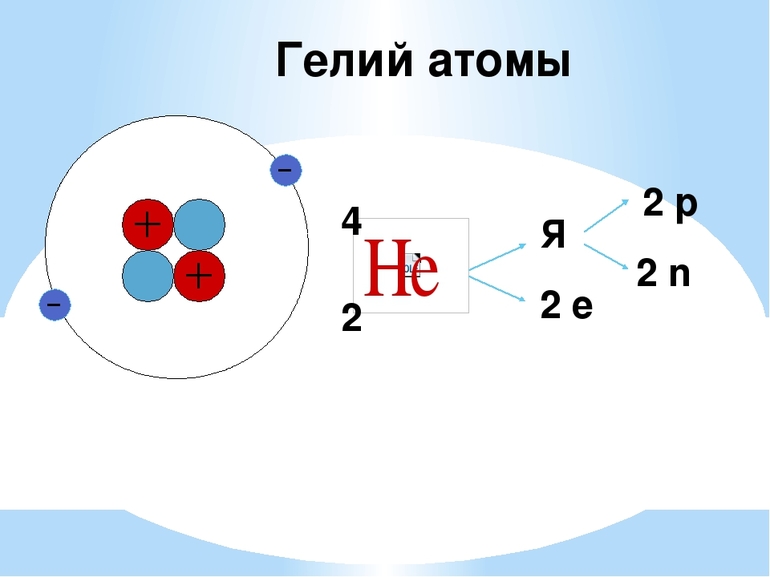
Гелий — второй порядковый элемент периодической системы химических элементов Д. И. Менделеева, с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической системы. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He ( Helium ). Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим элементом.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье Дистилляция).
История открытия Гелия

18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелено-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую Академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов.
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной строне медали были выбиты портреты Жансена и Локьера над скрещенными ветвями лавра, а на другой — изображение мифического бога Солнца Аполлона, правящего в колеснице четверкой коней, скачущей во весь опор
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента.
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а еще через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере.
Еще до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд, однако он ошибочно полагал, что получил азот и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. Но только значительно позже, в 1906 году, Резерфорд и Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия. Эти исследования положили начало современной теории строения атома.


Только в 1908 году нидерландскому физику Хейке Камерлинг-Оннесу удалось получить жидкий гелий дросселированием (Эффект Джоуля — Томсона), после того как как газ был предварительно охлажден в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий еще долго оставались безуспешными даже при температуре в 0,71 K, которых достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. Лишь в 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, ему удалось выделить кристаллы.
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения. Вот что он писал в одном из своих докладов про открытие этого явления:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим. …
… Если вязкость воды равняется 10 −2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе . Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде — это ядра гелия-4). Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восьмой группы гелий по содержанию в земной коре занимает второе место (после аргона).
Содержание гелия в атмосфере (образуется в результате распада Ac, Th, U) — 5,27·10 −4 % по объёму, 7,24·10 −5 % по массе. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5·10 14 м³. Гелионосные природные газы содержат как правило до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8 — 16 %.
Среднее содержание гелия в земном веществе — 3 г/т. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8 — 3,5 л/кг, а в торианите оно достигает 10,5 л/кг.
Определение Гелия
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.).
Физические свойства Гелия
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4 He) наименьшая среди всех простых веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Свойства в газовой фазе


При нормальных условиях гелий ведёт себя практически как идеальный газ. Фактически при всех условиях гелий моноатомный. Плотность 0,17847 кг/м³. Он обладает теплопроводностью (0,1437 Вт/(м·К) при н.у.) большей, чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж/(кг·К) при н.у., для сравнения — 14,23 кДж/(кг·К) для Н2).


При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра, важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с большей энергией, в результате чего и происходит смещение спектральных линий от инфракрасного к ультрафиолетовому краю.
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 (15 °C), 3,2 (25 °C). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля-Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля-Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
Химические свойства Гелия
Гелий — наименее химически активный элемент восьмой группы (Инертные газы) таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или УФ излучения на смесь гелия газа и фтора (хлора)).
Известно химическое соединение гелия LiHe. (возможно, имелось ввиду соединение LiHe7)
Изотопы Гелия
Природный гелий состоит из двух стабильных изотопов: 4 He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3 He (0,00014 %; содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Получение Гелия
Промышленность — химический элемент гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий очищая его CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Сырой гелий (70-90 % по объёму гелий) очищают от водорода (4-5 %) с помощью CuO при 650—800 К. Окончательная очистка достигается охлаждением сырого гелий кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
По производству гелия лидируют следующие страны мира: США (140 млн м³ в год), затем — Алжир (16 млн м³). Россия занимает третье место в мире — 6 млн м³ в год. Мировые запасы гелия составляют 45,6 млрд м³. Крупные месторождения находятся в США(45 % от мировых ресурсов), далее идут Россия (32 %), Алжир (7 %), Канада (7 %) и Китай (4 %).
Транспортировка гелия
Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды типа СТГ-10, СТГ-25 и СТГ-40 светло-серого цвета объёмом 10, 25 и 40 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение гелия
Биологическая роль гелия
Гелий не играет никакой биологической роли.
Физиологическое действие
Интересные факты
В 2000 г. цены частных компаний на газообразный гелий находились в пределах 1,5 — 1,8 $/м³
В 2009 году цены на газообразный гелий находились в пределах 1.800-2.500 рублей за 6 м³ (40-литровый баллон) (Санкт-Петербург).
Дополнительная информация по гелию
Гелий-3 — лёгкий, нерадиоактивный изотоп гелия.
Эффект Померанчука — аномальный характер плавления (или затвердевания) лёгкого изотопа гелия 3 He
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Тем, кто интересуется химией, будет интересно узнать, что гелий — химический элемент восемнадцатой группы знаменитой таблицы Менделеева, возглавляющий группу инертных газов и идущий под вторым порядковым номером. В настоящее время это вещество получило широкую сферу применения, искусственно синтезируясь из природного газа, содержащегося в земных недрах.

Основная информация об элементе
Уникальное в своем роде вещество считается одним из самых распространенных во всей Вселенной, уступая пальму первенства в своем объеме только водороду, ведь его доля составляет около 23 процентов от общей массы этого безграничного пространства. Близкие к рекордным показатели демонстрируют и другие физические свойства гелия, которые стоит рассмотреть более подробно.
Физические особенности
Химический элемент относят к практически полностью инертным газам, он не является токсичным и не имеет вкуса и запаха. Одиночное строение атома гелия остается таковым при любых условиях, чего не скажешь о других его характеристиках, зависящих от атмосферного давления, температурного режима и многих других параметров. Самый легкий идеальный газ после водорода, гелий обладает следующими физическими свойствами:
- Молярная масса атома газа составляет 4,002601 грамма на моль. Что касается молярного объема, то этот показатель равен 31,81 сантиметра кубических на моль, тогда как молярная теплоемкость составляет 20,79 Дж/Кмоль.
- Плотность вещества напрямую зависит от температурного режима, соответствуя 0,147 грамма на сантиметр кубический при падении столбика термометра ниже отметки в минус 270 градусов Цельсия и 0,000117846 градуса при нагревании до плюс 20 градусов и выше.
- Температура кипения у гелия является наиболее низкой, если сравнивать его с любым другим химическим элементом. Так, вещество имеет свойство закипать при температуре, равной 4,2152 Кельвина, что эквивалентно минус 268,94 градуса Цельсия.
- Температурный режим плавления соответствует 0,95 Кельвина или минус 272,2 градуса Цельсия при давлении, равном 2,5 МПа. При этом удельная теплота плавления составляет 0,0138 килоДжоуля на моль при удельной теплоте испарения 0, 0829 кДж/моль.
- Получение вещества в твердом виде становится возможным только при атмосферном давлении выше 25 атмосфер, тогда как при любых других показателях (даже нулевых) он не переходит в эту фазу.
- Гелий, найденный в природных условиях, всегда состоит из двух изотопов стабильного типа, один из которых имеет высокий процент распространения, близком к сотне, тогда как другой встречается гораздо реже, причем в совершенно разных естественных источниках (до 0,00014%). Помимо прочего, науке известны еще как минимум 6 радиоактивных гелиевых изотопов искусственного происхождения.
Стоит отметить, что для качественного определения вещества сегодня используется анализ эмиссионного спектра излучения, тогда как для количества применимым остается хроматографическое и масс-спектрометрическое тестирование. Кроме того, актуальными являются простейшие методы идентификации, подразумевающие измерение таких основных параметров, как плотность, молярная масса и теплопроводность.
Гелий в своем газообразном состоянии очень тяжело растворяется в воде (гораздо сложнее, чем любой другой газ). Так, в литре воды, температура которой составляет 20 градусов Цельсия, объем растворимого газа составляет не более 8,8 миллилитра из 100. Еще худшую растворимость можно наблюдать в этиловом спирте, так как ее показатель не превышает 2,8 мл/л при 15-градусной температуре и 3,2 мл при нагревании этанола до 25 градусов Цельсия.
А вот скорость диффузии гелия превышает актуальный для воздуха показатель в три раза, опережая даже водород, у которого коэффициент проникаемости ниже на 65%. Абсолютным рекордсменом гелий является и по коэффициенту преломления, максимально приближаясь к единице. Эффект Джоуля — Томсона у гелия имеет отрицательное значение в нормальной среде из-за его слишком быстрого охлаждения.
Что касается остывания в процессе дросселирования, то оно становится возможным только при 40 К и нормальном атмосферном давлении. Если же температура продолжит опускаться, то становится возможным переход гелия из газообразного в жидкое состояние, но только при условии применения охлаждения расширительного типа, обеспечить которое реально только с помощью специального преобразователя относительной потенциальной энергии в механическую.
Химические свойства

- Величина ковалентного радиуса равна 28 пм при радиусе иона, соответствующем 93 пм.
- Уровень электроотрицательности по шкале Полинга соответствует 4,5 баллам.
- Электродный потенциал, как степени окисления, а следовательно, и валентность элемента имеют нулевые значения.
- Энергия ионизации первого электрона равна 2361,3 кДж/моль.
- Показатель теплопроводности элемента соответствует 300 К.
- Молекулярная ионная энергия равна 58 ккал/моль.
- Равновесное расстояние между ядрами химически связанных элементов соответствует 1,09 А.
Что касается соединений вещества, то сегодня известной является его связь LiHe. Сам элемент имеет свойство образовывать двухатомные молекулы фторида и хлорида, обозначение первого из которых HeF, а второго HeCl, притом что их получение становится возможным только при воздействии электрического разряда или УФ-излучения на смесь описываемого элемента с фтором или хлором, соответственно.
Совершенно другими свойствами обладает гелий в газообразном состоянии. Не последнюю роль в этом вопросе играет воздействие на газ различного рода физических и химических процессов. К примеру, если пропустить ток через трубочку с гелием, то можно наблюдать его радужное свечение, сила которого будет зависеть от создаваемого давления в закрытом пространстве. Если же не прибегать к подобным приемам, то останется один только желтый спектр, считающийся привычным для гелия в его нормальном состоянии.
Ввиду содержания в веществе нескольких линий спектра по мере уменьшения атмосферного давления происходит изменение его цветового излучения, которое начинает меняться от желтого к оранжевому, розовому и зеленому. Всего же учеными принято выделять два основных спектра — единичный и триплетный, первый из которых свойственен атомам в их нормальном состоянии. Что касается перехода в триплетное состояние, то он становится возможным только при использовании разряда в 19,77 эВ.

Вывести атом из его привычного состояния можно и другими методами воздействия, один из которых заключается в искусственно созданном столкновении с другими атомами вещества с последовательной передачей энергии между ними. А вот обратный переход из триплетного состояния в синглетное естественным путем практически невозможен. Такое состояние называется метастабильным и для того, чтобы перевести газ в стандартное положение вновь, приходится прибегать к различным методам внешнего воздействия.
Интересные факты о гелии
Немного истории
Сегодня уже мало кто вспомнит, что открытие элемента произошло еще 18 августа 1868 года, когда известный французский ученый решил исследовать солнечную хромосферу в момент полного затмения звезды в одном из индийских городов. Примечательно, что всего лишь через 3 месяца такое же открытие было сделано в Англии, правда, тогда о его неактуальности еще никто не знал, ввиду более сложной корреспонденции научных данных.
В 1881 году итальянский вулканолог Луиджи Пальмери, исследовавший Везувий, также идентифицировал это вещество, поспешив сообщить о своей находке общественности. Но самое важное событие в области открытия гелия произошло 27 годами позже, когда он был впервые выявлен в недрах планеты. Тогда газ удалось добыть из такого распространенного минерала, как клевеит, и со временем именно он использовался учеными для того, чтобы установить величину его удельного веса и других физических параметров.

Со временем исследователи научились получать гелий в жидком виде, для чего впервые довелось применить процедуру дросселирования. В отличие от этого попытки добывать твердый гелий долгое время не увенчивались успехом. Ситуация изменилась только в 1926 году, когда вдобавок к охлаждению было применено и критическое понижение атмосферного давления до 35 атм, в результате чего удалось выделить кристаллическую решетку вещества.
Получение и применение
Удивительно, но, несмотря на свое внушительное распространение во всей Вселенной, гелий довольно редко встречается на Земле. Разной является и природа образования этого элемента на Земле и в космосе, так как в первом случае его выделение происходит за счет распада альфа-частиц тяжелых элементов. В итоге часть вещества проходит через земные породы, сливаясь с природным газом и демонстрируя концентрацию от 7 процентов от общего объема и выше.
В настоящее время месторождения, в которых наблюдаются большие залежи гелия, имеются на территории таких стран, как Индия, Бразилия, Россия и Танзания. Естественно, речь идет о гелийсодержащих газах, которые используются в промышленности для выведения чистого элемента или его производных. Для этого применяется процедура охлаждения посредством дросселирования, и в этом случае сложность разжижения элемента в значительной мере облегчает процесс.
На выходе удается получить смесь, состоящую не только из гелия, но и из водорода и неона, после чего производится очистка. В итоге доля сырого гелия будет составлять около 70−90 процентов от общего объема. После финишной фильтрации продукт, который, как известно, не может гореть, а следовательно, и не представляет никакой угрозы, транспортируясь в металлических баллонах, изготовленных в соответствии с ГОСТ 949–73 . Если же стоит вопрос о перевозке сжиженного газа, то в ход идут специальные сосуды марки СТГ-10 и СТГ-25.

Что касается применения, то гелий используется в следующих сферах:
- Металлургия.
- Пищевая промышленность.
- Для изготовления хладагентов для различных агрегатов и рабочих установок.
- Для наполнения различных судов воздухоплавания и шариков.
- В дайвинге для приготовления дыхательных смесей, необходимых для погружения.
- В ракетных установках в качестве одной из составляющих теплоносителя.
- Для наполнения трубок газорезного типа.
- В сфере газовой хроматографии.
- Для поиска утечек в трубопроводах и всевозможных инфраструктурных установках.
Естественно, на этом применение элемента не заканчивается, ввиду чего производство гелия является очень развитым и востребованным в настоящее время.

Среди прочих преимуществ газа — его высокие перспективы в сфере термоядерной энергетики, благо, мировые запасы гелийсодержащих веществ не позволяют отнести его в разряд дефицитного.
Так, современные эксперты называют цифру в 45,6 миллиарда метров кубических, притом что объемы производства перевалили за 110 миллионов еще в 2003 году.
ГЕЛИЙ, He (helium), химический элемент из семейства благородных (инертных) газов He, Ne, Ar, Kr, Xe, Rn, составляющих VIIIA подгруппу в периодической системе элементов, или, как ее еще называют, нулевую группу.
История открытия.
Распространенность в природе.
Содержание гелия в мировом пространстве составляет 28% (второе место после водорода). Гелий – основной компонент звездной материи. В результате углеродного цикла (сложная цепь ядерных реакций), впервые изученного Х.Бете в 1939, водород в звездном веществе превращается в гелий, при этом происходит значительное выделение энергии (см. также ЯДЕРНЫЙ СИНТЕЗ). В земной атмосфере гелий составляет всего 0,0005% об., так как он чрезвычайно легок и слабо удерживается гравитационным полем земли. Гелий образуется при распаде тяжелых радиоактивных элементов, находящихся в расплавленном земном ядре, и медленно диффундирует через земную мантию. Тепловая энергия, выделяющаяся при ядерных процессах, поддерживает ядро земли в расплавленном состоянии. Природный метан, добываемый из скважин, содержит ок. 1,75% гелия и 0,5% CO2. После удаления CO2, глубокого охлаждения природного газа до –185 ° C и сжатия образуется жидкий метан, а в газовой фазе остаются гелий и азот. Метод глубокого охлаждения позволяет получать гелий чистотой 98% и выше.
Свойства.
Гелий имеет одну-единственную электронную оболочку, занятую двумя электронами, т.е. его оболочка полностью заполнена электронами, которые испытывают сильное притяжение ядра, а значит, очень устойчивы; поэтому гелий не вступает в химические реакции, не образует химические соединений и не имеет степеней окисления. Гелий – бесцветный одноатомный газ без запаха; он не вступает в реакции ни с одним химическим элементом, и его атомы не соединяются даже между собой. Наиболее распространенный изотоп 4 He содержит в ядре два протона и два нейтрона, поэтому его массовое число равно 4. Более редкий изотоп 3 He с одним нейтроном был открыт в 1939 Л.Альваресом и Р.Кернегом. Содержание 3 He составляет 10 –5 % гелия, находящегося в природном газе, добываемом из скважин. 3 He получается в ядерных реакциях при распаде трития ( 3 H-изотоп водорода). Гелий – необычное вещество, по свойствам он близок к состоянию идеального газа
СВОЙСТВА 4 He
Жидкий и твердый гелий.
Жидкий гелий обладает рядом уникальных свойств; он имеет самую низкую температуру кипения: 4 He кипит при 4,22 K, а 3 He – 3,19 K. Это свойство гелия используют для создания низких температур. Гелий – единственное вещество на земле, которое при нормальном давлении не кристаллизуется вблизи абсолютного нуля, что объясняется слабым межатомным взаимодействием и квантовыми свойствами. Жидкий гелий бесцветен, очень текуч и имеет очень низкое поверхностное натяжение. Изотопы гелия в жидком состоянии сильно различаются. Так, 4 He имеет две формы: при температурах выше 2,18 K существует 4 He, а ниже 2,18 K происходит необычный переход (фазовый переход второго рода) в 4 He-II. Если пустой стеклянный сосуд погрузить в 4 He-II, то жидкость будет медленно подниматься вверх по стенкам и перетекать внутрь до выравнивания уровней жидкости снаружи и внутри. Если сосуд приподнять, то процесс пойдет обратно до нового выравнивания уровней жидкостей. Это – пленочное движение; оно характерно только для 4 He-II. Другое аномальное свойство 4 He-II – способность жидкости перетекать из области более низких температур в область более высоких. 4 He-II обладает сверхтекучестью (явление сверхтекучести открыл П.Л.Капица в 1938) – свойством, известным только для жидкого гелия. Явление сверхтекучести объясняется на основе двухжидкостной модели. Согласно ей, 4 He-II состоит из двух полностью взаимопроникающих жидкостей – нормальной и сверхтекучей; последняя является идеальной жидкостью и не испытывает сопротивления при протекании через узкие капилляры. Согласно теории, в 4 He-II существуют необычные температурные волны (второй звук). Объяснение аномалий 4 He-II дается на основе представлений квантовой механики.
Растворы изотопов гелия также необычны. Ниже 0,9 K раствор спонтанно делится на две части, образуя раствор, обогащенный 3 He и текущий над раствором, обогащенным 4 He. 6% 3 He растворимы в 4 He, но 4 He не растворяется в 3 He при абсолютном нуле.
Твердый гелий можно получить сжатием 4 He до 25 атм или 3 He до 34 атм при низких температурах. Твердый гелий – кристаллическое прозрачное вещество, причем границу между твердым и жидким гелием трудно обнаружить, так как их рефракции близки.
Применение.
Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии. Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля. Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений. При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза. Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов. Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения. В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств. Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3 He и 4 He для создания и поддержания температур ниже 0,005 K.
Читайте также:

