Амины и окружающая среда сообщение
Обновлено: 06.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
АМИНЫ. МНОГООБРАЗИЕ И ЗНАЧЕНИЕ.
Органическая химия настойчиво вторгается в жизнь современного человека, и вторжение это имеет два направления. Первое – полимерные материалы, из которых изготавливаются тысячи различных видов изделий, применяемых в повседневной жизни, способствуют совершенствованию нашего быта. Но в то же время при их производстве выделяются многочисленные вредные отходы, загрязняющие окружающую среду. Второе направление – лекарственные препараты. Они помогают излечивать болезни. Но одновременно способствуют развитию новых модификаций болезнетворных микроорганизмов. Наркотики спасают людей от мучительных болей и создают почву для развития социальных бед и преступлений при использовании наркотических средств в не лечебных целях.
Современному человеку следует располагать знаниями о химии веществ, вводимых им в организм или функционирующих в организме, так же, как он знает жиро-белково-углеводный состав потребляемой пищи и состав воздуха, которым он дышит.
познакомить с многообразием производных аминов, их значением и применением в жизни человека,
развивать у учащихся умение выделять главное, сравнивать, сопоставлять, сообщать информацию о загрязнении окружающей среды аминами, а так же о действии их на организм человека.
Амины – производные аммиака, в молекулах которых один или несколько атомов водорода замещены на углеводородные радикалы.
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациональной номенклатуре их рассматривают как алкил или ариламины.
Различают первичные, вторичные и третичные амины:
СН3- NH 2 метиламин (первичный амин)
( CH 3 CH 2 ) 2 - NH диэтиламин (вторичный амин)
( CH 3 CH 2 ) 3 - N триметил амин (третичный амин)
фениламин (анилин). Молекулярная формула С6Н5- NH 2
животного происхождения растительного происхождения


Гистамин играет важную роль в развитии аллергических реакций. Продукты метаболизма аргинина и лизина – путресцин и кадаверин – являются ядами, ответственными за отравление испорченным мясом, и во многом определяют трупный запах.
Триметиламин, обуславливающий характерный запах рыбы, содержится в селедочном рассоле.
Природные амины растительного происхождения – алкалоиды
( щелочеподобные; от лат alkali – щелочь), широко распространены в природе, обычно обладают высокой физиологической активностью, часто являются сильными ядами. Это азотсодержащие вещества основного характера. Рассмотрит некоторых представителей групп алкалоидов.
Кониин содержится наряду с другими родственными алкалоидами в болиголове, от сока которого, по легенде, умер приговоренный к смерти Сократ.
Кониин является сильным ядом, вызывая паралич центральной нервной системы, мышц, двигательных нервов, дыхательного центра.
Никотин выделен в качестве главного алкалоида из табака. Никотин крайне токсичен, его смертельная доза для человека – около 40 мг. В малых дозах никотин возбуждает вегетативные нервные окончания, а затем блокирует их, стимулирует деятельность желез, повышает кровяное давление. Никотин является мутагеном (вызывает генетические мутации) и тератогеном (нарушитель развития плода) для некоторых низших животных. Табачный дым содержит и другие алкалоиды табака, а также канцерогенные вещества. Поэтому среди курящих высок процент больных раком легких.
Кокаин выделяют из листьев кустарника (Перу, Боливия, Колумбия). Индейцы Южной Америки еще в древности использовали листья coca в качестве стимулирующего и возбуждающего средства.

В медицине применяется как одно из сильнейших местноанестезирующих (обезболивающих) средств. Однако кокаин является сильным наркотиком, вызывающим быстрое привыкание и зависимость организма. В больших дозах кокаин токсичен, вызывает паралич ЦНС.
Примеры других представителей:


Диамины – амины, содержащие две аминогруппы в молекуле.
Физические свойства аминов
Первые представители ряда аминов – метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 – при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С – кристаллическими веществами.
Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам).
Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха.
СТРОЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ
ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ АМИНОВ
I . Лекарственные, физиологически активные вещества.
Примеры многочисленных лекарственных веществ, получаемых с применением аминов – новокаин, спазмолитин, парацетамол, сульфаниламидные препараты. Широкое применение нашли соединения с упрощенной адреналиновой структурой, такие, как эфедрин (алкалоид), амфетамин, первитин и др.
Эти соединения, обладая структурой, близкой к структуре адреналина, вступают с ним в конкуренцию и благодаря схожему механизму действия оказывают стимулирующее, возбуждающее действие, но более сильное и продолжительное, по своему характеру наркотическое и допинговое.
II . Химические добавки к полимерам.
Амины нашли широкое применение в качестве термо- и светостабилизаторов, антирадов (вещества, повышающие стойкость к ионизирующему облучению) полимерных материалов, особенно каучуков, резин, полиамидов.
N -фенил- β -нафтиламин (неозон Д)
Эффективными модификаторами резин, вулканизирующими агентами служат дифенам 4Н и малеимид Ф.
Хорошими стабилизаторами по отношению к различным воздействиям зарекомендовали себя аминофенолы, например:
4- [3,5-ди(-трет-бутил)-4-гидроксифенил] –бутилметиламин где Х – трет-бутил
III . Красители и пигменты.
Красители являются важнейшей областью практического применения ароматических аминов. Огромное разнообразие используемых на практике красителей связано с вариацией цвета, растворимости, устойчивости по отношению к различным воздействиям, реагировать с поверхностью окрашиваемого материала и т.д.
Первый азокраситель – п-аминоазобензол (анилиновый желтый) (П.Грисс, 1859 г,) был недостаточно стоек и не нашел широкого применения. Один из известных азокрасителей конго красный хорошо красит хлопковые волокна за счет – HN 2 и – SO 3 Na групп, реагирующих с –ОН группами целлюлозы (водородные связи), и является в настоящее время одним из широко применяемых азокрасителей, которые получают из бензидина (диазосоставляющая) и нафтионовой кислоты (азосоставляющая):

Окраска некоторых азокрасителей зависит от рН среды, то есть они являются индикаторами, например, метиловый оранжевый:

Прочность красителя к стирке и свету сильно увеличивается при образовании ими прочных комплексов с металлами. Такие красители называют протравными. Примерами являются кислотный хромовый желтый, алмазный флавин G .
Из ди- и триарилметановых красителей практически значимы аурамин, основной краситель шерсти, шелка, хлопка, кожи, бумаги:


образующий в воде и этаноле темно-красные растворы и используемый для крашения бумаги, кожи и др., фуксинсернистая кислота – реагент на альдегидную группу:
IV . Фотореактивы.
Аминофенолы и дмамины являются сильными восстановителями, поэтому они применяются как проявители – например, в черно-белой фотографии параамидофенол, метол, амидол, в цветной фотографии – N , N -диэтил- n -фенилендиамин:

n -аминофенол n -( N -метиламино)- фенол(метол)
В процессе проявления N , N -диэтил- n -фенилендиамин превращается в красители желтого типа, сине-зеленого типа, фуксино-красного типа. Комбинации желтого, сине-зеленого и фуксино-красного красителей разных соотношений в каждом из трех фоточувствительных слоев в зависимости от интенсивности компонентов поглощаемого цвета позволяют осуществить необходимую цветопередачу. Изображение на цветной пленке получается только с помощью красителей. Проявленная и отфиксированная пленка, в отличие от черно-белой, не содержит серебра.
V . Экологическое послесловие
Производства, связанные с получением и применением аминов, относятся в основном к малотоннажным. Спецификой их многоэтапных, тонких, сложных, требующих высокой квалификации персонала технологий является необходимость использования и получения часто высокотоксичных соединений, например, фосгена, цианатов, сероуглерода, тяжелых металлов и т.д. Другой особенностью таких производств являются многокомпонентные токсичные, экологически опасные сточные воды и выбросы в атмосферу.
Внедрение новых, более безопасных технологий, например, отказ от традиционных восстановителей типа сульфидов аммония, натрия, гидросульфида натрия, ди-, полисульфидов, металлов (железа, олова, цинка) в кислых средах и переход к каталитическому гидрированию позволяет резко уменьшить вредные выбросы и стоки.
Кардинальным решением является полный отказ от производства ядовитых, вредных для здоровья химических продуктов в случаях, когда это возможно. Необходимо помнить о том, что многие нитро- и нитрозосоединения, ароматические амины, почти все азокрасители обладают канцерогенными свойствами. Например, запрещены к применению в пищевых продуктах n -диметиааминоазобензол, до 70-х годов использовавшихся для подкрашивания сливочного масла, и амарант, которым окрашивали пищевые продукты, косметические средства, лекарственные препараты:
n -диметиааминоазобензол (масляный желтый):
Есть необходимость постановки вопроса о полном запрещении применения азокрасителей в пищевых продуктах, косметических средствах, лекарственных препаратах, ужесточении процедур их сертификации.
Хотя среди технических красителей продукты анилино-красочной промышленности являются одними из наиболее широко распространенных, необходимо иметь в виду эколого-гигиенические аспекты их применения.
Реактивы и оборудование: таблицы “Строение аммиака” и “Строение аминов”, шаростержневые модели молекул аммиака и метильной группы, селедочный рассол 30-40%, раствор NaOH, концентрированная соляная кислота, фенолфталеин, колба Вюрца.
Ход урока.
Учитель. Назовите, какие классы органических веществ вам известны.
Учитель. В органической химии имеются вещества, содержащие в своем составе азот. Эти соединения играют чрезвычайно важную роль в нашей жизни. (Например белки). Большой вклад в изучение и получение азотосодержащих органических соединений внесли русские ученые А.Я. Данилевский и Н.Н. Зинин.
Ученики называют азотосодержащие соединения и записывают их формулы. Анализируя их строение, они приходят к выводу, что некоторые соединения содержат нитрогруппу, связанную непосредственно с углеводородным радикалом – это нитросоединения.
А нитроглицерин – это сложный эфир, так как нитрогруппы связаны с радикалом через атомы кислорода.
Учитель. Известны и другие соединения, содержащие азот. Важнейшие из них – амины, аминокислоты, белки.
Амины можно представить как производные аммиака, в молекулах которого один или несколько атомов водорода заменены на углеводородные радикалы
На доске написать структурные формулы аммиака и аминов. Ученики видят общее между аммиаком и аминами.
Вещества называют по тем радикалам, которые входят в состав молекулы, с прибавлением слова “амин”.
Ученики работают по таблице, называют вещества.
Учитель. Амины делятся на:
Рассмотрим физические и химические свойства аминов. Амины образуются при гниении рыбы, могут содержаться в селедочном рассоле
Низшие амины – газы, имеющие запах аммиака, средние - жидкости, а высшие – твердые вещества. С увеличением относительной молекулярной массы увеличиваются плотность и температура кипения аминов, а растворимость их в воде уменьшается.
Низшие амины из-за их запаха долгое время принимали за аммиак, пока в 1849 г. Ш. Вюрц не выяснил, что в отличие от аммиака они горят на воздухе с образованием углекислого газа:
Итак, запах и растворимость в воде первых членов гомологического ряда, указывают на сходство аммиака и аминов.
Если CH3 – NH2 растворить в воде и добавить лакмус, то среда будет щелочной.
Опыт №1. В колбу Вюрца наливаю 20 мл. селедочного рассола, прибавляю 7 мл. 40%-раствора NaOH и смесь нагреваю. Образующиеся газы отводим в проборку с водой, затем прибавляем 2-3 капли фенолфталеина. Раствор окрашивается в малиновый цвет.
Опыт №2. К отводной трубке с выделяющимися газообразными аминами подносят стеклянную палочку, смоченную концентрированной HCl. Образуется белый дым состоящий мельчайших кристаллов – солей аминов.
На доске параллельно ученик записывает уравнение реакций, характеризующих химические свойства аммиака.
и учитель записывает уравнение реакций с аминами. Напоминает, что у атома азота из пяти валентных электронов три неспаренных идут на образование ковалентных связей с атомами водорода, образуя молекулу аммиака, а два спаренных электрона остаются свободными. За счет них у атома азота образуется ковалентная связь с ионом водорода воды или кислоты
В первом случае освобождаются ионы гидроксила, которые определяют свойства оснований, вязь образуется по донорно-акцепторному механизму, Азот (донор) представляет протону (акцептору) в общее пользование свою пару электронов. Молекула аммиака превращается в катион аммония, и амин превращается в ион.
Учитель. Амины – производные алканов – боле сильные основания, чем аммиак. Они отличаются от аммиака только углеводородными радикалами, которые, очевидно, оказывают влияние на атом азота.
Радикал отталкивает электронную плотность, следовательно электронная плотность на атоме азота а амине больше, чем в молекуле аммиака. Значит, амин сильнее притягивает к себе протоны воды и кислот, то есть является более сильным основанием.
Вопрос. У диметиламина и триметиламина усиление или ослабление основвных свойств ожидаются?
Ученики. Усиление основных свойств по сравнению с метиламином.
Учитель. У диметиламина – да, а у триметиламина среда слабощелочная. Три радикала мешают свободному присоединению ионов водорода, в раствор поступает не так много ионов гидроксила.
Главный вывод: С позиций протолитической теории основания обладают свойством присоединять протон, поэтому аммиак и амины – основания, причем амины более сильные основания.
Применение аминов и загрязнение окружающей среды.
1-ый ученик. Амины и окружающая среда.
а) предприятия, которые используют или производят эти соединения;
б) крупные животноводческие комплексы и птицефабрики;
в) автотранспорт (выхлопные газы);
г) бытовое загрязнение (при пользовании газом, стирке белья,
приготовлении пищи и т.д.);
2-ой ученик. Рассказывает о действии аминов на организм человека.
В заключение предлагаю следующие вопросы для закрепления:
1. Какие из приведенных веществ относятся к аминам?
2. Напишите уравнение реакций этиламина:
б) с бромоводородной кислотой.
Дайте названия продуктам реакций.
Домашнее задание.
- Определите формулу вторичного амина, массовые доли атомных углерода, водорода и азота, в котором соответственно равны 61,0, 15,3 и 23,7%.
- Какой объем кислорода (н.у.) потребуется для полного окисления 10 мол метиламина, массовая доля примесей в котором составляет 5%.
1. А.Ю. Стахеев “Вся химия в таблицах”. Пособие для абитуриентов и учителей. “Мирос источник” г.Москва, 1995 г.
2. О.С. Табриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин “Химия” 10 класс. Учебник “Дрофа” г. Москва, 2000 г.
3. Г.П. Хомченко, И.Г. Хомченко “Сборник задач по химии”. Пособие для поступающих в ВУЗы. “Новая волна” г.Москва, 1996 г.
4. “Химия в школе”,1995, №3
5. Л.А. Цветков “Эксперимент по органической химии в средней школе”. “Просвещение” 1966г.
6. Н.Н. Чертков, А.С. Корошенко, А.А. Цветков и др. “Обучение органической химии в 11 классе”. Книга для учителя . “Просвещение” 1992 г.
Календарь
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
| « Фев | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 |
| 28 | 29 | 30 | 31 | |||
Рубрики
-
(102) (40) (5) (323)
-
(10) (13) (9) (9) (13) (2) (34) (14) (17) (12) (5) (14) (8) (4) (11) (5) (16) (14) (3) (7) (4) (10) (3) (7) (1) (6) (8) (15) (3) (9) (8) (9) (3) (3) (9)
-
(4)
-
(15) (21) (31)
Амины
Амины – органические вещества, производные аммиака (NH3), в молекулах которых один два или три атома атомов водорода замещены на углеводородные радикалы.
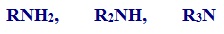
Функциональная группа аминов: -NH2 – аминогруппа.
Простейший представитель – метиламин Н3С-NH2.
Нахождение аминов в природе
В свободном состоянии простые амины редко встречаются в природе. Амины образуются при гниении органических остатков, содержащих белки под действием бактерий. Например, путресцин и кадаверин.
Запах селедочного рассола обусловлен триметиламином.
Ряд аминов образуются в организмах растений и животных в результате биохимического распада аминокислот под действием ферментов (биогенные амины). Такие амины обладают высокой биологической активностью.
Природные амины животного происхождения— адреналин, норадреналин, серотонин, мелатонин, гистамин, тирамин — участвуют в регуляции центральной нервной, пищеварительной, эндокринной, сердечно-сосудистой и других систем.
Адреналин оказывает стимулирующее воздействие на ЦНС. Он повышает уровень бодрствования, энергию и активность, вызывает психическую мобилизацию.
Серотонин является химическим передатчиком импульсов между нервными клетками человеческого мозга и контролирует аппетит, сон, настроение и эмоции человека. При снижении уровня серотонина повышается чувствительность болевой системы организма.
Амины растительного происхождения – алкалоиды (морфин, кофеин, кокаин, стрихнин, хинин и никотин), характеризуются высокой физиологической активностью.
Многие из природных биологически активных аминов ядовиты. Так называемые, психоактивные амины найдены в мухоморе, спорынье, мимозе, дурмане, белене, чилибухе, тропических растениях. В малых дозах такие вещества вызывают различного вида галлюцинации, изменяют тонус сердечной мышцы и сосудов.
Вредное воздействие аминов
Некоторые амины являются очень токсичными веществами. Опасно как вдыхание их паров, так и контакт с кожей. Амины, например, анилин, способны всасываться через кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу.
Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенные дыхание и сердцебиение, потеря сознания.
В случае попадания амина на незащищённые участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ватой, смоченной в спирте. В случае отравления парами аминов вывести пострадавшего на свежий воздух и обратиться к врачу.
Алифатические амины поражают нервную систему, вызывают нарушения проницаемости стенок кровеносных сосудов и клеточных мембран, функций печени и развитие дистрофии. Некоторые ароматические амины - канцерогены, способные вызвать рак мочевого пузыря.
На сегодняшнем уроке мы с вами будем знакомиться с такими соединениями, как амины. Давайте рассмотрим, какие это соединения и что они собой представляют.
Аминами называют такой класс соединений, который представляет собой органические производные аммиака, где атомы водорода замещены органическими группами. В этом классе соединений один или несколько водородных атомов могут быть замещены на углеводородные радикалы.
Отличительным признаком этих соединений является присутствие такого фрагмента, как R–N Номенклатура аминов
Также в составлении названия, правила допускают брать за основу углеводород, который можно рассматривать, как замену аминогруппы. Здесь положение аминов принято указывать благодаря числовому индексу.
Давайте рассмотрим, как это будет выглядеть в записи:
![]()
Это читается, как 3-аминопентан. В нем числовые индексы, которые расположены вверху указывают порядок нумерации атомов С. В некоторых случаях для определенных аминов сохранились упрощенные названия:
С6Н5NH2 – анилин, хотя, если следовать правилам номенклатуры, то он называется фениламином.
Также в химии часто используют устоявшиеся названия, которые искажают правильные наименования. Так, например:
Н2NСН2СН2ОН – моноэтаноламин, хотя правильно будет называть 2-аминоэтанол;
(ОНСН2СН2)2NH – диэтаноламин, а если использовать правильное название, то это будет звучать, как:
Физические свойства аминов
А теперь давайте рассмотрим физические свойства аминов. Первыми представителями ряда аминов являются метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2. Весь этот ряд аминов являются газами, которые имеют запах аммиака.
Средние члены этого ряда, при увеличении количества атомов в R, превращаются в жидкости. А высшие амины, при увеличении длины цепи R до 10 атомов С кристаллизируются и превращаются в твердые вещества.
А также следует знать, что в высших аминах запах практически отсутствует.
Как мы уже говорили, что простейшие амины имеют резкий запах аммиака и хорошо растворяются в воде. К более сложным аминам относится жидкость, которая имеет запах рыбы.
А вот высшие амины являются твердыми веществами, которые совсем не растворяются в воде и запаха они практически не имеют. Растворимость аминов идет на убыль при увеличении длины цепи и возрастании количества органических групп. То есть, чем выше их молекулярная масса, тем хуже их растворимость в воде.
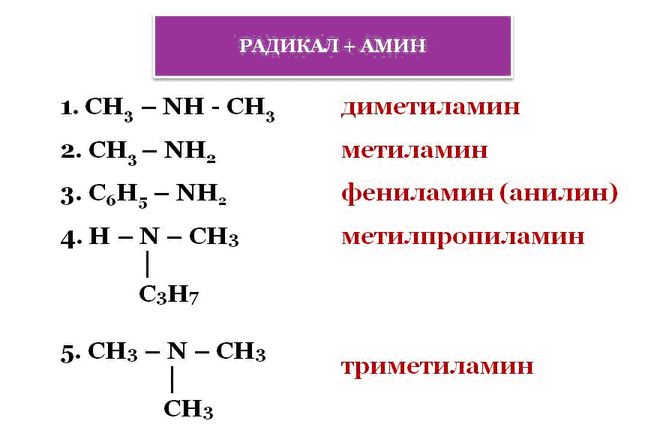
Химические свойства аминов
А теперь приступим к рассмотрению химических свойств аминов:
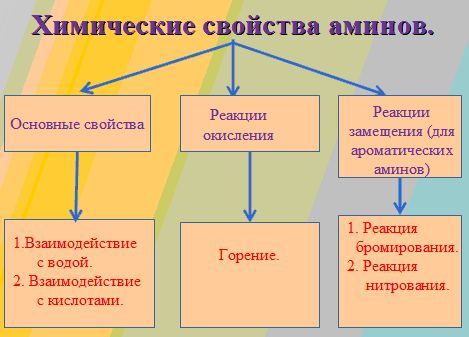
Как правило, общими свойствами органических соединения является их способность к горению. Если сравнивать способность горения аммиака с аминами, то первый горит, но его сложно поджечь. А вот амины имеют свойство легко загораться, и при горении их пламя чаще всего бывает бесцветным.
Нахождение аминов в природе
Соединения аминов широко распространены как в растительном, так и в животном мире, а также являются такими биологически активными веществами, как витамины, гормоны, промежуточные продукты обмена веществ.
Из-за этого неприятного запаха низшие амины часто путали с аммиаком. Но французский химик Шарль Вюрц в 1849 году обратил внимание на различие между аминами и аммиаком. Оказывается, вся разница в том, что амины обладают способностью к горению на воздухе и при этом образуют углекислый газ.
Применение аминов
Ну а теперь давайте узнаем, где применяются амины? Оказывается, амины нашли широкое применение при изготовлении лекарственных веществ, производстве различных красителей, взрывчатых веществ, а также продуктов, применяемых в органическом синтезе.
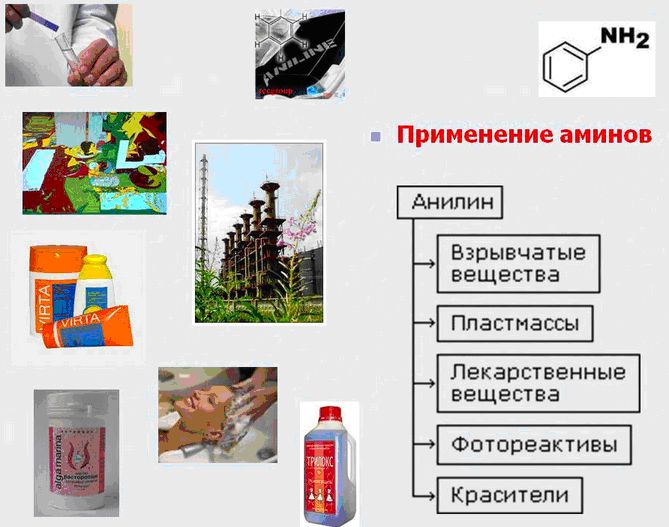
Вредное воздействие
Но также, следует знать, что амины – это вещества, которые довольно таки токсичны. Они представляют опасность при вдыхании их паров, а также при контакте с кожным покровом. А такие амины, как, например, анилин, обладает способностью проникновения через кожу в кровь и может нарушить функции гемоглобина, и тем самым привести к летальному исходу.
При попадании аминов в кровь появляются такие симптомы, как одышка, посинение губ, носа и кончиков пальцев. Также при отравлении наблюдается учащенное дыхание и сердцебиение. А в некоторых случаях может дойти и до потери сознания.
В случае отравления или попадания амина на незащищенные участки кожи, необходимо как можно быстрее, очистить пораженный участок кожного покрова с помощью спирта и ваты. Но это следует делать очень аккуратно, стараясь не увеличивать пораженные участки кожи. В случае отравления парами аминов, следует сразу же пострадавшему обеспечить доступ к свежему воздуху и вызвать врача.
При отравлении алифатическими аминами может произойти нарушение функций печени, поражение нервной системы и проницаемости кровеносных сосудов.
Вдыхание ароматических аминов может привести к угнетению центральной нервной системы, а также вызвать рак мочевого пузыря.
Практическое задание
Давайте с вами проведем небольшой опыт. Для этого мы берем и наливаем в пробирку 0,5 мл анилина. Теперь возьмем и взболтаем содержимое.
Вопрос: Какую реакцию вы наблюдаете?
А сейчас давайте в эту же пробирку добавим соляную кислоту и понаблюдаем до полного растворения анилина в воде.
А теперь подумайте и ответьте на вопросы:
1. Как вы думаете, почему происходит растворение анилина, после того, как мы добавили соляную кислоту?
2. Запишите эту реакцию в виде уравнения.
3. Попробуйте рассчитать массу вещества, которое образовалось.
4. Решите данную задачу.
Ответьте на вопросы:
1. Назовите известные вам классы органических веществ.
2. Какие азотосодержащие соединения вам известны? Назовите их и запишите их формулы.
3. Как использование аминов на предприятиях влияет на окружающую среду?
4. В чем различие между аммиаком и аминами?
5. Назовите сходные свойства аммиака и аминов.
Читайте также:

