Сочинение по химии про йод
Обновлено: 30.06.2024
Йод как химический элемент VII группы периодической системы Менделеева. Распространение в природе, физические и химические свойства йода. Болезни, связанные с недостатком йода в организме человека. Главные особенности применения радиоактивного йода.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 26.03.2011 |
| Размер файла | 68,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Федеральное агентство по образованию
Нижнекамский химико-технологический институт (филиал) государственного образовательного учреждения высшего профессионального образования
Открытие йода
Йод - химический элемент VII группы периодической системы Менделеева. Атомный номер - 53. Относительная атомная масса 126,90450,0001. Галоген. Из имеющихся в природе галогенов - самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный йод состоит из атомов одного - единственного изотопа с массовым числом 127 , его содержание в земной коре 4. 10 5 % по массе. Радиоактивный йод - 125 образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов йода важнейшие - йод -131 и йод -133 : их в основном используют в медицине.
I2 - галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо - в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей - йодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
Конец XVII и начало XVIII века были отмечены в Европе непрекращающимися войнами. Требовалось много пороха и, следовательно, много селитры. Производство селитры приняло невиданные масштабы, наряду с обыкновенным растительным сырьём в дело шли и морские водоросли. В них и обнаружили новый химический элемент.
Одним из французских селитроваров был химик и промышленник Бернар Куртуа (1777-1838), он был весьма наблюдательным человеком. Считается, что именно это помогло ему в 1811 г. стать первооткрывателем нового химического элемента йода. Однажды он заметил, что медный котёл, в котором выпаривался щелок, полученный из фукуса, ламинарий и других бурых водорослей, быстро разрушается, как будто его разъедает какая - то кислота. Куртуа решил выяснить, в чём тут дело. Осадив и удалив из раствора соли натрия, он выпарил раствор, обнаружил в котле сульфид калия и чтобы разложить его, прилил к осадку концентрированной серной кислоты - и тут появился фиолетовый дым. Куртуа повторил опыт, на этот раз в реторте, и в приёмнике реторты осели блестящие чёрные пластинчатые кристаллы.
Йодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет йод I2; одновременно образуется сернистый газ - диоксид серы SO2 и воду:
Распространение в природе
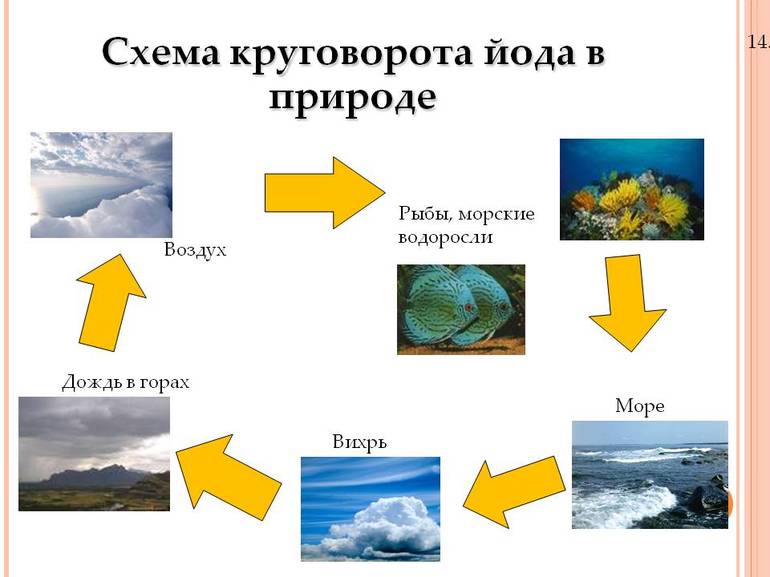
Среднее содержание йода в земной коре 4*10 -5 % по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах) соединения йода рассеяны; глубинные минералы йода неизвестны. История йода в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками). Известны 8 гипергенных минералов йода, образующихся в биосфере, однако они очень редки. Основным резервуаром йода для биосферы служит Мировой океан (в 1 литре в среднем содержится 5*10 -5 грамм йода). Из океана соединения йода, растворенные в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. Местности, удаленные от океана или отгороженные от морских ветров горами, обеднены йодом. Йод легко адсорбируется органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десорбция, часть соединений йода переходит в подземные воды. Так образуются используемые для добычи йода йодо-бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 литр этих вод содержит свыше 100 мг йода).
Адсорбция - связывание одного вещества на поверхности другого вещества, как правило, твёрдого тела.
Физические и химические свойства
Плотность йода 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °С. Молекула жидкого и газообразного йода состоит из двух атомов (I2). Заметная диссоциация I2 2I наблюдается выше 700 °С, а также при действии света. Уже при обычной температуре йод испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании йод возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки йода в лабораториях и в промышленности. Йод плохо растворим в воде (0,33 г/л при 25 °С), хорошо - в сероуглероде и органических растворителях (бензоле, спирте), а также в водных растворах йодидов.
Получение
Сырьем для промышленного получения йода в России служат нефтяные буровые воды (приложение 2); за рубежом - морские водоросли, а также маточные растворы чилийской (натриевой) селитры, содержащие до 0,4% йода в виде йодата натрия. Для извлечения йода из нефтяных вод (содержащих обычно 20 - 40 мг/л йода в виде йодидов) на них сначала действуют хлором или азотистой кислотой. Выделившийся йод либо адсорбируют активным углем, либо выдувают воздухом. На йод, адсорбированный углем, действуют едкой щелочью или сульфитом натрия. Из продуктов реакции свободный йод выделяют действием хлора или серной кислоты и окислителя, например дихромата калия. При выдувании воздухом йод поглощают смесью двуокиси серы с водяным паром и затем вытесняют йод хлором. Сырой кристаллический йод очищают возгонкой.
Йод в организме
Йод - необходимый для животных и человека микроэлемент. В почвах и растениях таёжно-лесной нечерноземной, сухостепной, пустынной и горных биогеохимических зон. Йод содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Са, Mn, Cu); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание йода в почвах около 3*10 -4 %, в растениях около 2*10 -5 %. В поверхностных питьевых водах йода мало (от 10 -7 до 10 -9 %). В приморских областях количество йода в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных - составляет 1 или даже 0,2 мкг.
Поглощение йода растениями зависит от содержания в почвах его соединений и от вида растений. Некоторые организмы (так называемые концентраторы йода, например морские водоросли - фукус, ламинария, филлофора, накапливают до 1% йода, некоторые губки - до 8,5% (в скелетном веществе спонгине). Водоросли, концентрирующие йод, используются для его промышленного получения. В животный организм йод поступает с пищей, водой, воздухом. Основной источник йода - растительные продукты и корма. Всасывание йода происходит в передних отделах тонкого кишечника. В организме человека накапливается от 20 до 50 мг йода, в том числе в мышцах около 10 - 25 мг, в щитовидной железе в норме 6 - 15 мг. С помощью радиоактивного йода (I 131 и I 125 ) показано, что в щитовидной железе йод накапливается в митохондриях эпителиальных клеток и входит в состав образующихся в них алл - и монойодтирозинов, которые конденсируются в гормон тетраиодтиронин (тироксин). Выделяется йод из организма преимущественно через почки (до 70 - 80%), молочные, слюнные и потовые железы, частично с жёлчью.
В различных биогеохимических провинциях содержание йода в суточном рационе колеблется (для человека от 20 до 240 мкг, для овцы от 20 до 400 мкг). Потребность животного в йоде зависит от его физиологического состояния, времени года, температуры, адаптации организма к содержанию йода в среде. Суточная потребность в йоде человека и животных - около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении). Введение в организм йода повышает основной обмен, усиливает окислительные процессы, тонизирует мышцы.
Йод и человек
Организм человека не только не нуждается в больших количествах йода, но и с удивительным постоянством сохраняет в крови постоянную концентрацию (10 -5 - 10 -6 %) йода, так называемое йодное зеркало крови. Из общего количества йода в организме около 25 мг, больше половины находится в щитовидной железе. Почти весь йод, содержащийся в этой железе, входит в состав различных производных тирозина - гормона щитовидной железы, и только незначительная часть его около 1%, находится в виде неорганического йода I 1-.
Большие дозы элементного йода опасны: доза 2 - 3 г смертельна. В то же время в форме йодида допускается приём внутрь в больших дозах.
Если ввести в организм с пищей значительное количество неорганических солей йода, концентрация его в крови повысится в 1000 раз, но уже спустя 24 часа йодное зеркало крови придёт в норму внутреннего обмена и практически не зависит от условий эксперимента.
В медицинской практике йодорганические соединения используется для рентгенодиагностики. Достаточно тяжелые ядра атомов йода рассасывают рентгеновские лучи. При введении внутрь организма такого диагностического средства получают исключительно чёткие рентгеновские снимки отдельных участков тканей и органов.
Болезни, связанные с недостатком йода
Еще в 1854 г. Француз Шатен - превосходный химик-аналитик обнаружил, что распространенность заболевания зобом находится в прямой зависимости от содержания йода в воздухе, почве, потребляемой людьми пище. Коллеги опротестовали выводы Шатена; более того, Французская академия наук признала их вредными. Что же касается происхождения болезни, то тогда считали, что её могут вызвать 42 причины - недостаток йода в этом перечне не фигурировал.
Недостаток йода в начале приводит лишь к небольшому увеличению щитовидной железы, но, прогрессируя, эта болезнь поражает многие системы организма. В результате нарушается обмен веществ, замедляется рост. В отдельных случаях эндемический зоб может привести к глухоте, кретинизму. Эта болезнь больше всего распространена в горных районах и в местах, сильно удаленных от моря.
Интересно отметить, что история лечебного применения йода уходит в глубь веков. Целебные свойства веществ, содержащих йод, были известны за 3 тыс. лет до того, как был открыт этот элемент. Китайский кодекс 1567 г. До н.э. рекомендует для лечения зоба морские водоросли.
Наиболее высокое содержание йода в водорослях:
- в сухой ламинарии - 26-180 мг на 100 г продукта
- в сухой морской капусте - 200-220 мг на 100 г продукта
В морской рыбе и продуктах моря содержание йода достигает 300-3000 мкг на 100г продукта.
Также источником йода для человека являются: мясо, молоко, яйца, овощи (приложение 1).
Йод в медицине
Антисептические свойства йода в хирургии первым использовал врач Буанэ. Как ни странно, самые простые лекарственные формы йода - водные и спиртовые растворы - очень долго не находили применения в хирургии, хотя ещё в 1865 - 1866 гг. великий русский хирург Н.И. Пирогов применял йодную настойку при лечении ран.
Препараты, содержащие йод, обладают антибактериальными и противогрибковыми свойствами, они оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приеме внутрь препараты йода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы. Малые дозы йода (микройод) тормозят функцию щитовидной железы, действуя на образование тиреотропного гормона передних долей гипофиза. Поскольку йод влияет на белковый и жировой (липидный) обмен, он нашел применение при лечении атеросклероза, так как снижает содержание холестерина в крови; повышает также фибринолитическую активность крови.
Для диагностических целей используют рентгеноконтрастные вещества, содержащие йод. При длительном применении препаратов йода и при повышенной чувствительности к ним возможно появление йодизма - насморк, крапивница, отек квинке, слезотечение, угревидная сыпь (йододерма). Препараты йода нельзя принимать при туберкулезе легких, беременности, при заболеваниях почек, хронической пйодермии, геморрагических диатезах, крапивнице.
Йод радиоактивный
Искусственно радиоактивные изотопы йода - I 125 , I 131 , I 132 и другие широко используются в биологии и, особенно в медицине для определения функционального состояния щитовидной железы и лечения ряда её заболеваний. Применение радиоактивного йода в диагностике связано со способностью йода избирательно накапливаться в щитовидной железе; использование в лечебных целях основано на способности - излучения радиоизотопов йода разрушать секреторные клетки железы. При загрязнениях окружающей среды продуктами ядерного деления радиоактивные изотопы йода быстро включаются в биологический круговорот, попадая, в конечном счете, в молоко и, следовательно, в организм человека.
Особенно опасно их проникновение в организм детей, щитовидная железа которых в 10 раз меньше, чем у взрослых людей и к тому же обладает большей радиочувствительностью. С целью уменьшения отложения радиоактивных изотопов йода в щитовидной железе рекомендуется применять препараты стабильного И. (по 100 - 200 мг на прием). Радиоактивный йод быстро и полностью всасывается в желудочно-кишечном тракте и избирательно откладывается в щитовидной железе. Его поглощение зависит от функционального состояния железы. Относительно высокие концентрации радиоизотопов йода обнаруживаются также в слюнных и молочной железах и слизистой желудочно-кишечного тракта. Не поглощенный щитовидной железой радиоактивный йод почти полностью и сравнительно быстро выделяется с мочой.
Применение йода
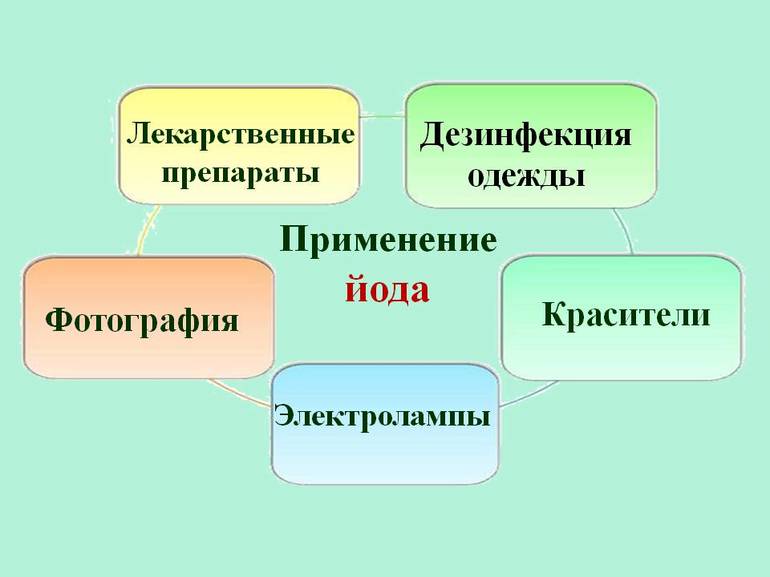
Йод и его соединения применяют главным образом в медицине и в аналитической химии, а также в органическом синтезе и фотографии. В промышленности применение йода пока незначительно по объему, но весьма перспективно. Так, на термическом разложении йодидов основано получение высокочистых металлов.
Сравнительно недавно йод стали использовать в производстве ламп накаливания, работающих по йодо - вольфрамовому циклу. Йод соединяется с частичками вольфрама, испарившегося со спирали лампы, образует соединение WI2, которое, попав на нагретую спираль, разлагается. Вольфрам при этом вновь возвращается на спираль, а йод опять соединяется с испарившемся вольфрамом. Йод как бы заботится о сохранении вольфрамовой спирали и тем самым значительно увеличивает время работы лампы.
Так же 0,6% йода, добавленного к углеводородным маслам, во много раз снижает трение в подшипниках из нержавеющей стали и титана. Это позволяет увеличить нагрузку на трущиеся детали белее, чем в 50 раз.
Йод применяют для изготовления специального поляроидного стекла. В стекло вводят кристаллы солей йода, которые распределяются строго закономерно. Колебания светового луча не могут проходить через них во всех направлениях. Получается своеобразный фильтр, называемый поляроидом, который отводит встречный слепящий поток света. Такое стекло используют в автомобилях. Комбинируя несколько поляроидов или вращая поляроидные стёкла, можно достигнуть исключительно красочных эффектов - это явление используют в кинотехники и в театре. Так же йод применяется в фотоделе. Современный способ фотографирования был изобретён англичанином У.Толботом. В основе его способа фотографии лежит фотохимическая реакция разложения галогенидов серебра под действием света:
Ag (Галл) + hг = Ag + (Галл),
Где hг - квант света.
йод физический свойство применение
Химический элемент - йод, открытый в 1811г Бернаром Куртуа, в наше время нашёл широкое применение в промышленности, технике и фотоделе. Но самое главное в медицине и не только как антисептическое средство, а как микроэлемент, который очень важен для поддержания здоровья щитовидной железы. Изучение свойств йода уже привело к появлению биологически активных добавок, которые содержат микроэлемент йод. И я надеюсь, что дальнейшее изучение йода приведёт к открытию новых возможностей применения этого элемента. И я думаю, что весь изложенный мною материал поможет не только мне, но и всем остальным людям, избежать этой болезни и узнать, что же в действительности представляет йод, и для чего он нужен.
Список использованной литературы
5. Аликберова Л.Ю. Занимательная химия: Книга для учащихся, учителей и родителей. - М.: АСТ-ПРЕСС, 19994.
7. Степин Б.Д; Аликберова Л.Ю. Книга по химии для домашнего чтения. - 2-е изд. - М.: Химия, 1995.
Химический элемент йод (обозначается как I) является самым тяжёлым из часто встречающихся галогенов и находится в 17 группе (VIIA) периодической системы Менделеева с атомным номером 53 и массой 126.9045. Он существует в виде блестящего пурпурно-чёрного неметаллического твёрдого вещества в стандартных условиях, которое плавится с образованием глубокой фиолетовой жидкости.
- История открытия
- Основная информация
- Физические свойства
- Химические свойства
- Наличие в природе
- Изотопы элемента
- Получение и нахождение
- Использование и применение
- Биологическая роль

История открытия

Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:

Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:

- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:


- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.

Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента

Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:

- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение

Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение

Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
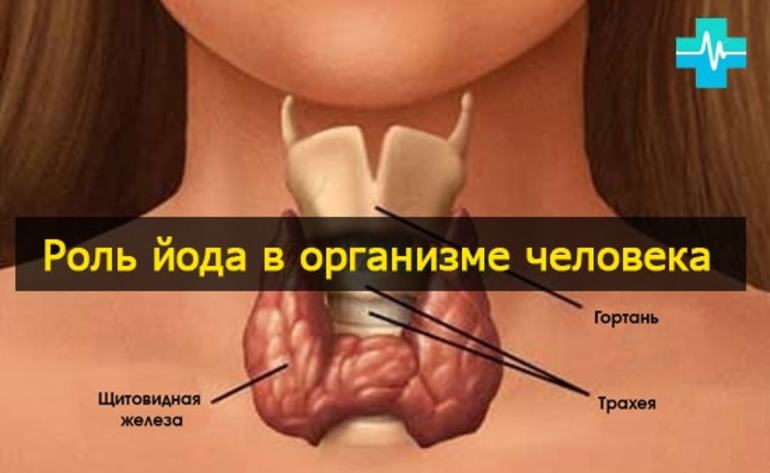
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.

Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.

Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.

История открытия элемента, применение иода в науке и технике, значение иода для организма человека.
| Вложение | Размер |
|---|---|
| iod_vezdesushchiy.docx | 27.82 КБ |
Предварительный просмотр:
XIII межрегиональные юношеские научно-исследовательские чтения имени Каюма Насыйри
Предметно-тематическое направление: химия
Исследовательская работа по химии
Выполнила ученица 10 класса
Маданова Татьяна Сергеевна
Руководитель: Петрова Надежда
Анатольевна, учитель биологии и химии
высшей квалификационной категории
- Вступление
- Строение атома химического элемента иода и простого вещества.
- История открытия элемента.
- Нахождение в природе.
- Применение иода в науке и технике.
- Значение иода для организма человека.
- Заключение
- Литература
Гипотеза. Если бы в окружающей среде не присутствовал химический элемент иод, как бы это отразилось на жизнедеятельности живых организмов, в частности, человека и каких открытий в области науки и техники лишилось бы человечество.
1. Изучить особенности строения атома химического элемента иода и простого вещества, образованного химическим элементом иодом.
2. Познакомиться с историей открытия элемента.
3. Изучить, где и в каких количествах находится иод в природе.
4. Сформировать представление о применении иода в промышленных целях.
5. Уяснить механизм влияния йода на обменные процессы в организме человека.
6. Выяснить влияние экологических факторов, питания на заболевания, вызываемые достатком или избытком йода в организме человека.
7. Ознакомиться с методами решения этой проблемы.
Строение атома химического элемента иода и простого вещества
Нахождение в природе
Иод — очень редкий элемент земной коры. Его содержание в ней оценивается всего в 1,4·10-5 %. В горных породах содержание иода измеряется миллионными долями процента. Так как иод химически достаточно активен, в свободном виде в природе он не встречается. В небольших количествах иод содержится в буровых водах нефтяных и газовых скважин. Больше иода в воде, особенно морской (0,4·10-5 — 0,5·10-5 %), сравнительно много в почвах и растениях. Морские водоросли, например, способны накапливать иод до десятых долей процента (от массы золы). На тонну водорослей приходится несколько килограммов иода. А в некоторых морских губках количество йода еще больше. Исследователи особенно хорошо изучили берега Тихого океана. На тысячи километров прибрежного района волны прибивают, главным образом осенью, огромное количество водорослей морской капусты — свыше 300 000 т. Эти бурые водоросли содержат сотни тысяч килограммов иода. Их добывают, часть используют для пищи, а часть осторожно сжигают, извлекая из них иод и поташ.
Применение иода в науке и технике
В промышленности применение иода пока незначительно по объему, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов. Данное п рименение иода основано на особенностях его химических свойств. Иод относится к семейству галогенов, которые являются реакционноспособными и легко образуют соединения с огромным количеством веществ. Но иодиды являются малоустойчивыми по сравнению с фторидами, бромидами, хлоридами. Сочетание этих двух качеств - высокой реакционной способности с относительно малой прочностью соединений позволяет использовать иод в так называемых транспортных химических реакциях. Процессы, основанные на этих реакциях, широко применяются в химической технологии. Суть их сводится к следующему: какое-либо исходное вещество с примесями в одном аппарате (или одной зоне аппарата) реагирует с промежуточным реагентом, образуя летучее или подвижное соединение, которое, переместившись в другой аппарат (другую зону аппарата), разлагается вновь на исходное и промежуточное вещество. Этот промежуточный реагент практически не расходуется, а служит лишь для переноса вещества и многократно используется в процессе. Подобрав соответствующие условия, можно добиться, что примеси основного вещества не будут вступать в реакцию и продукт, получаемый разложением промежуточного соединения, будет в десятки и сотни раз чище исходного. Так родился метод иодидного рафинирования металлов. В настоящее время получение металлов и полупроводниковых материалов особой чистоты становится все более важным для радиоэлектроники, ядерной энергетики и аэрокосмической техники.
Сравнительно недавно иод стали использовать в производстве ламп накаливания, работающих по иодо – вольфрамовому циклу. Температура плавления вольфрама почти 3400°С. Испарившийся вольфрам на стенках колбы реагирует с иодом, образуя иодид вольфрама. Иодид испаряется со стенок и устремляется к раскаленной нити, где разлагается на вольфрам и свободный иод. Итак, вольфрам возвращен на место, а иод снова может вступать в соединение. Иод как бы заботится о сохранении вольфрамовой спирали и тем самым значительно увеличивает время работы лампы.
Иод применяют для изготовления специального поляроидного стекла. В стекло вводят кристаллы солей иода, которые распределяются строго закономерно. Колебания светового луча не могут проходить через них во всех направлениях. Получается своеобразный фильтр, называемый поляроидом, который отводит встречный слепящий поток света. Такое стекло используют в автомобилях. Комбинируя несколько поляроидов или вращая поляроидные стёкла, можно достигнуть исключительно красочных эффектов – это явление используют в кинотехнике и в театре.
Йод стали добавлять в подшипники, а точнее в масло для подшипников, выполненных из нержавеющей стали и титана, что во много раз снижает трение в подшипниках. Количество добавленного йода ничтожно мало, а повышение нагрузок на трущиеся детали увеличилось более, чем в 50 раз.
Иод применяется в фотоделе. В основе его способа фотографии лежит фотохимическая реакция разложения галогенидов серебра под действием света.
В аналитической химии и органическом синтезе иод и его соединения используются в лабораторной практике для анализа и в хемотронных приборах, действие которых основано на окислительно-восстановительных реакциях иода. Как катализатор (ускоритель реакций) иод используется в производстве всех видов искусственных каучуков. Подобно другим галогенам иод образует многочисленные иодоорганические соединения, которые входят в состав некоторых синтетических красителей.
И еще одна новая область, куда проникает иод, это воздействие человека на погоду. Кристаллы иодида серебра, распыляемые над облаками, искусственно вызывают дождь.
Значение иода для организма человека
Особую роль играет иод в жизни животных и человека. Жизнь человека без иода немыслима. Человеческий организм исключительно чуток к иоду: понижение его содержания в воздухе и воде сейчас же отражается на здоровье. В среднем в организме взрослого человека находиться около 25 мг иода. Большая часть иода сосредоточена в щитовидной железе, гормоны которой состоят из йода на 65 %. При нормальном состоянии в крови человека содержится 600 мкг иода. Дневная норма, обеспечивающая работу щитовидной железы – всего 75 мкг. Несмотря на это, дефицит иода возникает достаточно быстро. Известно, что щитовидная железа выполняет одну из основных функций жизнедеятельности организма человека, а именно обмен веществ. Щитовидная железа под воздействием иода регулирует процессы жирового обмена, углеводов и белков, желудочно-кишечный тракт, сердечно-сосудистую систему, психическую, половую деятельность. В щитовидной железе происходит синтез важнейшего гормона тироксина, выработку которого стимулирует иод. Гормон тироксин через кровь разноситься ко всем органам и тканям организма человека. Именно гормон тироксин усиливает окислительные реакции, контролирует обмены жира и воды, увеличивает потребление кислорода. При участии иода происходят окислительные процессы в обмене веществ, которые положительно влияют на мозговую деятельность человека. Таким образом, нормальное количество иода в организме положительно влияет на умственные способности. Кроме этого иод оказывает успокаивающее действие на организм человека. Недостаток иода можно заметить практически сразу. Симптомы йодной недостаточности: Эмоциональные: подавленное настроение, раздражительность, сонливость. Кардиологические: атеросклероз, аритмия, повышение нижнего давления. Иммунодефицитные: инфекционные и простудные заболевания, снижение функций щитовидной железы. О нем свидетельствует увеличение щитовидной железы, спровоцированное попыткой органа восстановить нарушенный процесс выработки гормонов. При этом образуется эндемический зоб, развивается базедова болезнь. Дефицит иода сказывается на репродуктивной функции. Возможны выкидыши и даже мертворождение. Дети могут рождаться плохо развитыми умственно и физически. Если накопление иода в организме человека повышенное, то щитовидная железа становиться гиперактивной (гипертиорез). Такое заболевание приводит к резкому ускорению обмена веществ. В результате вес людей становиться значительно меньше нормы, конечности начинают дрожать, появляется пучеглазие, из организма с мочой выводиться много креатина и азота, нарушается работа сердечнососудистой системы. Такое заболевание может привести в конечном итоге к увеличению естественного размера щитовидной железы и даже ее перерождению (образованию доброкачественной опухоли).
Необходимое количество иода наш организм получает извне. Именно поэтому очень важно знать, как можно снабжать себя этим веществом, где раздобыть йод для организма?
Прежде всего, это иодированная соль. В одном грамме – 40 мкг вещества. Важно знать, что иод испаряется при нагревании, теряется в среднем 30%. Поэтому иодированную соль нужно добавлять в пищу в самом конце готовки. Также на содержание иода в соли влияет срок ее годности, при истечении которого вещества там вовсе не остается. И од можно получить из морепродуктов. В речной рыбе, к примеру, содержится около 70 мкг на 100 г, а в устрицах – 60 мкг. В 100 г водорослей морской капусты иода может содержаться от 500 до 3000 мкг. Содержится иод и в некоторых овощах: капуста, картофель, щавель, морковь, лук, редька и т.д. Также наш организм может получать иод при употреблении в пищу таких ягод, как клубника, черный виноград и смородина. Иод есть в яичном желтке, в зелени. В брокколи и шампиньонах его от 15 до 18 мкг. Проведем эксперимент с целью убедиться, есть ли в картофеле иод. Эксперимент 2 : Качественная реакция на йод. В стакане – крахмальный клейстер. Капля йода окрашивает крахмальный клейстер в синий цвет. Присутствие йода заметно по посинению крахмала, это качественная реакция на йод. Капнем аптечным йодом на срез картошки – он станет синим. Картофель содержит крахмал. В свежем виде в пище иода содержится гораздо больше, чем после тепловой обработки. Некоторые считают, что ежедневное нанесение спиртового раствора иода, может восполнить нехватку его в организме, и заблуждаются. Иод не усваивается через кожу.
Наличие иода в организме можно определить простым тестом. Эксперимент 3 . Перед сном ватной палочкой или спичкой, предварительной смоченной в 5% растворе иода нужно нанести на любой участок тела, кроме области щитовидной железы, несколько полосок разной толщины. Например, первую полосу иода нанести в один слой, вторую – намазать дважды, третью смочить трижды. Утром внимательно присмотритесь к этому месту — если осталась самая толстая линия – обратите на состояние здоровья, если остались две линии, то иододифицита нет. Если вы не увидите ни одной из нанесенных линий, то это значит, что ваш организм остро нуждается в иоде. Или можно проделать следующий опыт. Нарисуйте йодом сеточку на коже. В случае если после суток рисунок не пропадет, значит его достаточно. Но если же сеточка пропала через 2-3 часа, то вы испытываете недостаток йода.
Выводы проделанного исследования: Я выяснила, что из себя представляет химический элемент –Иод. Узнала то, что иод очень важен и нужен для организма человека, в каких дозах его нужно принимать. Выяснила, что иод помогает нам в медицине, имеет широкое применение в науке и технике. Действительно, иод можно назвать вездесущим.


Блестящий тёмно-серый неметалл. В газообразном состоянии — фиолетовый.

Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 7.1 Й од и щитовидная железа
- 7.2 Токсичность
![йод]()
Название и обозначение
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Нахождение в природе
![йод кристаллический]()
Йод — редкий элемент. Его кларк — всего 400 мг/т . Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде ( 20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях ( 2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн , 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства
![йод кристаллический]()
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде ( 0,28 г/л ), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
![йод кристаллы]()
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅10 7 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ .
![йод цилиндр]()
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I − :
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По "Началам Химии" Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
- Реакция образования нитрида трийода:
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
Применение
В медицине
![раствор йода]()
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода ( 125 I, 132 I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк .
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность ]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
![йод кристаллы]()
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг ) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг .
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
![кристаллы йода]()
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
Читайте также:









