Сочинение дисперсные системы в моей жизни
Обновлено: 07.07.2024
Дисперсные системы достаточно широко распространены в природе, поэтому в жизнедеятельности человека используются с давних времен.
Человек сам является объектом природы и, как любой представитель живого вещества, является совокупностью взаимосвязанных истинных и коллоидных систем разной консистенции: от низковязких (кровь) до систем практически твердых ( костные ткани, образующие скелет).
Биохимические процессы в организме протекают в дисперсных системах: усвоение пищи напрямую связано с переходом питательных веществ в новое состояние – растворенное. Дисперсные системы в виде биожидкостей принимают участие в транспортировке питательных веществ: аминокислот, жиров, кислорода, а также лекарственных препаратов к тканям и органам. Кроме того, они способствуют выведению билирубина, мочевины и углекислого газа из организма. В целом, знание закономерностей физико-химических процессов в дисперсных системах, сыграет очень важную роль для будущих медработников изучающих медико-биологические и клинические дисциплины для более глубокого понимания процессов, протекающих в организме.
Практически любой организм либо представляет собой дисперсную систему, либо содержит их в различных формах.
Роль дисперсных систем в практической деятельности и природных экологических процессах трудно переоценить. Особенно большое значение дисперсные системы имеют в быту и медицине. Так, в последней широко используются коллоидные растворы, аэрозоли и мази.
Дисперсные системы играют в деятельности человека как позитивную, так и негативную роль. Использование свойств коллоидных систем в приготовлении пищи относится к позитивной роли, а образование смога — к негативной.
Для достижения цели данного занятия используются мультимедийные технологии, ТСО, беседа, лекция, самостоятельная работа.
План занятия
Вид учебного занятия: теоретическое
Тип занятия: изучение нового материала
- освоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятиях, законах и теориях;
- овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ;
- развитие познавательных интересов и интеллектуальных способностей с использованием различных источников информации, в том числе компьютерных;
- воспитание убежденности позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к собственному здоровью и окружающей среде;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, на производстве и в сельском хозяйстве, для решения практических задач в повседневной жизни, для предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
- Образовательные:
изучить значение дисперсных систем в живой и неживой природе , в практической жизни человека.
- Развивающие:
развивать логическое мышление, внимание, память, умение осуществлять самостоятельный поиск информации с использованием различных источников, организовывать собственную деятельность, необходимую для выполнения профессиональных задач.
- Воспитательные:
создавать содержательные и организационные условия для развития самостоятельности в добывании студентами знаний, скорости восприятия и переработки информации, культуры речи, воспитании настойчивости в достижении цели, формирование способности организовывать собственную деятельность при выполнении заданий.
Формируемые компетенции:
-чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
-готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций ;
-умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
-использование различных видов познавательной деятельности и основных интеллектуальных операций (анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
-сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
-владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
-владение основными методами научного познания, используемыми в химии: наблюдением, описанием; умение обрабатывать, объяснять результаты и делать выводы; готовность и способность применять методы познания при решении практических задач;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников
Требования к результатам усвоения учебного материала
- Обучающиеся должны знать:
классификацию дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, по размеру частиц. иметь представление об эффекте Тиндаля, коагуляции ;
значение дисперсных систем в живой и неживой природе и практической жизни человека( эмульсии и суспензии в строительстве, пищевой и медицинской промышленности, косметике; биологические, медицинские и технологические золи);
значение гелей в организации живой материи (биологические, пищевые, медицинские, косметические гели);
понятие синерезиса (фактор, определяющий срок годности продукции на основе гелей, свертывание крови как биологический синерезис, его значение).
- Обучающиеся должны уметь:
различать грубодисперсные системы (эмульсии , суспензии), тонкодисперсные системы( коллоидные растворы (золи, гели)) и истинные растворы (молекулярные, молекулярно-ионные и ионные);
Форма организации обучения: лекция с элементами беседы и самостоятельной работы.
Учебно-методическое оснащение:
2.Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов : пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2014. – 79 с.
Материально-техническое оснащение:
ПК, телевизор, Периодическая система Д.И.Менделеева.
Межпредметные связи: биология, физика, математика.
Время: 90 мин.
Технологическая карта занятия
Содержание занятия
Этап занятия
Содержание и методы обучения
Проверка санитарного состояния аудитории и внешнего вида студентов
Раздача рабочего задания к практической части
Мотивация учебной деятельности
Беседа на тему важности существования различных растворов в организме человека
Объявление и запись темы занятия.
Объявление типа, цели и задач занятия
Актуализация опорных знаний. Контроль исходного уровня знаний
Проверка домашнего задания в соответствии с ФОС
Изучение нового материала
Обобщение и закрепление изученного материала
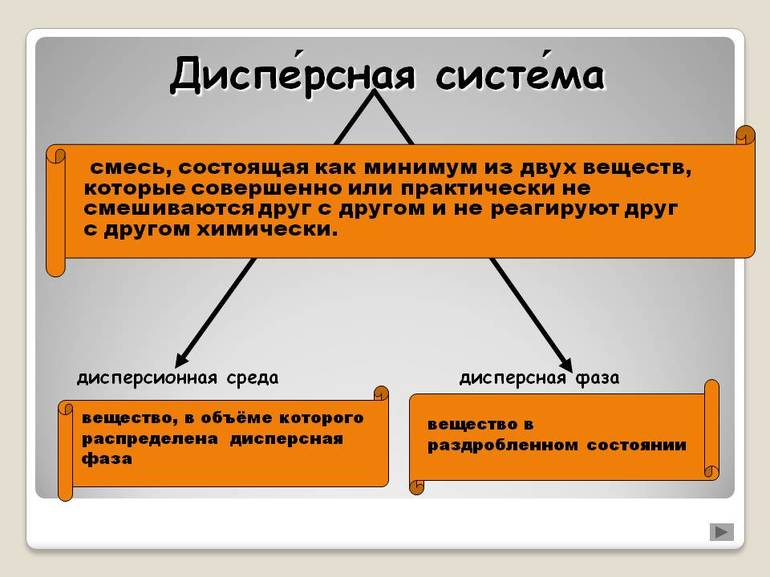
Дисперсной системой называется смесь, состоящая из нескольких фаз (отдельных веществ). Фазы в дисперсной системе не взаимодействуют и не смешиваются.
Рассмотрим дисперсные системы с двумя фазами (двухфазные). Одно из веществ, которое присутствует в системе в меньшем количестве, называется дисперсной фазой, а второе (в большем количестве) – дисперсионной средой.
Отдельная фаза может быть в одном из трех состояний: твердом (Т), жидком (Ж) и газообразном (Г). Для комбинации двух фаз получаем девять возможных сочетаний. Их обозначают дробью. Числитель дроби относится к дисперсной фазе, а знаменатель – к дисперсионной среде.
Примеры.
Туман (капли воды в водяном паре) образует дисперсную систему Ж/Г. Бетон и металлокерамика относятся к твердым двухфазным системам (Т/Т).
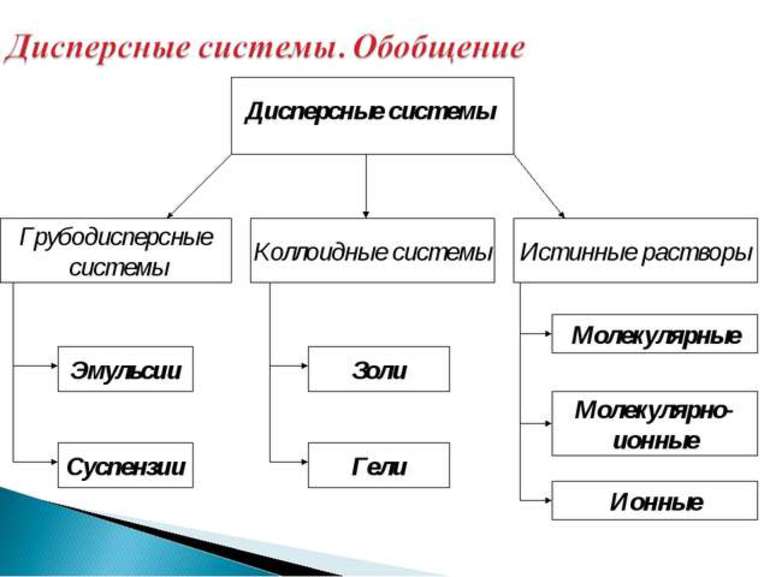
Если частицы вещества, составляющего дисперсную фазу, имеют размер больше 100 нм, система называется грубодисперсной, в противном случае – тонкодисперсной. Если размер частиц в тонкодисперсной системе больше 1 нм, такая система называется коллоидной системой.
Коллоидные системы делятся на золи (Т/Ж) и гели (Ж/Т). Золи называют коллоидными растворами.К золям относятся многие клеи.
Тонкодисперсную систему с размером частиц менее 1 нм называют истинным раствором. Растворы относятся к гомогенным дисперсным системам, в которых (в отличие от гетерогенных систем) нет поверхности раздела между фазами.
Примеры.
Коллоидные и истинные растворы внешне очень похожи. Чтобы их отличить, можно воспользоваться эффектом Гиндаля. Если пропустить через кювету с раствором луч света, в коллоидном растворе образуется светящаяся дорожка в виде конуса.
Если частицы дисперсной фазы имеют одинаковые размеры, такие системы называются монодисперсными, в противном случае – полидисперсными. К полидисперсным относится большинство встречающихся в природе дисперсных систем.
Примером трехфазной системы можно считать молоко. Молоко можно рассматривать как систему, состоящую из трех веществ: жира, казеина и раствора молочного сахара в воде. Если молоко оставить стоять, то через некоторое время содержащийся в нем жир всплывает, образуя сливки. Казеин при добавлении небольшого количества уксуса (подкислении) выпадает в виде творога.
При определенных условиях в дисперсной фазе происходит процесс коагуляции, когда частицы слипаются и выпадают в осадок. Коагуляцию можно наблюдать при нагревании клеев. Студенистый остаток, остающийся после коагуляции золя, является гелем. Дисперсионная среда в геле образует трехмерную структуру в виде сетки.
При механическом воздействии, например, встряхивании, гель может снова стать золем. Такой процесс называется тиксотропией.
Коллоидные системы широко распространены в природе. Некоторые химики даже процесс возникновения жизни на Земле рассматривают как процесс изменения коллоидного состояния вещества.
Дисперсные системы

Иглокожими называют беспозвоночных животных. Часть из них свободно передвигается (морские звезды, ежи), хотя и ведут малоподвижный образ существования, а часть – прикрепляется ко дну (морские лилии). Обитают они только в морях и совершенно
Бесспорно, про этот город слышали буквально все. Его можно назвать центром мира. Именно здесь сосредоточено множество достопримечательности, различные учреждения от образовательных до культурных. Есть множество развлечений и мест,
Самый крупный вид из отряда зайцеобразных — заяц-беляк. Вес этого вида до 5 кг, а в длину тело может достигать до 65 см. Хвост — круглый, диаметром до 8 см. Уши — до 10 см. Самцы всегда мельче самок. Волоски,
Чистые вещества в природе встречаются очень редко. Кристаллы чистых веществ – сахара или поваренной соли, например, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещество внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
В природе чаще всего встречаются смеси различных веществ. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы. Такие системы мы будем называть дисперсными.
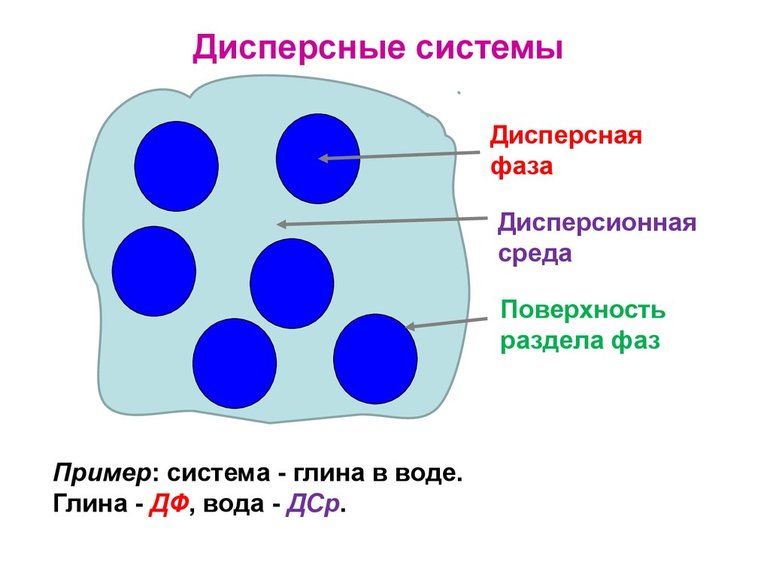
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого.
Вещество распадается на ионы, молекулы, атомы, значит “дробится” на мельчайшие частицы. “Дробление” > диспергирование, т.е. вещества диспергируют до разных размеров частиц видимых и невидимых.
Вещество, которое присутствует в меньшем количестве, диспергирует и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называются гетерогенными (неоднородными).
И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем.
Таблица
Примеры дисперсных систем
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система – раствор. Она однородна, поверхности раздела между частицами и средой нет.
Дисперсные системы и растворы очень важны в повседневной жизни и в природе. Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета – наш общий дом – Земля; без клеток не было бы живых организмов и т.д.
ВЗВЕСИ
- Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д.
- Суспензии ( среда – жидкость, фаза – нерастворимое в ней твердое вещество).Чтобы приготовить суспензию , надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д.
- Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний – взвесь капелек жидкости в газе. Например: туман, грозовые тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига – клинкера. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающих изо рта больного гриппом, также вредные аэролози. Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопление облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, лечение дыхательных путей (ингаляция) – примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли – туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидные системы (в переводе с греческого “колла” – клей, “еидос” вид клееподобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
Из курса общей биологии вам известно, что частицы такого размера можно обнаружить при помощи ультрамикроскопа, в котором используется принцип рассеивания света. Благодаря этому коллоидная частица в нем кажется яркой точкой на темном фоне.
Их подразделят на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей). И живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки и т.д.) Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в лесу и в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
Пропускание луча света через растворы;
а – истинный раствор хлорида натрия;
б – коллоидный раствор гидроксида железа (III).
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Это объясняется тем, что вещества в коллоидном, т.е., в мелкораздробленном, состоянии обладают большой поверхностью. На этой поверхности адсорбируются либо положительно, либо отрицательно заряженные ионы. Например, кремниевая кислота адсорбирует отрицательные ионы SiO3 2- , которых в растворе много вследствие диссоциации силиката натрия:
Частицы же с одноименными зарядами взаимно отталкиваются и поэтому не слипаются.
Но при определенных условиях может происходить процесс коагуляции. При кипячении некоторых коллоидных растворов происходит десорбция заряженных ионов, т.е. коллоидные частицы теряют заряд. Начинают укрупняться и оседают. Тоже самое наблюдается при приливании какого-либо электролита. В этом случае коллоидная частица притягивает к себе противоположно заряженный ион и ее заряд нейтрализуется.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, торт “Птичье молоко”) и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. Историю развития на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
Выполните лабораторные опыты по теме (групповая работа, в группе по 4 человека).
Вам выдан образец дисперсной системы. Ваша задача: определить какая дисперсная система вам выдана.
Выдано учащимся: раствор сахара, раствор хлорода железа (III), смесь воды и речного песка, желатин, раствор хлорида алюминия, раствор поваренной соли, смесь воды и растительного масла.
- Рассмотрите внимательно выданный вам образец (внешнее описание). Заполните графу № 1 таблицы.
- Перемешайте дисперсную систему. Понаблюдайте за способностью осаждаться.
Осаждается или расслаивается в течении несколько минут или с трудом в течении продолжительного времени, или не осаждаются. Заполните графу № 2 таблицы.
- Пропустите дисперсную систему через фильтр. Что наблюдаете? Заполните графу № 3 таблицы. (Отфильтруйте немного в пробирку).
- Пропустите через раствор луч света фонарика на фоне темной бумаги. Что наблюдаете? (можно наблюдать эффект Тиндаля)
- Сделайте вывод: что это за дисперсная система?Что является дисперсной средой? Что является дисперсной фазой? Каковы размеры частиц в нем? (графа №5).
Синквейн ( "синквейн" – от фр. слова, означающего "пять") – это стихотворение из 5 строк по определенной теме. Для сочинения синквейна дается 5 минут, после чего написанные стихотворения можно озвучить и обсудить в парах, группах или на всю аудиторию.
- В первой строчке одним словом (обычно существительным) называется тема.
- Вторая строчка – это описание этой темы двумя прилагательными.
- Третья строчка – это три глагола (или глагольные формы), называющие самые характерные действия предмета.
- Четвертая строчка – это фраза из четырех слов, показывающая личное отношение к теме.
- Последняя строка – это синоним темы, подчеркивающий её суть.
Лето 2008 г. Вена. Шенбрунн.
Лето 2008 г. Нижегородская область.
Облака и их роль в жизни человека
Вся окружающая нас природа – организмы животных и растений, гидросфера и атмосфера, земная кора и недра представляют собой сложную совокупность множества разнообразных и разнотипных грубодисперсных и коллоидных систем.
Развитие коллоидной химии связано с актуальными проблемами различных областей естествознания и техники.
На представленной картинке представлены облака – один из видов аэрозолей коллоидных дисперсных систем. В изучении атмосферных осадков метеорология опирается на учение об аэродисперсных системах.
Облака нашей планеты представляют собой такие же живые сущности, как вся природа, которая нас окружает. Они имеют огромное значение для Земли, так как являются информационными каналами. Ведь облака состоят из капиллярной субстанции воды, а вода, как известно, очень хороший накопитель информации. Круговорот воды в природе приводит к тому, что информация о состоянии планеты и настроении людей накапливается в атмосфере, и вместе с облаками передвигается по всему пространству Земли.
Облака – удивительное творение природы, которое доставляет человеку радость, эстетическое удовольствие.
Р.S.
Огромное спасибо Першиной О.Г., учителю химии МОУ гимназия “Дмитров”, на уроке работали с найденной презентацией, и она дополнялась нашими примерами.
Крайне редко в природе встречаются вещества в идеально чистом виде и состоянии. Обычно это разбавленная гомогенная субстанция, состоящая из различных атомов и молекул. Причем это необязательно 2 элемента, встречаются соединения с тремя и более. Когда одна структура находится в другой, равномерно распределяется, но не растворяется в ней, — это дисперсные системы.
- Понятие и определение
- Классификация по агрегатному состоянию
- Существующие виды
- Взвеси и их особенности
- Коллоидные системы
- Высокомолекулярные вещества
- Ключевые свойства
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
- Свободнодисперсные. Основное и главное свойство такой системы — текучесть. Поэтому сюда относят любые аэрозоли и растворы.
- Связнодисперсные. Это твердые или полутвердые системы. К ним относятся все концентрированные пасы или аморфные вещества.
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
- Эмульсии. В жидком агрегатном состоянии находится фаза и среда, они не взаимодействуют друг с другом и не растворяются. Многие получаются посредством гомогенизации. К ним относят большинство лекарственных препаратов или молоко.
- Суспензии. Здесь средой является жидкость, а фазой — твердая структура. Получают посредством пересыпания в жидкость порошка. Структура получается текучая, т. к. фаза крайне мелкая. Если оставлять структуру в неподвижном состоянии, выпадает осадок. Почти все строительные растворы относятся к категории.
- Аэрозоли. Взвесь в этом случае располагается в газе. Примеров множество, встречаются как в природе, так и в быту. Например, грозовые или обычные облака, туманы и некоторые виды осадков. Большинство химикатов, производимых для обработки сельскохозяйственных структур, тоже являются аэрозолями.
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:

Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
- Процессы смешения происходят естественно и крайне медленно.
- Сначала происходит набухание, а затем смешивание.
- Полимерные и истинные растворы отличаются существенно. Те законы, которые характерны для одних (Рауля, Вант-Гоффа), несвойственны другим.
- По всей полученной субстанции свойства могут различаться из-за разного направления и/или размеров молекул.
- Повышенная вязкость.
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства

Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
- Степень (количество фаз).
- Молекулярный вес.
- Размеры частиц.
- Агрегатное состояние.
- Лиофобная/лиофильная группа.
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Читайте также:

