Эксперимент шпемана путь к клонированию сообщение
Обновлено: 05.07.2024
Термин "клонирование" описывает целый ряд различных процессов, в результате которых может быть создана генетическая копия биологического организма. "Скопированный" материал, который имеет аналогичный "оригиналу" генетический состав, называется "клоном".
Первым, кто доказал возможность искусственного получения близнецов, в 1885 году стал немецкий эмбриолог Ханс Дриш (Hans Driesch). Разделив клетки двуклеточного зародыша морского ежа, он получил два генетически идентичных организма.
В 1902 году немецкий ученый Ханс Шпеман (Hans Spemann) разделил двухклеточный зародыш саламандры на две части, каждая из которых развилась в полноценный организм. Результат эксперимента подтвердил, что на ранней стадии развития эмбриональные клетки содержат достаточную для создания самостоятельного организма информацию.
В 1928 году Ханс Шпеман клонировал саламандру с помощью пересадки ядра из одной клетки в другую. Шпеман показал, что именно клеточное ядро управляет развитием эмбриона.
В 1951 году Роберт Бриггс (Robert Briggs) и Томас Клинг (Thomas Kling), используя методы Шпемана по эмбриональному переносу ядра, успешно клонировали лягушек.
В 1962 году Джон Гердон (John Gurdon), профессор Оксфордского университета, заявил, что клонировал южно-африканскую лягушку. Ему удалось добиться развития яйцеклеток лягушки с чужим ядром до достаточно поздних стадий, примерно в двух процентах случаев особи превращались во взрослых лягушек.
В 1963 году британский биолог Джон Холдейн (John Haldane), описывая результаты исследований Гердона, впервые употребил термин "клон".
В 2012 году Гердон за свои исследования стал лауреатом Нобелевской премии по медицине и физиологии.
В 1963 году китайский исследователь Тун Дичжоу (Tong Dizhou) впервые клонировал рыбу. Он пересадил генетический материал взрослого азиатского карпа в икринку, из которой появилась новая особь, которая впоследствии принесла потомство.
В 1969 году профессор Гарвардского университета Джонатан Беквит (Johnathan Bechwith) с коллегами выделили первый ген.
В 1972 году профессор Стэнфордского университета Пол Берг (Paul Berg) создал первые рекомбинантные молекулы ДНК.
В 1984 году датский ученый Стин Вилладсен (Steen Willadsen) клонировал овцу из эмбриональных клеток. Это был первый эксперимент по клонированию млекопитающего. Вилладсен использовал метод пересадки ядра.
В 1987 году профессора Университета Висконсина Нил Ферст (Neal First), Рэндал Прэзер (Randal Prather) и Уиллард Айстоун (Willard Eyestone) клонировали двух телят.
В 1996 году профессора Рослинского института в Шотландии Иэн Уилмут (Ian Wilmut) и Кит Кэмпбелл (Keith Campbell) с помощью генетического материала двух изолированных эмбрионов успешно клонировали двух овец — Меган и Мораг.
В 1996 году Уилмут и Кэмпбелл впервые поставили эксперимент по клонированию животного из клеток взрослой особи. Из 29 эмбрионов, которые ученые получили из 277 клеток вымени овцы, только один плод продолжал развиваться в теле суррогатной матери. В результате эксперимента 5 июля 1996 года на свет появилась клонированная овечка дорсетской породы, которую назвали Долли. Ее рождение ознаменовало переворот в науке.
27 февраля 1997 года в английском журнале Nature была опубликована сенсационная статья группы сотрудников Рослинского института во главе с Иэном Уилмутом об успешном клонировании овечки Долли.
В 1997 году в лаборатории Дона Вольфа (Don Wolf) Орегонского регионального центра по изучению приматов ученым удалось клонировать двух макак-резусов.
В 1997 году Иэн Уилмут и Кит Кэмпбелл использовали выращенные в лабораторных условиях клетки кожи с генетически вживленным в них человеческим геном и клонировали еще одну овцу.
В 1998 году в Университете штата Гавайи международная группа ученых во главе с профессором Риузо Янагимачи (Ryuzo Yanagimachi) клонировала 50 мышей из клеток взрослых особей. Первая мышь-клон получила прозвище Кумулина.
5 марта 2000 года английские ученые провели первую успешную операцию по клонированию свиней.
22 декабря 2001 года в Техасском университете агрокультуры и машиностроения родилась первая в мире клонированная домашняя кошка по кличке Сиси. Через два года в университете родились первый клонированный олень — Дьюи и первая клонированная лошадь — Прометея.
В 2001 году ученые из компании Advanced Cell Technology, Inc. объявили о рождении быка-гаура по кличке Ноа, который стал первым клонированным животным, относящимся к вымирающим видам. Хотя гаур прожил всего несколько дней, этот эксперимент открыл перспективу спасения исчезающих видов животных путем клонирования.
В 2003 году знаменитую на весь мир овцу Долли усыпили. Причиной послужил прогрессирующий рак легких, вызванный вирусом. Долли было 6,5 лет, она родила шесть ягнят.
В 2005 году в Южной Корее на свет появилась первая в мире клонированная собака — африканская борзая Снуппи.
В 2005 году в Сеульском национальном университете были клонированы исчезающие виды волка.
В 2009 году в Дубае (ОАЭ) родился первый клонированный верблюд — Инджас, в переводе с арабского "достижение".
В июне 2013 года группа ученых японского научного центра RIKEN сумела клонировать мышь, используя лейкоциты, выделенные из капли периферической крови животного.
Ранее лейкоциты не использовались для клонирования.
Несмотря на ряд заявлений о проведении успешных опытов по клонированию человеческого эмбриона (в 1998, 2004 годах — в Южной Корее, в 2002 году — в США), научного подтверждения этому не было.
В 2013 году работающий в США ученый казахского происхождения Шухрат Миталипов объявил об успешном эксперименте по получению стволовых клеток из клонированного человеческого эмбриона. Научный коллектив под руководством профессора Орегонского университета науки и здоровья Миталипова извлек ДНК из донорской яйцеклетки, полученной от молодой женщины, поместил в нее генетическую информацию из клетки кожи и заставил клетку делиться, но не путем стимулирования электрическими разрядами, как в случае с клетками овечки Долли, а с помощью кофеина. Полученный эмбрион развивался 5-6 дней и достиг размера в 120 клеток, после чего Миталипову удалось извлечь из него живые стволовые клетки.
По мнению британского ученого Иэна Уилмута — создателя овечки Долли, существующие процедуры клонирования очень неэффективны. Исследования показали, что в лучшем случае успехом заканчиваются лишь 5% попыток.
Клонирование до сих пор является предметом серьезной дискуссии в обществе с точки зрения этики. Технология клонирования человека пока окончательно не разработана, а его сторонники сталкиваются с множеством юридических, этических и религиозных проблем.
Запрет на проведение опытов по репродуктивному клонированию человека действует в Австрии, Аргентине, Бельгии, Бразилии, Дании, Италии, Канаде, Норвегии, Португалии, Финляндии, Франции, ФРГ, Швейцарии, Швеции, Японии и других странах.
В 2002 году в России был введен пятилетний мораторий на клонирование человека, срок действия которого истек в 2007 году.
В 2010 году президент РФ подписал закон о продлении моратория до вступления в силу федерального закона, устанавливающего порядок использования технологий клонирования организмов в целях клонирования человека.
Закон при этом не запрещает клонирование клеток и организмов в научно-исследовательских целях, клонирование органов для трансплантации и клонирование животных.
Ханс Шпеман
Родился 27 июня 1869 года, Штутгард, Королевство Вюртемберг
Умер 9 сентября 1941 года, Фрайбург, Германия
Уже в Гейдельберге биолог Густав Вольф проделывал удивительный эксперимент: у зародыша тритона из развивающегося глаза удалял хрусталик, но он вновь развивался из края сетчатки. Шпеман был настолько поражен магией увиденного, что, уже будучи студентом, отказался от медицинской карьеры и решил стать эмбриологом. Сказано — сделано: он ушел из Гейдельберга, недолго учился в Мюнхене, а затем перешел в Зоологический институт Университета Вюрцбурга.
Там он получает степени по зоологии, ботанике и физике, выполнив исследования под руководством эмбриолога Теодора Генриха Бовери (который установил постоянство количества хромосом у разных видов), ученика великого Пуркинье Юлиуса фон Сакса (который фактически был одним из первооткрывателей фотосинтеза) и Вильгельма Конрада фон Рентгена соответственно.

Эмбриональной индукцией называется процесс взаимодействия частей зародыша, при котором один участок оказывает влияние на судьбу другого. Данное понятие относится к экспериментальной эмбриологии.
Статья посвящена одному из самых важных и сложных вопросов данной науки: "Что значит эмбриональная индукция?"

Немного истории
Явление эмбриональной индукции было открыто в 1901 году такими немецкими учеными как Ханс Шпеман и Хильда Мангольд. Впервые этот процесс изучили на примере хрусталика у земноводных, находящихся в эмбриональном состоянии. История сохранила множество примеров и экспериментов по данной теме, в основе которых лежит теория Шпемана.

Гипотеза
Как говорилось ранее, эмбриональная индукция – это процесс взаимодействия частей эмбриона. Так вот, согласно гипотезе, есть ряд клеток, воздействующих на другие клетки как организаторы, провоцирующие изменения в развитии. Для того, чтобы более понятно проиллюстрировать данный процесс, ученые в 20-ых годах прошлого века провели ряд опытов, о которых более подробно расскажем далее.
Эксперимент Ханса Шпемана
В результате своих экспериментов доктор Шпеман выявил закономерность, что развитие происходит в строгой зависимости одних органов от других. Опыт проводился на тритонах. Шпеман пересадил со спины одного эмбриона в брюшную полость другого участок губы бластопора. В результате этого, на месте, куда пересадили орган, началось образование нового зародыша. В норме на брюшной полости никогда не образуется нервная трубка.
Исходя из опыта, доктор сделал вывод, что есть организаторы, которые влияют на дальнейшее развитие организма. Однако, организаторы могут дать старт только в том случае, если клетки обладают компетенцией. Что это значит? Под компетенцией подразумевается способность зародышевого материала к изменению своей презумптивной судьбы под воздействием разного рода влияний. При изучении индукционных взаимодействий у различных видов хордовых ученые пришли к выводу, что в областях и сроках компетенции различных организмов много индивидуальных особенностей. То есть организаторы действуют, если клетка способна принять индуктор, но у всех организмов тот или иной процесс происходит по-разному.
Сделаем вывод: развитие организма – это цепной процесс, без одной клетки невозможно образование другой. Эмбриональная индукция поэтапно определяет формообразование и дифференцировку органов. Также этот процесс является основой становления внешнего облика развивающейся особи.
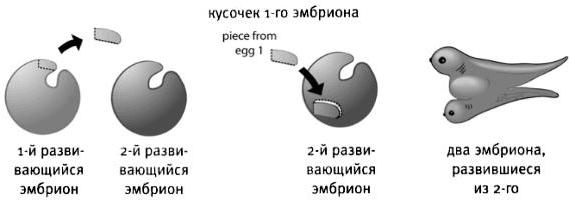
Исследования Хильды Мангольд
У Ханса Шпемана была аспирантка - Хильда Мангольд. Обладая удивительной ловкостью, она сумела провести ряд сложных экспериментов с микроскопическими эмбрионами тритона (1,5 мм в диаметре). Отделяя от одного зародыша маленький кусочек ткани, она пересаживала его на зародыш другого вида. Причем для пересадки она выбирала участки эмбриона, где происходило формирование клеток, из которых впоследствии должны были образоваться зародышевые листки. Эмбрион с пересаженной на него частичкой другого зародыша, успешно продолжал развиваться. А привитый кусочек ткани дал начало новому телу, наделенному спиной, позвоночником, брюшком и головой.
Какое же значение имели проведенные эксперименты? В ходе них Мангольд доказала что существовует эмбриональная индукция. Это возможно, потому что небольшой участок обладает этими уникальными свойствами, его назвали организатором.
Виды индукции
Различают два вида: гетерономную индукцию и гомономную индукцию. Что это такое и в чем отличие? Первый вид - это процесс, при котором пересаженная клетка вынуждена перестраиваться под общий ритм, то есть она зарождает какой-то новый орган. Второй провоцирует изменение окружающих клеток. Побуждает материал к развитию в этом же направлении.
Основные клеточные процессы
Для большей наглядности ниже приведена таблица. Предлагаем на ее примере изучить основные клеточные процессы эмбриональной индукции.
| Формы клеточных взаимодействий | Образование нормальных структур | Последствия нарушений |
| перемещения | образование нервной трубки при перемещении первичных половых клеток | нарушения при образовании нервной трубки, нарушение структуры |
| избирательное размножение | зачатки органов | отсутствие органов |
| избирательная гибель | разделение пальцев, гибель эпителиальных клеток при слиянии небных зачатков, носовых отростков и т.д. | расщелина неба, расщелина губы, лица, спинно-мозговые грыжи |
| адгезия | образование нервной трубки из нервной пластинки и т.д. | нарушения при образовании нервной трубки, нарушение структуры |
| сгущения | образование конечностей | отсутствие конечностей или наличие дополнительных |
Проявление данного явления обнаружили на самых разных этапах развития организма. В настоящее время эмбриональная индукция активно изучается.
Эмбриональная индукция — взаимодействие между частями развивающегося организма у многоклеточных беспозвоночных и всех хордовых.
Важную роль в эмбриогенезе играют контактные и дистантные взаимодействия.
Контактные взаимодействия – контакт как минимум 2-х бластомеров, являются условием для нормального развития зародыша. Обуславливают дальнейшую судьбу бластомеров, определяя направление перемещения клеточных слоёв, миграцию, подавление деления и т.д. (Сосед определяет судьбу рядом лежащих бластомеров).
Дистантные взаимодействия: в процессах эмбриональной индукции. Взаимодействие частей зародыша, при котором 1 участок определяет судьбу другого, побуждая его к делению. Явление эмбриональной индукции – опыты Грегора Шпемана на амфибиях (1924 г.).
(опыт из рабочей тетради №3)
. Межклеточные взаимодействия чрезвычайно важны в развитии и являются одним из механизмов, обеспечивающих интегрированность развития особи. Этот механизм действует на протяжении всего онтогенеза, но особую значимость имеет на ранних этапах эмбриогенеза, а именно, в период дробления.
Со стадии гаструляции, если в эксперименте у зародыша амфибии взять дорзальную губу бластопора и пересадить её другому зародышу амфибии, но не на спинную, а на вентральную (брюшную) сторону, то развивается 2-я нервная трубка (на брюшной стороне). Вывод: Дорзальная губа бластопора гаструлы у амфибии в норме индуцирует закладку нервной трубки (в норме на спинной/дорзальной стороне).
Для осуществления эмбриональной индукции необходимо:
· наличие индуцируемой структуры, отвечающей на действие индуктора;
· наличие состояния компетентности (способности воспринимать этот стимул).
Виды эмбриональной индукции:
· первичная: обнаруживается первой, при закладке нервной трубки;
· вторичная: проявляется на более поздней стадии, чем гаструляция, при закладке всех структур зародыша.;
· последующая: при закладке глазного яблока, почек; каждая новая структура последовательно играет роль индуктора;
· взаимная: при закладке конечностей.
Целостность онтогенеза. Эмбриональная регуляция. Детерминация частей развивающегося зародыша; канализация развития. Концепции морфогенеза (физиологических градиентов, позиционной информации, морфогенетических полей).
Целостность организма — его внутреннее единство, относительная автономность, несводимость его свойств к свойствам отдельных его частей, подчиненность частей целому — проявляется в течение всех стадий онтогенеза. Таким образом, онтогенез представляет собой упорядоченное единство последовательно чередующихся состояний целостности. В целостности индивидуального развития проявляется органическая целесообразность.
Целостность онтогенеза базируется на действии системно-регуляторных факторов: цитогенетических, морфогенетических, морфофизиологических, гормональных, а у большинства животных также нейрогуморальных. Эти факторы, действуя по принципу обратной связи, координируют ход развития и жизнедеятельность организма как активного целого в тесной связи с условиями окружающей среды.
Эмбриональная регуляция – явление восстановления нормального хода развития зародыша после естественного или искусственного его [развития] нарушения.
Детерминация (предопределение) – выбор конкретного пути развития, приобретение клетками способности развиваться в определенном направлении и одновременно ограничение их будущих возможностей развития. В начале эмбриогенеза бластомеры тотипотентны (могут дать начало целому организму) и их развитие зависит от внешних индукторов и соседних клеток. На более поздних стадиях клетки становятся более детерминированными (их развитие предопределено) и они развиваются по намеченному плану.
Процесс развития канализирован; он устойчив к внешним давлениям, которые могли бы заставить его отклониться от нормального пути. Если фенотипический продукт развития адаптивен, то можно предполагать, что отбор благоприятствовал канализированым генотипам, т. е. генотипам, которые приводят к развитию одного и того же признака в различных средах. Таким образом, канализация развития представляет собой консервативную силу в эволюции. Канализированное онтогенетическое развитие устойчиво к радикальному изменению. Генные мутации или рекомбинации, коренным образом изменяющие нормальное развитие, будут элиминироваться. Сохраниться могут только те генетически детерминированные изменения онтогенеза, которые означают относительно небольшие сдвиги в процессе развития.
Морфогенез — это процесс возникновения новых структур и изменения их формы в ходе индивидуального развития организмов. Морфогенез, как рост и клеточная дифференцировка, относится к ациклическим процессам, т.е. не возвращающимся в прежнее состояние и по большей части необратимым.
В настоящее время разрабатывают несколько подходов к проблеме регуляции и контроля морфогенеза:
Концепция физиологических градиентов - интенсивность жизненных процессов неодинакова в разных частях тела: она закономерно понижается по какой-либо оси тела или его органов (Ч. Чайлд). Основным показателем интенсивности жизненных процессов, по Чайлду, является уровень метаболизма, изучаемый по интенсивности окислительно-восстановительных процессов. По мнению автора, количественные различия в уровне метаболизма, или градиенты, имеют значение простейших систем, определяющих интеграцию тех организмов, у которых в эволюции не выработались еще или находятся в примитивном состоянии интеграционные механизмы более высокого порядка, как-то: нервная система, железы внутренней секреции и др. Ч. Чайлд открыл также, что верхний конец градиента является доминирующим. Выделяя некоторые факторы, он подавлял развитие таких же структур из других клеток зародыша. Наряду с подтверждающими имеются явления, которые не укладываются в упрощенную схему, и поэтому концепцию Чайльда нельзя рассматривать как универсальное объяснение пространственной организации развития.
Более современной является концепция позиционной информации, по которой клетка как бы оценивает свое местоположение в координатной системе зачатка органа, а затем дифференцируется в соответствии с этим положением. По мнению современного английского биолога Л. Вольперта, положение клетки определяется концентрацией некоторых веществ, расположенных вдоль оси зародыша по определенному градиенту. Ответ клетки на свое местоположение зависит от генома и всей предыдущей истории ее развития. По мнению других исследователей, позиционная информация есть функция полярных координат клетки. Существует также мнение о том, что градиенты представляют собой стойкие следы периодических процессов, распространяющихся вдоль развивающегося зачатка. Концепция позиционной информации позволяет формально интерпретировать некоторые закономерности онтогенетического развития, но она очень далека от общей теории целостности.
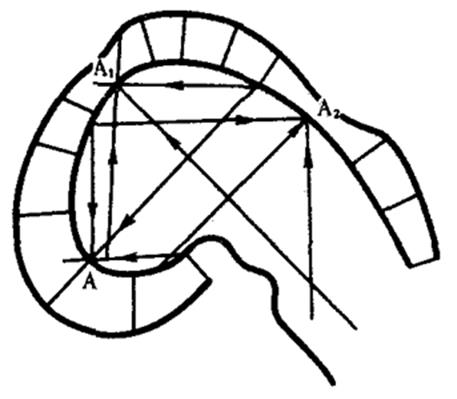
Концепция морфогенетических полей, базирующаяся на предположении о дистантных либо контактных взаимодействиях между клетками зародыша, рассматривает эмбриональное формообразование как самоорганизующийся и самоконтролируемый процесс. Предыдущая форма зачатка определяет характерные черты его последующей формы. Кроме того, форма и структура зачатка способны оказать обратное действие на биохимические процессы в его клетках. Наиболее последовательно эту концепцию разрабатывал в 20—30-х гг. отечественный биолог А. Г. Гурвич, предложивший впервые в мировой литературе математические модели формообразования. Он, например, моделировал переход эмбрионального головного мозга из стадии одного пузыря в стадию трех пузырей.
Модель исходила из гипотезы об отталкивающих взаимодействиях между противоположными стенками зачатка. На рис. 8.17 эти взаимодействия отображены тремя векторами (А, А1, А2). Гурвич впервые указал также на важную роль неравновесных надмолекулярных структур, характер и функционирование которых определяются приложенными к ним векторами поля. В последние годы К. Уоддингтон создал более обобщенную концепцию морфогенетического векторного поля, включающую не только формообразование, но и любые изменения развивающихся систем.
Влияние факторов среды на онтогенез. Критические периоды в онтогенезе человека. Тератогенез и канцерогенез. Понятие аномалий и пороков развития. Значение нарушений частных и интегративных механизмов онтогенеза в формировании ВПР.
Среди факторов среды различают:
Под биологическими факторами понимают взаимодействие живых организмов. Абиологические факторы - это факторы неживой природы (климат и пр.).
Факторы могут быть:
Однако даже при кратковременном воздействии они могут оказать весьма существенное влияние на развитие организма.
Онтогенез представляет собой последовательное развитие, при котором ранее образовавшиеся структуры обусловливают развитие последующих, причем и эта тенденция проявляется в единстве с условиями среды. При одном и том же генотипе развиваются различные фенотипические особенности. Однако совершенно очевидно, что в фенотипе не может быть ни одного признака, который не был бы обусловлен генотипом. Из этого вытекает, что именно противоречивое единство внутренних и внешних факторов определяет развитие организма.
Критические периоды эмбриогенеза человека – зародыш наиболее чувствителен к действию факторов внешней среды, т.к. изменяются условия его существования (включаются новые блоки генов):
· Имплантация (6-7 сутки после оплодотворения);
· Плацентация (14-15 сутки после оплодотворения);
Действие неблагоприятных факторов среды в эти периоды развития приводит к порокам развития данных систем.
Тератогенез - это возникновение пороков развития под влиянием факторов внешней среды (тератогенных факторов). Тератогенные факторы включают лекарственные средства, наркотики и многие другие вещества.
Канцерогенез – это процесс появления злокачественной клетки.
Пороки развития (синоним аномалии развития) — собирательный термин, обозначающий отклонения от нормального строения организма вследствие нарушения внутриутробного или постнатального (реже) развития.
Эти изменения вызывают нарушения соответствующих функций. Под аномалиями развития и понимают только такие пороки, при которых анатомические изменения не приводят к существенному нарушению функций, например деформации ушных раковин, не обезображивающие лица больного и существенно не отражающиеся на восприятии звуков. Грубые пороки развития, при которых обезображивается внешний облик ребенка, нередко называют уродствами.
1) эндогенные (внутренние) факторы:
а) изменения наследственных структур (мутации);
б) "перезревание" половых клеток; в) эндокринные заболевания;
г) влияние возраста родителей;
2) экзогенные (внешние) факторы:
а) физические - радиационные, механические воздействия;
б) химические - лекарственные препараты, химические вещества, применяемые в промышленности и в быту, гипоксия, неполноценное питание, нарушения метаболизма;
в) биологические - вирусные заболевания, протозойные инвазии, изоиммунизация.
Механизмы.
Формирование пороков происходит преимущественно в период эмбрионального морфогенеза (3-10-я неделя беременности) в результате нарушения процессов размножения, миграции, дифференциации и гибели клеток. Эти процессы происходят на внутриклеточном, экстраклеточном, тканевом, межтканевом, органном и межорганном уровнях. Нарушением размножения клеток объясняют гипоплазию и аплазию органов. Нарушение их миграции лежит в основе гетеротопий. Задержка дифференциации клеток обусловливает незрелость или персистирование эмбриональных структур, а ее полная остановка - аплазию органа или его части. Нарушение физиологической гибели клеток, как и нарушение механизмов адгезии ("склеивание" и срастание эмбриональных структур), лежат в основе многих дизрафий (например, спинномозговых грыж).
Врожденные аномалии и пороки развития. Определение, классификация, механизмы возникновения: гаметопатии, бластопатии, эмбриопатии, фетопатии, механизмы и причины их возникновения. Примеры.
Врожденный порок развития – это любое стойкое анатомическое отклонение в развитии органа или части тела, возникающее в результате воздействия тератогенных факторов или генетических мутаций (подробнее см. предыдущий вопрос).
Классификация.
Выделяют несколько групп пороков. В зависимости от времени воздействия вредных факторов и объекта поражения выделяют следующие формы пороков развития:
· Бластопатия - патология бластоцисты, возникающая в период нидации и дробления в первые 15 дней от момента оплодотворения до выделения эмбрио- и трофобласта. Причиной бластопатии чаще всего являются хромосомные аберрации в сочетании с влияниями среды (эндокринные заболевания матери, гипоксия и др.). Патогенез зависит от вида поражения бластоцисты. Так, например, патогенез двойниковых уродств связан с появлением во время дробления двух или более самостоятельно растущих центров. Полагают, что если эти центры разобщены друг с другом, то развиваются два независимо растущих однояйцевых близнеца, нормальное развитие которых не следует относить к бластопатиям. Если центры роста расположены близко и имеют общую для двух близнецов промежуточную зону, то развиваются два сросшихся близнеца. В обоих случаях возможно развитие симметричных и асимметричных близнецов;
· Эмбриопатия - патология эмбрионального периода с 16-го дня беременности до 75-го дня включительно, в течение которого заканчивается основной органогенез и формирование амниона и хориона. К основным видам эмбрионатий относят врожденные пороки развития (аплазии, гиперплазии и пр.);
· Фетопатии - общее название болезней плода, возникающих с начала 4-го лунного месяца (11-я неделя) внутриутробного развития, проявляющихся аномалиями развития или врожденными болезнями, нередко заканчивающихся асфиксией плода и обусловливающих преждевременные роды (фетопатии вирусные – обусловленные вирусной инфекцией в организме матери; фетопатии туберкулезные – обусловленные заражением плода микобактериями туберкулеза и пр.);
Понятие о гомеостазе. Общие закономерности гомеостаза живых систем. Генетические, клеточные и системные основы гомеостатических реакций организма. Роль эндокринной и нервной систем в обеспечении гомеостаза адаптивных реакций.
Гомеостаз - способность организма поддерживать относительное постоянство внутренней среды (крови, лимфы, межклеточной жидкости).
· Нестабильность системы: тестирует, каким образом ей лучше приспособиться;
· Стремление к равновесию: вся внутренняя, структурная и функциональная организация систем способствует сохранению баланса;
· Непредсказуемость: результирующий эффект от определённого действия зачастую может отличаться от того, который ожидался.
Уровни:
· Клеточный уровень: установление гомеостаза клеточной среды обеспечивается мембранными системами, с которыми связаны биоэнергические процессы и регулирование транспорта веществ в клетку и из нее;
· Генетический уровень: считывание генетической информации должно происходить без ошибок, это и обеспечивает нормальный гомеостаз (генный контроль тринадцати факторов свертывания крови, генный контроль гистосовместимости тканей и органов, позволяющий возможность трансплантации);
· Системный уровень: обеспечивается взаимодействием важнейших регуляторных систем: нервной, эндокринной и иммунной.
Роль эндокринной системы: гормоны оказывают влияние на обменные процессы, обеспечивающие гомеостаз. Для сохранения гомеостаза необходимо уравновешение функциональной активности железы с концентрацией гормона, находящегося в циркулирующей крови.
Роль нервной системы: быстрое наступление ответной реакции, регуляция работы эндокринной системы, которая, в свою очередь, влияет на гомеостаз.
Читайте также:

