Значение водородных связей для биологических систем реферат
Обновлено: 17.05.2024
Значение водородной связи , которая широко распространена, велико в биологических и химических процессах. Существование Н - связи в воде определяет благоприятные условия для жизни на Земле. Эта связь существенна для структуры белков и многих других веществ, необходимых для всего живого. Возможность образования Н - связи параллельно с обычными валентными связями необходимо всегда учитывать при изучении строения веществ и их реакционной способности. Возникновение Н - связей, которое облегчает перенос протона, имеет существенное значение в кислотно-основном катализе, окислительно-восстановительных и многих подобных и важных в науке и технике процессах. Не случайно так многочисленны в последние годы исследования, посвященные вопросам природы и механизма действия водородной связи. [1]
О значении водородной связи в процессе крашения свидетельствует тот факт, что в молекулах всех красителей содержится атом азота и ( или) атом кислорода. Наличие неподеленных электронов у этих атомов и амино -, азо -, окси -, карбоксильных, амидиых и других группах в значительной мере определяет сродство красителей к целлюлозе. Поэтому субстантивность красителя прежде всего определяется числом и прочностью водородных связей, в образовании которых краситель участвует. Однако для того чтобы молекулы красителя могли приблизиться к тем местам в структуре целлюлозы, в которых эти связи могут возникнуть, молекула красителя должна обладать определенными формами и размерами. [3]
Фишер-Бобзин [1420] подробно разбирает значение водородных связей в процессах набухания и крашения волокон. Вюрц [1357] приводит данные о связи между химическим строением и окрашивае-мостью синтетических волокон. [4]
Ее постоянство в широком интервале значений водородных связей оказывается совершенно противоположным тому, что мы наблюдали для силовых постоянных ОН-связей, величина изменений которых под влиянием Н - связей оказывается очень значительной. Она почти на порядок превышает силовые постоянные самих Н - связей и поэтому является определяющей в наблюдаемом на опыте смещении VQH-ПОЛОС. [5]
Необходимо упомянуть и о другой точке зрения на значение водородной связи . На основании спектроскопического изучения низкомолекулярных соединений, моделирующих ПВХ, Леш и Ульбрих [40] пришли к заключению, что водородная связь не может играть заметной роли во взаимодействии ПВХ с растворителями. [6]
В монографии освещаются современные представления о молекулярной, надмолекулярной и биоморфологической структуре целлюлозы, особенностях ее различных структурных модификаций, роли и значении водородных связей в них. Рассматриваются пути глубоких структурных изменений в целлюлозе за счет донорно-акцепторных взаимодействий с молекулами различных сред для ослабления общего межмолекулярного взаимодействия в структуре целлюлозы, увеличения внутренней поверхности и доступности ее для различных реакционных сред, увеличения активности в О-гетероцикле элементарных звеньев целлюлозных молекул и гидроксильных групп в процессах химического реагирования. Показана неразрывная связь структуры и реакционной, способности целлюлозы, перспективность использования эффективных методов активации целлюлоз для получения производных целлюлозы с ценными свойствами. [7]
Усиление флюоресценции при образовании комплекса приписывают возникновению водородных связей, в которых принимает участие карбонил тропонового цикла и водорода белковой части комплекса. Значение водородных связей для возникновения комплекса подтверждается отрицательным влиянием мочевины на флюоресценцию. [8]
Водородная связь играет важную роль в неорганической и органической химии. Низкая энергия водородной связи, способность легко разрушаться и восстанавливаться при комнатной температуре вместе с ее огромной распространенностью обусловливает значение водородной связи в биологических системах. Упорядоченное расположение полипептидных цепей в структуре белка, поперечные связи в структуре целлюлозы и в двойной спирали дезоксирибонуклеиновой кислоты ( ДНК) объясняются наличием водородной связи. Кроме того, доказано образование водородной связи на некоторых стадиях почти всех биохимических процессов. [9]
Микрофотографии таких срастаний приведены Брэггом ( W. L. Bragg, Atomic Structure of Minerals, Ithaca, N. Дипольные свойства органического вещества имеют решающее значение для образования срастаний, О значении водородной связи между атомами кислорода см. также J. Willems [373], 31, 1943, 146, 147, 232, 233 301, 302, 319 и 320; но главным образом следует см. 32, 1944, 324 - 333; [605], 105, 1943, 53 - 68, 144 - 148; о функциональном виде связи в кристаллах, служащих суппортом ( см. А. [10]
Представления об участии атома водорода в образовании двух химических связей (а не одной, как соответствовало бы его классической валентности) появились в конце XIX века (Ильинский, 1887 год) и начале XX века (Мур и Винмил, 1912 год; Хаггинс, 1919 год). Дальнейшее достаточно быстрое накопление экспериментальных данных, для объяснения которых эти представления оказались полезными, позволило… Читать ещё >
Водородная связь и ее роль в биологических системах ( реферат , курсовая , диплом , контрольная )
Содержание
- Введение
- Сущность и особенности водородной связи
- Растворимость органических веществ
- Водородная связь в полимерах
- Водородная связь в биологических системах
- Заключение
- Список литературы
Представления об участии атома водорода в образовании двух химических связей (а не одной, как соответствовало бы его классической валентности) появились в конце XIX века (Ильинский, 1887 год) и начале XX века (Мур и Винмил, 1912 год; Хаггинс, 1919 год). Дальнейшее достаточно быстрое накопление экспериментальных данных, для объяснения которых эти представления оказались полезными, позволило не только привыкнуть к самому факту наличия водородной связи, но и дать некоторые разъяснения, по каким причинам она возникает, почему такого типа связь наиболее широко распространена именно для водородсодержащих соединений и не столь часто встречается у соединений, в которых соответствующие атомы водорода заменены на другие, например на атомы щелочных металлов.
Водородную связь относят к числу слабых химических взаимодействий. Энергия водородной связи обычно лежит в пределах от 10 до 30 кДж/моль, хотя иногда она достигает и сотен кДж/моль. Энергии обычных химических связей (ковалентных и ионных), как правило, заметно превышают 150 кДж/моль, достигая, например, для молекул азота или оксида углерода величин 900 кДж/моль и более. Тем не менее, за последние полвека появилось четкое понимание исключительной роли слабых взаимодействий, прежде всего роли водородных связей в стабилизации конденсированных состояний многих простых молекулярных систем, например воды, и, что самое существенное, в стабилизации биополимеров (нуклеиновых кислот, белков). Водородные связи позволяют полимерным цепям соединяться в специфические трехмерные структуры, приобретающие при этом функциональную биологическую активность, структуры, с одной стороны достаточно прочные (за счет образования большого числа водородных связей), а с другой достаточно чутко реагирующие на изменение внешних условий (например, приближение той или иной молекулы) именно из-за того, что эти взаимодействия являются слабыми. Разрыв таких связей лишает белки или нуклеиновые кислоты их биологических функций. Отсюда, в частности, видна исключительно важная роль водородных связей, которую они играют в биологических процессах на молекулярном уровне. Понятно и то важное значение исследований и понимания природы водородных связей, которым в последние десятилетия было уделено столь пристальное внимание ученых различных направлений.
Представления об участии атома водорода в образовании двух химических связей (а не одной, как соответствовало бы его классической валентности) появились в конце XIX века (Ильинский, 1887 год) и начале XX века (Мур и Винмил, 1912 год; Хаггинс, 1919 год). Дальнейшее достаточно быстрое накопление экспериментальных данных, для объяснения которых эти представления оказались полезными, позволило не только привыкнуть к самому факту наличия водородной связи, но и дать некоторые разъяснения, по каким причинам она возникает, почему такого типа связь наиболее широко распространена именно для водородсодержащих соединений и не столь часто встречается у соединений, в которых соответствующие атомы водорода заменены на другие, например на атомы щелочных металлов.
Содержимое работы - 1 файл
Введение.docx
Представления об участии атома водорода в образовании двух химических связей (а не одной, как соответствовало бы его классической валентности) появились в конце XIX века (Ильинский, 1887 год) и начале XX века (Мур и Винмил, 1912 год; Хаггинс, 1919 год). Дальнейшее достаточно быстрое накопление экспериментальных данных, для объяснения которых эти представления оказались полезными, позволило не только привыкнуть к самому факту наличия водородной связи, но и дать некоторые разъяснения, по каким причинам она возникает, почему такого типа связь наиболее широко распространена именно для водородсодержащих соединений и не столь часто встречается у соединений, в которых соответствующие атомы водорода заменены на другие, например на атомы щелочных металлов.
Водородную связь относят к числу слабых химических взаимодействий. Энергия водородной связи обычно лежит в пределах от 10 до 30 кДж/моль, хотя иногда она достигает и сотен кДж/моль. Энергии обычных химических связей (ковалентных и ионных), как правило, заметно превышают 150 кДж/моль, достигая, например, для молекул азота или оксида углерода величин 900 кДж/моль и более. Тем не менее, за последние полвека появилось четкое понимание исключительной роли слабых взаимодействий, прежде всего роли водородных связей в стабилизации конденсированных состояний многих простых молекулярных систем, например воды, и, что самое существенное, в стабилизации биополимеров (нуклеиновых кислот, белков). Водородные связи позволяют полимерным цепям соединяться в специфические трехмерные структуры, приобретающие при этом функциональную биологическую активность, структуры, с одной стороны достаточно прочные (за счет образования большого числа водородных связей), а с другой – достаточно чутко реагирующие на изменение внешних условий (например, приближение той или иной молекулы) именно из-за того, что эти взаимодействия являются слабыми. Разрыв таких связей лишает белки или нуклеиновые кислоты их биологических функций. Отсюда, в частности, видна исключительно важная роль водородных связей, которую они играют в биологических процессах на молекулярном уровне. Понятно и то важное значение исследований и понимания природы водородных связей, которым в последние десятилетия было уделено столь пристальное внимание ученых различных направлений.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H•••[F-H•••F]-).
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+ образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
Водородная связь в полимерах
Этот факт нашел важное техническое применение, ацетилен, находящийся под давлением, очень чувствителен к легким сотрясениям и легко взрывается, а его раствор в ацетоне под давлением безопасен в обращении.
Важную роль играют водородные связи в полимерах и биополимерах. В целлюлозе – основном компоненте древесины – гидроксильные группы, расположены в виде боковых групп полимерной цепи, собранной из циклических фрагментов. Несмотря на сравнительно слабую энергию каждой отдельной Н-связи, их взаимодействие на всем протяжении полимерной молекулы приводит к столь мощному межмолекулярному взаимодействию, что растворение целлюлозы становится возможным лишь при использовании экзотического высокополярного растворителя – реактива Швейцера (аммиачный комплекс гидроксида меди).
В полиамидах (капрон, нейлон) Н-связи возникают между карбонильными и аминогруппами >С=О···Н–N
Это приводит к образованию кристаллических областей в структуре полимера и увеличению его механической прочности.
То же самое происходит в полиуретанах, имеющих строение, близкое к полиамидам:
Образование кристаллических областей и последующее упрочнение полимера происходит благодаря образованию Н-связей между карбонильными и аминогруппами >С=О···Н–N
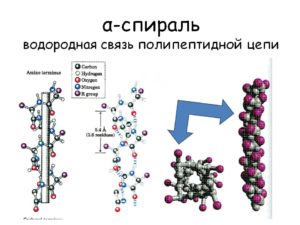
Аналогичным образом происходит объединение параллельно уложенных полимерных цепочек в белках, однако Н-связи предоставляют белковым молекулам также иной способ упаковки – в виде спирали, при этом витки спирали закреплены все теми же водородными связями, возникающими между карбонильной и аминогруппой.
Молекулы внутри вещества взаимодействуют друг с другом. Это осуществляется с помощью межмолекулярных взаимодействий, возникающих среди нейтральных молекул без образования ковалентных связей. К ним относятся водородные связи, которые также могут быть представителями внутримолекулярных взаимодействий.
Что такое водородные связи?
Водородная связь – связь, которая формируется между водородом и молекулами с сильнополярными связями (H-F, H-O, H-N). Она обеспечивает дополнительные межмолекулярные силы притяжения и увеличивает устойчивость вещества. Обозначается точками: Н ··· O.

Создание водородной связи отличается от других связей. Она формируется одновременно по обменному и донорно-акцепторному механизму. Роль донора играет электроотрицательный элемент, а акцептора – водород. Чем выше электроотрицательность, тем больше устойчивость вещества.
Водородная связь свойственна для многих веществ:
- плавиковая кислота;
- вода;
- аммиачный раствор;
- органические соединения с группировками О-Н и N-H.
Образованием водородных связей можно объяснить изменение свойств веществ. Например, она повышает температуру кипения и плавления.
Биологическая роль водородных связей
Полимерные цепи с помощью водородных связей формируют объемные структуры, которым характерна высокая биологическая активность. Химические взаимодействия возникают из-за электростатических взаимоотношений разноименных зарядов частиц в веществе. Разрыв водородных связей в белках или нуклеиновых кислотах лишает нативных свойств.
Многие полимеры укреплены с помощью водородных связей. В нейлоне они играют главную роль при кристаллизации материала. Также они присутствуют в древесине, хлопке, льне, целлюлозе и других соединениях.
В какой структуре белка появляются водородные связи?
Водородные связи укрепляют белки и нуклеиновые кислоты во вторичной и третичной структурах. Они позволяют макромолекулам принимать определенную форму. Биологическое значение водородной связи заключается в образовании спиральных структур нуклеиновой кислоты ДНК, которая обеспечивается попарным расположением нуклеотидов.
В белках есть два варианта образования связей между:
- пептидными группами;
- боковыми радикалами полярных аминокислот.
Водородные связи формируются с помощью ван-дер-ваальсовых сил разноименных полюсов диполя. Первичная структура белков образуется с помощью пептидных связей. Пространственная структура основывается на водородных и ионных связях, ван-дер-ваальсовых силах, гидрофобных взаимодействиях. Водородные связи пептидных групп образуют вторичную структуру белков. Формирование третичной и четвертичной структур осуществляется водородными связями, образующимися между радикалами полярных аминокислот, ионными взаимодействиями, ван-дер-ваальсовыми силами, гидрофобными взаимодействиями.
Водородные связи позволяют полимерным цепям соединяться в специфические трехмерные структуры, приобретающие при этом функциональную биологическую активность, структуры, с одной стороны достаточно прочные (за счет образования большого числа водородных связей), а с другой — достаточно чутко реагирующие на изменение внешних условий (например, приближение той или иной молекулы) именно из-за того, что эти взаимодействия являются слабыми.
Разрыв таких связей лишает белки или нуклеиновые кислоты их биологических функций. Отсюда, в частности, видна исключительно важная роль водородных связей, которую они играют в биологических процессах на молекулярном уровне. Понятно и то важное значение исследований и понимания природы водородных связей, которым в последние время было уделено столь пристальное внимание ученых различных направлений.
Общей причиной возникновения водородной связи, как, впрочем, и других выделяемых обычно типов химических связей, является главным образом электростатическое, кулоновское взаимодействие разноименных зарядов тех частиц, которые образуют молекулу. Правда, это взаимодействие отличается от того, которое встречается в классической теории, поскольку оно не определяется только лишь плотностью распределения положительного и отрицательного зарядов, а выражается более сложным образом с помощью волновых функций, определяющих состояния молекулярной системы. Поэтому естественно стремление найти некоторые более простые образы, которые давали бы возможность наглядно представить себе, как же все-таки образуется химическая связь.
Водородная связь по своему происхождению не представляет собой нечто отличающееся от того, что характерно для химических связей вообще. Ее определяют главным образом поляризация электронного распределения в мономерных звеньях (в общем случае в молекулах, образующих такую связь) и отличная от мономерных звеньев динамика колебательного движения атомов в водородно-связанном фрагменте. Пристальное внимание к изучению систем с водородными связями давно уже определяется не спецификой этой связи как таковой, а широкой распространенностью водородных связей, особенно в биологических объектах, и той важной ролью, которую они играют в биополимерах и жизненно важных процессах с их участием.
Примеры соединений с водородной связью

Во многих случаях, когда имеется сильная связь между молекулами или разными группами одной и той же молекулы, эту связь можно приписать атомам водорода, проявляющим двухвалентный характер. Таковы, например, димеры алифатических кислот, ион дифторида и димер HF, структура которых приведена на рисунке 1.1.

Рисунок 1.1 Некоторые примеры структур с водородной связью
Водород служит в качестве связующего атома в другом важном классе соединений – бороводородах. Простейшим членом этого семейства является диборан (В2 Н6 ). Однако бороводороды обычно не рассматривают в качестве соединений с водородной связью, так как их нельзя разбить на фрагменты, представляющие собой стабильные молекулы. Рассмотрим эти соединения лишь для того, чтобы сопоставить их с комплексами с водородной связью.
Бороводороды были названы электронодефицитнымимолекулами (термин электронодефицитный в применении к бороводородам не совсем оправдан, так как во всех случаях электронов достаточно для заполнения всех связывающих молекулярных орбиталей), так как они не имеют достаточно электронов для образования того количества двухэлектронных связей, которое, по-видимому, подразумевается их молекулярной геометрией. Диборан имеет восемь связей В–Н, но только четырнадцать валентных электронов. Расчеты на основе метода молекулярных орбиталей показывают, что концевые связи представляют собой нормальные двухэлектронные связи, а мостиковые связи следует описывать как трехцентровые двухэлектронные связи.
Описание на основе метода молекулярных орбиталей иона дифторида полностью отличается от описания диборана, поскольку для образования мостиковых связей здесь имеются четыре электрона. Равновесная конфигурация молекулы линейная, причем водород находится посредине отрезка F–F. Две наивысшие заполненные молекулярные орбитали образованы в основном 2p σ -орбиталями фтора п ls -орбиталями водорода с некоторой добавкой 2s -орбиталей фтора. Низшая из двух орбиталей имеет симметрию σ g и является связывающей для всех трех атомов. Более высокая орбиталь σ u (ее узел приходится на атом водорода) – разрыхляющая по отношению к атомам фтора. Однако атомы фтора достаточно удалены друг от друга, так что разрыхляющий эффект мал, и орбиталь σ u имеет отрицательную энергию (т. е. связывает электроны), что обусловлено большой электроотрицательностью атома фтора.
Можно преобразовать σ g — и σ u -орбитали в эквивалентные орбитали θ1 = σ g + σ u и θ2 = σ g – σ u , локализованные на двух связях F–Н, что демонстрирует отличие от мостиков в бороводородах, орбитали которых не могут быть локализованы на связях.
Ион дифторида не типичен для соединений с водородными связями в том отношении, что атом водорода расположен посредине между двумя тяжелыми атомами. Обычно энергии водородных связей намного меньше, чем для иона дифторида, а водород более тесно связан с одним из атомов, чем с другим, как в димере муравьиной кислоты (рис. 1.1). В действительности геометрия двух компонентов, составляющих комплекс, немного отличается от их геометрии в изолированных состояниях.
Таблица 1.1 Энергии димеризации некоторых газофазных димеров с водородной связью
| Димер | Энергия димеризации, кДж/моль -1 |
| (HF)2 | 29±4 |
| (H2 O)2 | 22±6 |
| (NH3 )2 | 19±2 |
| (HCl)2 | 9±1 |
| (H2 S)2 | 7±1 |
Димер HF
Геометрическая конфигурация, колебания, энергия связи
На рисунке 1.2 изображена равновесная геометрическая конфигурация комплекса, одновременно и понятная и непредсказуемая. Все четыре атома располагаются в одной плоскости. Расстояния между атомами фтора и водорода, относящиеся к составным (мономерным) частям комплекса Fb –Hb и Ff –Hf , равны соответственно 0,922 и 0,920 Å и мало отличаются от равновесного расстояния 0,917 Å в молекуле HF. Расстояние между атомами Hb …Ff равно 1,82 Å, что характерно для водородной связи. Расположение всех трех участников водородной связи Fb –Hb …Ff близко к линейному. Это все предсказуемые черты межмолекулярного комплекса с водородной связью. Непредсказуемыми из простых принципов оказываются значения углов θ1 = 7 ̊ (между направлениями Fb Ff и Ff Hb) и θ2 = 69 ̊ (Fb Ff и Ff Hf ).

Рисунок 1.2 Равновесная геометрическая конфигурация комплекса (HF)2
Читайте также:

