Волновые функции и квантовые числа реферат
Обновлено: 04.07.2024
– это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Квантовые числа необходимы для описания состояния каждого электрона в атоме. Всего 4-ре квантовых числа. Это: главное квантовое число – n, орбитальное квантовое число – l, магнитное квантовое число – ml и спиновое квантовое число – ms.
Главное квантовое число – n.
Главное квантовое число – n – определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
Орбитальное квантовое число – l.
Орбитальное квантовое число – l – определяет геометрическую форму атомной орбитали. Орбитальное квантовое число принимает любые целочисленные значения, начиная с l=0 (l=0,1,2,3,…n-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы. Значению орбитального квантового числа l=0 соответствует s-орбиталь (1-ин тип). Значению орбитального квантового числа l=1 соответствуют p-орбитали (3-ри типа). Значению орбитального квантового числа l=2 соответствуют d-орбитали (5-ть типов). Значению орбитального квантового числа l=3 соответствуют f-орбитали (7-мь типов).
Значение орбитального квантового числа – l.
Типы орбитали.
Количество типов орбитали.
s-орбиталь
p-орбитали
d-орбитали
f-орбитали
f-орбитали имеют ещё более сложную форму. Каждый тип орбитали – это объём пространства, в котором вероятность нахождения электрона – максимальна.
Магнитное квантовое число – ml.
Магнитное квантовое число – ml – определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от –l до +l, включая 0. Это означает, что для каждой формы орбитали существует 2l+1 энергетически равноценных ориентаций в пространстве – орбиталей.
l=0, m=0 – одна равноценная ориентация в пространстве (одна орбиталь).
l=1, m=-1,0,+1 – три равноценные ориентации в пространстве (три орбитали).
l=2, m=-2,-1,0,1,2 – пять равноценных ориентаций в пространстве (пять орбиталей).
l=3, m=-3,-2,-1,0,1,2,3 – семь равноценных ориентаций в пространстве (семь орбиталей).
Спиновое квантовое число – ms.
Спиновое квантовое число – ms – определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и –1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона – спинам. Для обозначения электронов с различными спинами используются символы: и .
Если Вам нужна помощь с академической работой (курсовая, контрольная, диплом, реферат и т.д.), обратитесь к нашим специалистам. Более 90000 специалистов готовы Вам помочь.
Поможем написать работу на аналогичную тему
Похожие рефераты:
Моноциклические полиены и донорно-акцепторные соединения. Молекулярные орбитали дважды-вырожденного уровня треугольного цикла. Гибридизация орбиталей - модельный случай у плоского ротатора. Уровни МО молекулы СО в различных приближениях метода МО ЛКАО.
Теория многоэлектронного атома. Атом H и водородоподобный ион. Возмущение потенциала и расщепление уровней АО. Правило Маделунга-Клечковского. Порядок учёта кулоновских взаимодействий. Микросостояния и атомные термы в приближении Рассела-Саундерса.
Энергетические уровни жесткого ротатора и его спектр. Волновые функции жёсткого ротатора. Разделение переменных. Интегрирование уравнения. Постоянная интегрирования, определяемая из условия нормировки. Общая формулы сферических волновых функций.
Решение задач о квантовании момента количества движения пространственного ротатора и его свойства. Соотношения, касающиеся момента импульса и его проекций. Определение квадрата модуля момента импульса и вывод формулы сферических волновых функций.
Электростатическая связь: виды взаимодействий. Свойства ковалентных связей (длина, полярность и энергия). Средняя величина дипольных моментов связей и функциональных групп. Строение метана. Строение молекул с n, o-атомами с неподеленной парой электронов.
Теория строения атома: микрочастица и волна. Явление дифракции электромагнитного излучения и волновая природа атома: подтверждение гипотезы де Бройля. Уравнение Шредингера и волновая функция. Физическая основа структуры периодической системы элементов.
Представление о строении метана (молекулярная, электронная и структурная формулы). Физические свойства, нахождение в природе, тип химической связи и пространственное строение молекулы и атома углерода в трёх валентных состояниях, понятие гибридизации.
Основы квантовой механики и строение атома. Корпускулярные и волновые свойства света. Волновые и корпускулярные свойства материи. Волны материи (волны де Бройля). Квантование энергии. Длина волны, волновое число, частота и энергия спектрального перехода.
Двухэлектронный коллектив на примере атома гелия. Волновые функции коллектива. Перестановочная симметрия. Спиновые волновые функции. Обозначение электронной конфигурации. Орбитальные состояния. Принцип минимума энергии. Орбитальное приближение.
Реферат по химии на тему "Строение атома" Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако д.
Сущность и применение методов оптической спектроскопии. Зависимость поглощения света веществом от электролитической структуры молекул. Определение и характеристика групп атомов, обуславливающих поглощение в видимой и ультрафиолетовой областях спектра.
Координационная связь (связь металл-лиганд). Октаэдрический комплекс. Идея "оптимального" взаимодействия между реагентами и катализатором. Гетерогенный катализ. Интермедиат в каталитическом процессе. Комплексы, их классификация, понятия и определения.
Микросостояния и атомные термы в приближении Рассела-Саундерса, их систематизация. Порядок учёта кулоновских взаимодействий и постадийная классификация дискретных электронных уровней и состояний атома. Термы нормальные и обращённые. Правила Хунда.
Протоны и нейтроны как составляющие атомного ядра. Атомный номер элемента. Изотопы, ядерная и квантово-механическая модели атома. Волновые свойства электрона. Одноэлектронные и многоэлектронные атомы, квантовые числа. Электронная конфигурация атома.
Вращательные движения определяют важнейшие черты стационарных состояний электронных оболочек и ядер, aтомов и молекул. Гибридизация – смешение состояний с различными значениями момента импульса. Совместные измерения динамических переменных и коммутация.
Составление формул соединений кальция с водородом, фтором и азотом. Определение степени окисления атома углерода и его валентности. Термохимические уравнения реакций, теплота образования. Вычисление молярной концентрации эквивалента раствора кислоты.
Квантово-механическая модель, применяемая для исследования сферического вращения. Понятие одноэлектронных атомов. Компоненты лапласиана в шаровых координатах. Гамильтониан и уравнение Шрёдингера для одноэлектронных состояний и водородоподобного иона.
Уравнение Шрёдингера для простейшей схемы одноэлектронной теории. Система приближений. Базис и его свойства. Базисные функции. Эффективный гамильтониан. Простейшее упрощение молекулярного гамильтониана. Математическая схема квантовой механики по Дираку.
Основные условия образования химической связи. Потенциал ионизации. Ковалентная связь. Перекрывание атомных орбиталей. Процесс смещения электронной пары к наиболее электроотрицательному атому. Координационная связь. Межмолекулярное взаимодействие.
Электронные орбитали атомов, молекул. Межэлектронное отталкивание. Заряд экранирования. Функции Слэтера-Ценера. Одноэлектронное приближение. Одноэлектронный гамильтониан. Модель экранирования (по Ферми). Правило Клечковского. Орбитальная энергия оболочки.
Согласно этой модели, атом состоит из тяжёлого положительно заряженного ядра очень малых размеров (~ 10 -15 м ), вокруг которого по некоторым орбитам движутся электроны. Радиусы этих орбит имеют размеры ~ 10 -10 м .
Наличие у электрона заряда делает планетарную модель противоречивой с точки зрения классической физики, т.к. вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица должен излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным. В опытах наблюдается линейчатый спектр излучения атомов. Кроме того, непрерывное излучение уменьшает энергию электрона, и он из-за уменьшения орбиты обязан был бы упасть на ядро.
Постулаты Нильса Бора
1. Электрон в атоме может двигаться только по определённым стационарным орбитам с определённым номером п = 1; 2; 3; … Движущийся по стационарной замкнутой орбите электрон обладает неизменной полной энергией Еп .
2. Разрешёнными стационарными орбитами являются только те, для которых угловой момент импульса электрона равен целому кратному значению постоянной Планка
3. Испускание или поглощение кванта излучения происходит при переходе атома из одного стационарного состояния в другое.
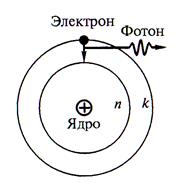
Расчёт атома водорода по Н.Бору
те - масса электрона
Решая систему из этих двух уравнений получаем:
, где а = 0,529 . 10 -10 м - радиус 1-ой стационарной
орбиты электрона в атоме водорода
Кинетическая энергия электрона
Потенциальная энергия электрона
Полная энергия электрона на п-ой орбите
Для частоты излучения при переходе из к в п состояние получаем
, где - постоянная Ридберга
Существуют также постоянные Ридберга для ν и λ :
Для водородоподобных атомов ( ион гелия Не + с Z = 2, двухкратно- ионизованный литий Li ++ c Z = 3, трёхкратноионизованный бериллий Ве +++ с Z = 4 и т.д. ) радиусы орбит электрона оказываются в Z раз меньше, чем в атоме водорода, а энергетический спектр водородоподобного иона получается умножением на Z 2
Квантовая теория атома
Хотя теория Бора даёт хорошие результаты для водородоподобных атомов, она не может рассматриваться как законченная теория атомных явлений.
С позиций современной физики атом является физической системой, которая заведомо не может быть описана классической теорией, не учитывающей волновых свойств движущегося в атоме электрона, так как длина волны де Бройля такого электрона сравнима с размерами атома.
Потенциальная энергия взаимодействия электрона с ядром водородо- подобного атома
r – расстояние между электроном и ядром, которое в первом приближении
будем считать точечным.
Движение электрона в таком поле можно рассматривать как движение в некоторой сферической потенциальной яме.
Спектр энергий электрона должен быть дискретным, т.е. состоять из отдельных энергетических уровней со
значениями полной энергии электрона Е1; Е2; Е3 и т.д.
Уравнение Шрёдингера имеет вид
Решение этого уравнения проводят в сферической системе координат r , θ, φ , центр которой совпадает с центром ядра атома. В такой системе Ψ = Ψ( r , θ , φ ) , а оператор Лапласа
Используя оператор квадрата момента импульса в сферической системе координат
уравнение Шрёдингера преобразуют к виду
Решение этого уравнения ищут в виде произведения двух функций с разделяющимися переменными
Ψ = X( r ) . Y( θ, φ ).
C учётом естественных требований, налагаемых на Ψ-функцию она должна быть однозначной, конечной, непрерывной и гладкой.
В процессе решения обнаруживается, что этим требованиям можно удовлетворить при любыхположительных значениях энергии Е , но вобласти отрицательных значений Е – только при дискретных значениях, а именно, если
, где п = 1; 2; 3; … ,
что соответствует связанным состояниям электрона в атоме.
Таким образом решениеуравнения Шрёдингера приводит в случае Е
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.007)
* Данная работа не является научным трудом, не является выпускной квалификационной работой и представляет собой результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала при самостоятельной подготовки учебных работ.
Квантовые числа – это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Квантовые числа необходимы для описания состояния каждого электрона в атоме. Всего 4-ре квантовых числа. Это: главное квантовое число – n, орбитальное квантовое число – l, магнитное квантовое число – ml и спиновое квантовое число – ms.
Главное квантовое число – n.
Главное квантовое число – n – определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
Орбитальное квантовое число – l.
Орбитальное квантовое число – l – определяет геометрическую форму атомной орбитали. Орбитальное квантовое число принимает любые целочисленные значения, начиная с l=0 (l=0,1,2,3,…n-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы. Значению орбитального квантового числа l=0 соответствует s-орбиталь (1-ин тип). Значению орбитального квантового числа l=1 соответствуют p-орбитали (3-ри типа). Значению орбитального квантового числа l=2 соответствуют d-орбитали (5-ть типов). Значению орбитального квантового числа l=3 соответствуют f-орбитали (7-мь типов).
Так как электронам присущи волновые свойства и они обладают неопределенностью положения в пространстве, их движение характеризуется при помощи волновой функции и описывается волновым уравнением. Физический смысл волновой функции заключается в том, что ее квадрат 2 пропорционален вероятности нахождении электрона в элементарном объеме атома V с координатами x, y, z.
Значение волновой функции находят при решении волнового уравнения Шредингера:
2 /x 2 + 2 /y 2 + 2 /z 2 +82m/h 2 *(E–U)=0
В этом сложном дифференциальном уравнении с частными производными: Е–полная энергия частицы, U – потенциальная энергия, –волновая функция.
Волновая функция, получаемая при решении уравнения Шредингера, может иметь ряд значений. Эти значения зависят от квантовых параметров n, l, me, названных квантовыми числами
В итоге – значения квантовых чисел есть не что иное как результат решения уравнения Шредингера. Следовательно, при решении уравнения Шредингера получены значения волновой функции и возможные /допустимые/ значения квантовых чисел.
2.1.4. Квантовые числа. Атомные орбитали.
Так как электрон имеет четыре степени свободы, то для характеристики его поведения в атоме требуется четыре квантовых числа.
Главное квантовое число n определяет удаленность атомной орбитали от ядра и характеризует общий запас энергии электрона на данном энергетическом уровне. n принимает целочисленные значения от единицы до бесконечности. В зависимости от цифровых значений главного квантового числа приняты буквенные обозначения квантовых уровней n=1, 2, 3, 4,…
обозначение К, L, M, N,…
Чем больше n, тем слабее электрон связан с ядром и более емким становится квантовый уровень. Числовые значения n определяют также и количество подуровней, содержащееся на данном квантовом уровне /т.е. числовые значения n определяют емкость квантового уровня/. Так, если n=3, то это значит, что имеем третий квантовый уровень, который состоит из трех подуровней.
Орбитальное квантовое число l характеризует момент количества движения электрона относительно центра орбитали. Наличие такого движения приводит к делению квантового уровня на подуровни. Орбитальное квантовое число характеризует так же пространственную форму электронного облака. Это квантовое число предопределяется главным квантовым числом n и принимает ряд целочисленных значений от нуля до n–1. В зависимости от числовых значений l приняты буквенные обозначения подуровней:
обозначение подуровня: s, p, d, f,…
Магнитное квантовое число ml характеризует магнитный момент электрона. Определяет ориентацию квантового подуровня в пространстве. Число проекций подуровня на направление магнитных силовых линий квантуется и оно равно количеству орбиталей на данном подуровне. Можно сказать, что магнитное квантовое число определяет количество орбиталей на подуровне. ml принимает значения от –l через ноль до +l.
Рассмотрим подуровень s. Для него: l=0, ml=0
Подуровень Р имеет l=1, а ml = –1, 0, +1
В данном случае согласно правил квантования уже три проекции.
Следовательно на р-подуровне три р-орбитали. рис2.2.
Для d-подуровня: l=2, ml = –2, –1, 0, +1, +2. Это значит, что согласно квантовой теории d-подуровень состоит из пяти d-орбиталей.
Подуровень f имеет l=3, ml = –3, –2, –1, 0, +1, +2, +3. Следовательно f-подуровень состоит из семи f-орбиталей.
Число орбиталей на подуровне можно определить из выражения ml =2l+1:
значение l: 0, 1, 2, 3, …….
подуровень: s, p, d, f, …….
число орбиталей: 1, 3, 5, 7, …….
Оно получено из опытов Штерна и Герлаха.
Рассмотренные квантовые числа определяют энергию электрона, объем и форму пространства, в котором вероятно его пребывание в околоядерном объеме, т.е. размер, форму и ориентацию орбитали в пространстве.
Так как волновая функция является решением уравнения Шредингера при всевозможных значениях квантовых чисел, то можно сказать, что волновая функция является в свою очередь функцией рассмотренных квантовых параметров n, l и ml, где:
Атомные орбитали. Так как вероятность нахождения электрона в пространстве далеком от ядра очень мала, когда говорят об орбиталях, то имеют в виду такую область вокруг ядра атома внутри которой сосредоточено 90–95% электронного заряда. С точки зрения квантовой механики атомные орбитали являются геометрическим изображением волновой функции (n, l, ml).
Z Электронное облако. Если бы в каждый момент времени
y определяли положение электрона в трехмерном пространстве и
ставили в том месте точку, то через множество таких определений
X получили бы картину в виде пространственного облака изображен-
ного точками с размытыми краями /рис.2.3.)
Такое зарядовое облако называют электронным облаком. Его плотность, пропорциональная 2 , является непосредственной мерой вероятности нахождения электрона. Граничная поверхность облака, внутри которой содержится 90–95% электронного заряда, дает форму орбитали.
Z s-орбиталь. Она существует при l=0. Значение ml тоже равно
Y нулю. Имеем только одно значение ml =0. Следовательно,
s-орбиталь имеет максимальную симметричность. У нее
X сферическая форма (рис.2.4.). В этом случае вероятность на–
хождения электрона в околоядерном пространстве определя–
рис.2.4. ется только радиусом-вектором и не зависит от угла координат.
Радиальное распределение электронной плотности для 1s
электрона соответствует кривой с максимумом (рис.2.5.).
Максимум распространения вероятности находится на
0 r1 r,A 0 расстоянии от ядра r1, которые соответствует радиусу
рис.2.5. первой боровской орбиты.
р-орбиталь. Существует при l=1. ml = –1, 0, +1.
Z р-орбиталь появляется на втором и всех последующих
Рz уровнях. Так как ml имеет три значения, то на р-подуров-
Y не каждого уровне может быть три р-орбитали. р-орбиталь
имеет гонтелеобразную форму. Все три р-орбитали распо-
X лагаются в пространстве по направлению координатных
Px осей. Их называют соответственно рх, рy, рz-орбитали
Рис.2.6. Z Y Y Z Z
dz 2 dx 2 y 2 dxy dxz dyz
d-орбиталь. Появляется при l=2 на третьем квантовом уровне. На d-подуровне может быть уже пять различных состояний электронов, поэтому на d-подуровне каждого квантового уровня содержится пять d-орбиталей. В этом случае ml принимает пять значений: ml = –2, –1, 0, +1, +2, d-орбитали имеют более сложную форму, чем р-орбитали, они либо в виде четырех лепестков либо в виде гантели с ободком (рис.2.7.).
f-орбиталь. Появляется при значении l=3. f-орбитали могут быть только на четвертом и более отдаленных уровнях. Так как при l=3 ml имеет 7 значений /–3, –2, –1, 0, +1, +2, +3/, то на f-подуровне может быть семь орбиталей. Форма f-орбиталей еще более сложная, чем у d-орбиталей. f-орбитали изображают в виде сложных шестилепестковых фигур.
Форма орбиталей и ее направленность играют существенную роль при образовании химических связей, т.к. эти два фактора определяют характер и степень перекрывания электронных облаков соединяющихся атомов.

ГОСТ
Введение
Состояние каждого электрона в атоме описывается волновой функцией, которая называется атомной орбиталью (или уровнем) и характеризуется тремя квантовыми числами. Соответствующие волновые функции выводятся из уравнения Шредингера и должны удовлетворять следующим требованиям: непрерывность, однозначность и конечность каждой волновой функции. При нарушении хотя бы одного из этих требований волновая функция оказывается непригодной для описания состояния электронов в атоме. Следовательно, дискретность энергетических состояний, в которых могут находиться электроны в атоме, является прямым следствием уравнения Шредингера. То же касается и трех квантовых чисел.
Главное квантовое число
Главное квантовое число может принимать любое целочисленное значение:
Но атомы известных в настоящее время элементов в стационарном состоянии (т.е. невозбужденные) не содержат электроны, для описания которых необходимы были бы атомные орбитали (уровни) с $n > 7$. Поэтому, в общем случае, реальным верхним пределом изменения главного квантового числа является значение $7$. Главное квантовое число характеризует энергию электрона на соответствующей орбитали. Или, проще говоря, степень удаленности данной орбитали от ядра атома (рис. 1). Чем меньше $n$, тем больше энергия связи электрона с ядром, т.е. тем большее, при прочих равных условиях, количество энергии требуется для удаления этого электрона из атома (эта энергия называется энергией ионизации).

Рисунок 1. Схема раположений орбиталей атома
Забегая вперед, стоит сказать, что иногда для краткости записи электронной конфигурации атома вместо главного квантового числа используется буквенное обозначение соответствующих орбиталей (рис. 1): $K (n = 1)$, $L (n = 2)$, $M (n = 3)$, $N (n = 4)$, и так далее по алфавиту.
Орбитальное квантовое число
Орбитальное квантовое число $l$ может принимать значения от $0 до(n - 1)$:
Таким образом, $l$ для первых четырех значений главного квантового числа $n$ принимает следующие значения:

Готовые работы на аналогичную тему
Орбитальное квантовое число определяет форму соответствующего электронного облака (рис. 4). В записи электронной конфигурации атома оно обозначается по первым буквам английских наименований соответствующих спектральных линий $(sharp - s$, $principal - p$, $diffuse - d$, $fundamental - f$):


Рисунок 4. Формы электронных облаков атомных $s-$, $p-$, $d-$ орбиталей и их пространственное расположение
Таким образом, для каждого значения $n$ возможны строго определенные (по количеству и характеру) атомные орбитали (подуровни):

Причем значения энергии электронов на соответствующих орбиталях таковы, что подуровень $4s$ расположен ближе к ядру, чем $3d$. Это правило пригодится при решении задач на составление электронных конфигураций атомов.
Магнитное квантовое число
Магнитное квантовое число m может принимать любые целочисленные значения от $+l$ до $-l$, включая $0$, и характеризует расположение соответствующей орбитали в пространстве атома:
Количество значений магнитного квантового числа определяется значением орбитального квантового числа $l$ и равно $(2l + 1)$:


При заданных значениях $n$ и $l$ все возможные атомные орбитали независимо от значений m имеют одинаковую энергию, т.е. являются вырожденными. Кратность вырождения определяется числом атомных орбиталей с одинаковой энергией, т.е. числом значений m при заданном значении $l$. Таким образом, $s$-состояние электрона является вырожденным ($m = 0$), $p$-состояние - трехкратновырожденным ($m = 1$, $0$, $-1$), $d$- состояние - пятикратновырожденным, и.т.д.
Физический смысл магнитного квантового числа схематично представлен на рис. 7, где клетки - это, по сути, места, которые могут быть заняты электронами.
Спиновое квантовое число
Кроме всего прочего, электроны в атоме отличаются собственным моментом количества движения, который условно можно представить как вращение вокруг собственной оси. Это вращение характеризуется спиновым квантовым числом s, которое может иметь лишь два значения $+1/2$ и $-1/2$ (условно говоря, вращение по часовой стрелке и против часовой стрелки).
Примеры решения типовых задач
Записать электронную конфигурацию атома гелия в основном состоянии.
Решение. Главное квантовое число $n = 1$, орбитальное квантовое число $l = n - 1 = 0$, что соответствует s-состоянию. Таким образом, электронная конфигурация атома гелия $1s^2$, где индекс $2$ указывает на число электронов, занимающих орбиталь $1s$.
Записать электронную конфигурацию атома железа с порядковым номером $26$.
Решение. В соответствии с порядком заполнения атомных орбиталей имеем $1s^22s^22p^63s^23p^64s^23d^6$.
Читайте также:
- Личностно ориентированное обучение в вузе реферат
- Аналитические и численные методы в планировании экспериментов и инженерном анализе реферат
- Машинно тракторные агрегаты реферат
- Қазақстандық қоғам құндылықтарының жаңа жүйесі ерекшеліктері мен өзгешелігі реферат
- Порядок проведения патологоанатомического вскрытия реферат

