Вода основной компонент химического производства реферат
Обновлено: 30.06.2024
Химическая промышленность – один из крупнейших потребителей воды. Вода используется почти во всех химических производствах для разнообразных целей. На отдельных химических предприятиях потребление воды достигает 1 млн. м3 в сутки. Превращение воды в один из важнейших элементов химического производстваобъясняется:
- наличием комплекса ценных свойств (высокая теплоемкость, малая вязкость, низкая температура кипения и др.);
- доступностью и дешевизной (затраты исключительно на извлечение и очистку);
- удобством использования в производстве и транспортировки.
В химической промышленности вода используется в следующих направлениях:
1. Для технологических целей в качестве:
*растворителя твердых, жидких и газообразных веществ;
*
среды для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы и др.);
*
промывной жидкости для газов;
*
экстрагента и абсорбента различных веществ.
2. Как теплоноситель (в виде горячей воды и пара) и хладоагента для обогрева и охлаждения аппаратуры.
3. В качестве сырья иреагента для производства различной химической продукции (например, водорода, ацетилена, серной и азотной кислот и др.)
Воды морей и океанов являются источниками сырья для добычи многих химических веществ. В промышленных масштабах из них извлекаются хлориды натрия и магния, бром, йод и другие продукты. В настоящее время их рассматривают и как потенциальные источники получения многих другихэлементов.
Масштабы потребления воды химической промышленностью зависят от типа производства и колеблются в широких пределах. Так, расходные коэффициенты по воде (в м3 на тонну продукции) составляют: для азотной кислоты 200, вискозного волокна 1200, аммиака 1500, синтетического каучука 1600, капронового волокна 2500. Например, завод капронового волокна расходует такое же количество воды как город снаселением 120000 человек, а специализированный завод пластических масс по потреблению воды эквивалентен городу с населением 400000 человек.
Водооборотные циклы технологических установок, цехов и химических предприятий в целом являются важнейшим фактором рационального использования водных ресурсов. В этих циклах осуществляется многократное использование воды без выброса загрязненных стоков вводоемы, а потребление свежей воды для ее восполнения ограничено только технологическими превращениями (в качестве компонента сырья) и естественными потерями.
В химических производствах используют три схемы водооборота в зависимости от тех изменений, которые претерпевает вода в процессе производства:
*
вода только нагревается и должна быть перед возвратом охлаждена в градирнях илибассейнах;
*
вода только загрязняется и должна быть перед возвратом очищена в специальных очистных сооружениях;
*
вода нагревается и загрязняется. Этот тип водооборота представляет комбинацию водооборотов первого и второго типов.
^
Источники водоснабжения химических производств
Общее количество воды на Земле составляет 1,4·1018 тонн. Большая часть этой воды находится в постоянномкругообороте под воздействием тепловой энергии солнца и теплоты земных недр. Природная вода подразделяется на атмосферную, поверхностные воды, подземные воды и морскую (океанскую) воду.
Атмосферная вода, выпадающая в виде дождя и снега, содержит минимальное количество примесей, главным образом, в виде растворенных газов (кислорода, оксида углерода (II), азота, сероводорода), бактерий, а в промышленных районах такжеоксиды азота и серы и различные органические вещества.
Поверхностные воды представляют воды открытых водоемов: рек, озер, каналов, водохранилищ. В состав поверхностных вод входят различные минеральные и органические вещества, природа и концентрация которых зависят от климатических, геоморфологических, почвенно-геологических условий, а также от агро- и.
Химическая промышленность - один из крупнейших потребителей воды. Вода используется почти во всех химических производствах для разнообразных целей. На отдельных химических предприятиях потребление воды достигает 1 млн. м 3 в сутки. Превращение воды в один из важнейших элементов химического производства объясняется:
- наличием комплекса ценных свойств (высокая теплоемкость, малая вязкость, низкая температура кипения и др.);
- доступностью и дешевизной (затраты исключительно на извлечение и очистку);
- нетоксичностью;
- удобством использования в производстве и транспортировки. В химической промышленности вода используется в следующих направлениях:
- Для технологических целей в качестве:
- растворителя твердых, жидких и газообразных веществ;
- среды для осуществления физических и механических процессов (флотация,транспортировка твердых материалов в виде пульпы и др.);
- промывной жидкости для газов;
- экстрагента и абсорбента различных веществ.
- Как теплоноситель (в виде горячей воды и пара) и хладагента для обогрева и охлаждения аппаратуры.
- В качестве сырья и реагента для производства различной химической продукции (например, водорода, ацетилена, серной и азотной кислот и др.)
Воды морей и океанов являются источниками сырья для добычи многих химических веществ. В промышленных масштабах из них извлекаются хлориды натрия и магния, бром, иод и другие продукты. В настоящее время их рассматривают и как потенциальные источники получения многих других элементов. Так, например, содержание элементов в водах Океана составляет (%): калия 3,8*10 -2 , ванадия 5*10 -8 , золота 4*10 -10 , серебра 5 10 -9 , урана 2*10 -7 . Приняв массу воды на планете равной 1,4 10 18 тонн, получим соответственно содержание в ней золота 5,6*10 6 тонн и урана 2,8*10 9 т. Всего 0,01% этой массы урана достаточно для обеспечения энергией всей планеты на протяжении 100 лет.
Масштабы потребления воды химической промышленностью зависят от типа производства и колеблются в широких пределах. Так, расходные коэффициенты по воде (в м 3 на тонну продукции) составляют: для азотной кислоты 200, вискозного волокна 1200, аммиака 1500, синтетического каучука 1600, капронового волокна 2500. Например, завод капронового волокна расходует такое же количество воды, как город с населением 120000 человек, а специализированный завод пластических масс по потреблению воды эквивалентен городу с населением 400000 человек.
Громадный расход технологической воды, наряду с большим объемом загрязненных вод, сбрасываемых химическими предприятиями (до 40% стока речных вод используется только на разбавление их до безопасной концентрации содержащихся в них веществ), выдвигает первоочередную задачу рационального использования водных ресурсов в химической и нефтехимической промышленности. Эта задача решается путем:
- разработки научно обоснованных норм расхода воды на технологические операции;
- максимально полного использования отходов и снижения за счет этого потребности в очистительных сооружениях;
- замены водяного охлаждения аппаратуры воздушным;
- организации замкнутых без сточных производств и водооборотных циклов.
Водооборотные циклы технологических установок, цехов и химических предприятий в целом являются важнейшим фактором рационального использования водных ресурсов. В этих циклах осуществляется многократное использование воды без выброса загрязненных стоков в водоемы, а потребление свежей воды для ее восполнения ограничено только технологическими превращениями (в качестве компонента сырья) и естественными потерями.
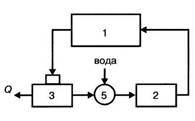
Рисунок 3.2 – Цикл с охлаждением оборотной воды:
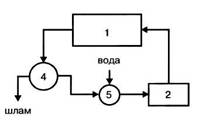
Рисунок 3.3 – Цикл с очисткой оборотной воды:
- Технологическая установка (цех);
- Насосная станция;
- Градирня (бассейн);
- Очистные сооружения;
- Камера для пополнения потерь воды
В химических производствах используются три схемы водооборота в зависимости от тех изменений, которые претерпевает вода в процессе производства:
- вода только нагревается и должна быть перед возвратом охлаждена в градирнях или бассейнах (рис. 3.2);
- вода только загрязняется и должна быть перед возвратом очищена в специальных очистных сооружениях (рис.3.3);
- вода нагревается и загрязняется. Этот тип водооборота представляет комбинацию водо-оборотов первого и второго типов (рис. 3.4).
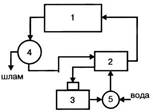
Рисунок 3.4 – Цикл с очисткой и охлаждением оборотной воды:
- Технологическая установка (цех);
- Насосная станция;
- Градирня (бассейн);
- Очистные сооружения;
- Камера для пополнения потерь воды
Критерием эффективности водооборотного цикла является коэффициент использования воды:
- [TEX]Kв=\frac[/TEX]
(3.1) - где: Vз и Vсб - количества забираемой из источника свежей воды и сбрасываемой в водоем сточной воды соответственно. В химической промышленности доля оборотного водоснабжения достигает 85 - 90%.
2. Источники водоснабжения химических производств
Общее количество воды на Земле составляет 1,386*10 9 км 3 (1,386*10 18 м 3 ) или 1,4*10 18 тонн. Большая часть этой воды находится в постоянном кругообороте под воздействием тепловой энергии солнца и теплоты земных недр. Природная вода подразделяется на атмосферную, поверхностные воды, подземные воды и морскую (океанскую) воду.
Атмосферная вода, выпадающая в виде дождя и снега, содержит минимальное количество примесей, главным образом, в виде растворенных газов (кислорода, оксида углерода (II), азота, сероводорода), бактерий, а в промышленных районах также оксиды азота и серы и различные органические вещества.
Поверхностные воды представляют воды открытых водоемов: рек, озер, каналов, водохранилищ. В состав поверхностных вод входят различные минеральные и органические вещества, природа и концентрация которых зависят от климатических, геоморфологических, почвенно-геологических условий, а также от агро- и гидротехнических методов, развития промышленности в регионе и других факторов.
К подземным водам относятся воды артезианских скважин, колодцев, ключей и гейзеров. Для них характерно высокое содержание минеральных солей, выщелачиваемых из почвы и осадочных пород, и малое содержание органических веществ.
Морская вода представляет многокомпонентный раствор электролитов и содержит практически все элементы, входящие в состав литосферы. В ней растворены также различные газы.
В зависимости от солесодержания природные воды делятся на пресные (содержание солей менее 1 г/кг), солоноватые (содержание солей 1-10 г/кг) и соленые (содержание солей более 10 г/кг). Из общего объема гидросферы планеты запасы пресных вод составляют всего 0,03%, при этом источниками промышленного водоснабжения становятся, преимущественно, только речные воды, что связано со значительной протяженностью их береговой линии. В настоящее время на промышленные цели в РФ расходуется до 9% общего стока пресной воды, что составляет 700 куб. км в год.
Вода, используемая в химической промышленности (технологическая вода) должна удовлетворять по качеству определенным требованиям того или иного производства. Качество воды определяется совокупностью ее физических и химических характеристик, к которым относятся: цвет, прозрачность, запах, общее солесодержание, жесткость, окисляемость, реакция (рН), которые зависят от содержания в воде различных примесей. Для промышленных вод важнейшими из этих характеристик являются жесткость, окисляемость, реакция и содержание примесей различной дисперсности.
Жесткость - свойство воды, обусловленное присутствием в ней солей кальция и магния. В зависимости от природы анионов различают временную (устранимую, карбонатную) жесткость, зависящую от наличия в воде бикарбонат-ионов HCO - , Ж в и постоянную (некарбонатную) жесткость, вызываемую присутствием хлорид-ионов Cl - , нитрат-ионов NO3 - , и сульфат-ионов SO4 2- , и постоянной жесткости называется общей жесткостью воды:
[TEX]Жо = Жп + Жв[/TEX]. (3.2)
Жесткость воды выражается суммой концентраций ионов кальция и магния, содержащихся в 1 литре воды, то есть в ммоль/дм 3 . По значению общей жесткости воды делятся на мягкую ( Жо менее 2), средней жесткости (Ж0 = 2-10 ммоль/л) и жесткую (Жо более 10).
Окисляемость - свойство воды, обусловленное присутствием в ней органических веществ, легкоокисляющихся соединений железа и сероводорода, способных окисляться различными окислителями. Так как состав этих примесей неопределенен, окисляемость воды выражается в количестве перманганата калия или эквивалентном ему количестве кислорода, затраченного на окисление 1 литра воды, то есть мг/л.
Активная реакция воды характеризует ее кислотность и щелочность. Она зависит от присутствия в воде некоторых газов, реагирующих с водой (хлор, оксид углерода и др.), растворимых гуминовых кислот и веществ, вносимых в водоем промышленными стоками. Для большинства природных вод активная среда характеризуется величиной рН=6,5-8,5.
3. Промышленная водоподготовка
Вредное влияние примесей, содержащихся в промышленной воде, зависит от их химической природы, концентрации, дисперсного состояния, а также технологии конкретного производства, использующего воду. Все вещества, присутствующие в воде, могут находиться в виде истинного раствора (соли, газы, некоторые органические соединения, в коллоидном состоянии (алюмо- и железосиликаты, некоторые гидроксиды, кремневая кислота, органические соединения типа лигнина и др.) и во взвешенном состоянии (глинистые, песчаные и известковые частицы).
Растворенные в воде вещества образуют при нагреве накипь на стенках аппаратуры и вызывают коррозионное разрушение ее. Коллоидные примеси вызывают загрязнение диафрагм электролизеров, вспенивание воды. Грубодисперсные взвеси засоряют трубопроводы, снижая их производительность, могут вызвать их закупорку. Все это вызывает необходимость предварительной подготовки воды, поступающей на производство водоподготовки.
Водоподготовкой называют комплекс операций по удалению из природной воды вредных для производства примесей, содержащихся в ней в виде взвесей, коллоидных частиц, растворенных солей и газов. В водоподготовку входят операции осветления, умягчения, дегазации, а в отдельных случаях обессоливания и для питьевой воды обеззараживания. Схема промышленной водоподготовки приведена на рис. 3.5.
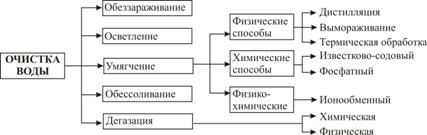
Рисунок 3.5 – Схема промышленной водоподготовки
Осветление воды достигается отстаиванием ее с последующим фильтрованием через зернистый материал различной дисперсности. Для коагуляции коллоидных примесей и абсорбции окрашенных веществ, содержащихся в воде, к ней добавляют электролиты – сульфаты алюминия и железа.
Обеззараживание воды обеспечивается ее хлорированием (Ca(ClO)2 хлорная известь) или озонированием.
Дегазация – удаление из воды растворенных газов достигается химическим способом, при котором газы поглощаются химическими реагентами, например, в случае диоксида углерода:
или физическими способами термической деаэрации на воздухе или в вакууме.
Обессоливание применяется в тех производствах, где к воде предъявляются особо жесткие требования по чистоте, например, при получении полупроводниковых материалов, химически чистых реактивов, фармацевтических препаратов. Обессоливание воды достигается методом ионного обмена, дистилляцией и электродиализом.
Метод ионного обмена основан на свойстве некоторых твердых тел (ионитов) поглощать из раствора ионы в обмен на эквивалентное количество других ионов того же знака. Иониты подразделяются на катиониты и аниониты.
Катиониты - нерастворимые в воде вещества, которые являются солями или кислотами с анионом, который обусловливает нерастворимость в воде; катион (натрий или водород) способен вступать в обменную реакцию с катионами раствора. Катиониты соответственно называются Na - катионитами и H - катионитами.
Аниониты - основания или соли с твердым, нерастворимым катионом. Они содержат подвижную гидроксильную группу (OH - аниониты).
Катиониты содержат подвижные катионы натрия или водорода, а аниониты подвижные ионы гидроксила. В качестве катионитов применяют сульфоугли, алюмосиликаты (пермутит, цеолит и др.), в качестве анионитов искусственные смолы, например карбамидные.
Соответственно, процессы ионного обмена подразделяются на H(Na) – катионирование, например:
и анионирование, например:
где: [Кат] и [Ан] - не участвующая в обмене матрица ионита.
Поскольку процесс ионного обмена обратим, установление равновесия в системе означает прекращение процесса обессоливания. Поглощающая способность ионита характеризуется его обменной емкостью, равной количеству ионов кальция и магния, которое может поглотить единица объема или массы ионита, выраженное в граммэквивалентах: г-экв/м 3 и г-экв/кг. От величины обменной емкости при данном объеме ионита зависит время рабочего цикла ионитовых фильтров. При насыщении ионита он может быть регенерирован промывкой растворами для Н - катионитов кислоты, а катионитов хлорида натрия и для анионитов раствором щелочи. В приведенных выше примерах работы анионитов при этом протекают реакции:
- [TEX]Ca[Кат] +2NaCl = Na2[Кат] + CaCl2[/TEX]
и
- [TEX]An[Cl] + KOH = An[OH] + KCl[/TEX]
Полное обессоливание воды обеспечивается ее дистилляцией (термическое обессоливание) обычно после того, как вода предварительно очищена с помощью ионитовых фильтров.
На рис. 3.6 приведена схема обессоливания воды методом ионного обмена.
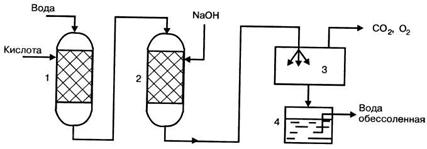
Рисунок 3.6 – Схема установки для обессоливания воды:
1 - катионитный фильтр; 2 - анионитный фильтр;
3 - дегазатор; 4 - сборник очищенной воды
Вода последовательно проходит через катионитный и анионитный фильтры и поступает распыляясь в дегазатор, где из нее удаляются растворенные диоксид углерода, кислород и другие газы. Для регенерации катионита в фильтр периодически подается кислота или раствор хлорида натрия, для регенерации анионита – раствор щелочи.
Электродиализом называется процесс диализа под воздействием электрического поля. При этом выделение солей из диализуемого раствора происходит в результате перемещения ионов через пористые мембраны, содержащие катионит (у катода) и анионит (у анода), с последующим их разрядом на электродах. На рис. 3.7 представлена схема электродиализатора для обессоливания воды.
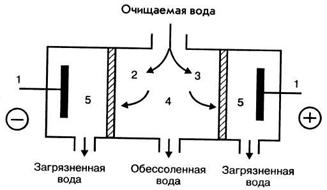
Рисунок 3.7 – Схема электродиализатора: 1 - электроды; 2 - катионитовая мембрана; 3 - анионитовая мембрана; 4 - внутренняя камера; 5 - внешние камеры
Одной из основных и обязательных операций водоподготовки технологической воды является ее умягчение.
Умягчением называется обработка воды для понижения ее жесткости, то есть уменьшения концентрации ионов Са +2 различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в их карбонаты, выпадающие в осадок:
Этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и известковосодовый, заключающиеся в обработке воды тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
Во втором случае протекают две реакции. Бикарбонаты кальция и магния реагируют с гидроксидом кальция, чем устраняется временная жесткость:
а сульфаты, нитраты и хлориды — с карбонатом натрия, чем устраняется постоянная жесткость:
Физико-химический метод ионнообменного умягчения воды был описан выше.
Водоподготовка в химическом производстве представляет весьма трудоемкий процесс и требует больших капитальных и эксплуатационных затрат. На современных химических предприятиях доля капитальных затрат на водоподготовку составляет 10-15% общего объема расходов на производство химической продукции.
Современные схемы промышленной водоподготовки включают все основные операции: осветление в грубых и коагуляционных отстойниках, фильтрование через зернистый материал, умягчение методом ионного обмена, дегазацию. На рис. 3.8 представлена подобная схема водоподготовки промышленных вод.
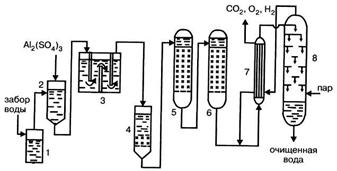
Рисунок 3.8 – Схема подготовки промышленных вод: 1 - грубый отстойник; 2 - смеситель коагулянта; 3 - коагуляционный отстойник; 4 - фильтр; 5 - катионитный фильтр; 6 - анионитный фильтр; 7 - теплообменник; 9 - деаэратор
Пример решения задачи
К 25 см 3 водопроводной воды прибавили 5 см 3 аммиачной буферной смеси и индикатор эриохром черный Т. Полученный раствор оттитровали 0,02 н раствором ЭДТА до перехода окраски индикатора из винно-красной в ярко-голубую. Титрование повторили 3 раза. Средний объём ЭДТА, израсходованный на титрование составил V1 ср(ЭДТА) см 3 . Аналогичный эксперимент повторили с водопроводной водой, прокипяченной в течение 30 минут, Средний объём ЭДТА, израсходованный на титрование составил V2ср (ЭДТА) см 3 . Рассчитать общую и постоянную жесткость водопроводной воды.
V1 ср (ЭДТА) = 3, 00 см 3 , V2ср (ЭДТА) = 2,50 см 3 .
1) Вычисление общей жесткости воды производят по формуле
Ж(общ) - общая жесткость воды, ммоль/дм 3 ;
Сэк(ЭДТА) - молярная концентрация эквивалентов раствора ЭДТА, моль/дм 3 ;
V1 ср (ЭДТА) – средний объем ЭДТА, израсходованный на титрование воды до кипячения, см 3 ;
Vа.ч. (Н2О) - аликвотная часть анализируемой воды, см 3 .
Ж(общ) = 0,02*3,00*1000/25,00 = 2.4 ммоль/дм 3
2) Вычисление временной жесткости воды производят по формуле
где V2 ср (ЭДТА) – средний объём воды, израсходованный на титрование воды после кипячения, см 3 .
Водооборотные циклы химико-технологических производств являются важным фактором рационального использования водных ресурсов. В этих циклах осуществляется многократное использование воды без выброса загрязненных стоков в водоемы, а потребление свежей воды для ее восполнения ограничено только технологическими превращениями и естественными потерями. В химических производствах используется 3 схемы… Читать ещё >
Вода в химической промышленности ( реферат , курсовая , диплом , контрольная )
Вода в химической промышленности
Использование воды, свойства воды
Химическая промышленность — один из крупных потребителей воды. Вода используется почти во всех химических производствах для разнообразных целей. На отдельных химических предприятиях потребление воды достигает 1млн м 3 в сутки. Превращение воды в один из важнейших элементов химического производства объясняется:
• наличием комплекса ценных свойств (высокая теплоемкость, малая вязкость, низкая температура кипения);
• доступностью и дешевизной (затраты исключительно на извлечение и очистку);
• удобством использования в производстве и транспортировке.
В химической промышленности вода используется в следующих направлениях:
1. Для технологических целей в качестве:
— растворителя твердых, жидких и газообразных веществ;
— среды для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы);
— промывной жидкости для газов;
— экстрагента и абсорбента различных веществ.
2. Как теплоноситель (в виде горячей воды и пара) и хладагента для обогрева и охлаждения аппаратуры.
3. В качестве сырья и реагента для производства различной химической продукции (водорода, ацетилена, серной и азотной кислот.).
Воды морей и океанов — источники сырья для добычи многих химических веществ: из них извлекаются NaС1, МgСl, Br, I и др. продукты. Так например, содержание элементов в водах океана составляет: К-3.8 *10−2%, V- 5*10 -8 %, Аu -4*10 -10 %, Аg -5*10 -9 %. Приняв массу воды на планете-1.4 *10 18 , получим соответственно содержание в ней Аu-5.6 * 10 6 т.
Масштабы потребления воды химической промышленностью зависят от типа производства. Так, расходный коэффициент по воде (м 3 /т продукции) составляет: для азотной кислоты — 200, аммиака- 1500, синтетического каучука-1600. Например, завод капронового волокна расходует такое же количество воды, как город с населением 400тыс. человек. Общее количество воды на Земле составляет 1.386 *10 18 м 3
Природную воду принято делить на 3 вида, сильно различающихся по наличию примесей:
Атмосферная вода — вода дождевых и снеговых осадков, содержит минимальное количество примесей, главным образом, растворенные газы СО2, О2 а в промышленных районах N0х, SОх. Почти не содержит растворенные соли.
Поверхностная вода — речные, озерные, морские, содержат различные минеральные и органические вещества, природа и концентрация которых зависят от климата, геоморфологических и гидротехнических мероприятий.
Подземная вода — вода артезианских скважин, колодцев, ключей, гейзеров. Для них характерно высокое содержание минеральных солей, выщелачиваемых из почвы и осадочных пород и малое содержание органических веществ.
Морская вода представляет многокомпонентный раствор электролитов и содержит все элементы, входящие в состав литосферы.
Вода, используемая в химической промышленности должна удовлетворять по качеству определенным требованиям. Качество воды определяется совокупностью физических и химических характеристик, к которым относятся: цвет, прозрачность, запах, общее солесодержание, жесткость, рН, окисляемость. Для промышленных вод важнейшими из этих характеристик являются солесодержание, жесткость, рН, содержание взвешенных веществ.
Жесткостью называется свойство воды, обусловленное присутствием в ней солей Са и Мg. В зависимости от природы анионов различают временную жесткость (устранимую, карбонатную), удаляемую при кипячении — Жв и постоянную (некарбонатную) — Жп. Сумма Жв и Жп называется общей жесткостью воды Жо = Жв + Жп Принята следующая классификация по жесткости: мягкая (Са и Мg до 3 мгэкв/л), умеренножесткая (3−6 мгэкв/л) и жесткая (более 6 мгэкв/л).
В зависимости от солесодержания природные воды делятся на пресные (с/с менее 1г/кг), солоноватые (с/с от 1 до 10 г/кг) и соленые (с/с более 10г/кг.
Окисляемость воды обусловлена наличием в воде органических примесей и определяется количеством мг перманганата калия, израсходованного при кипячении 1л воды.
РН воды характеризует ее кислотность щелочность.
Водооборотные циклы химико-технологических производств являются важным фактором рационального использования водных ресурсов. В этих циклах осуществляется многократное использование воды без выброса загрязненных стоков в водоемы, а потребление свежей воды для ее восполнения ограничено только технологическими превращениями и естественными потерями. В химических производствах используется 3 схемы водооборота в зависимости от технологических изменений, которые вода претерпевает в процессе производства.
Вода только нагревается и д.б. перед возвратом охлаждена в бассейне или градирне.
Вода только загрязнена и д. б. перед возвращением очищена в специальных очистных сооружениях ["https://referat.bookap.info", 22].
Вода нагревается и загрязнена. Это комбинация 1 -го и 2 -го типа ВОЦ.
Промышленная водоподготовка
вода химический коллоидный водоподготовка Вредное влияние примесей, содержащихся в промышленной воде, зависит от их химической природы, концентрации, дисперсного состояния, а также технологии конкретного производства использования воды. Все вещества, присутствующие в воде, могут находиться в виде истинного раствора (соли, газы, некоторые органические соединения в коллоидном состоянии) и во взвешенном состоянии (глинистые, песчаные, известковые частицы).
Растворенные в воде вещества образуют при нагревании накипь на стенках аппаратуры и вызывают коррозионное разрушение ее. Коллоидные примеси вызывают загрязнение диафрагмы электролизеров, вспенивание воды. Грубодисперсные взвеси засоряют трубопроводы, снижают их производительность, могут вызвать их закупорку. Все это вызывает необходимость предварительной подготовки воды, поступающей на производство — водоподготовку.
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды — удаление из нее вредных примесей, находящихся в молекулярно-растворенном, коллоидном и взвешенном состоянии. Основные операции водоподготовки: очистка от взвешенных веществ отстаиванием и фильтрованием, умягчение, в отдельных случаях — обесцвечивание, нейтрализация, дегазация и обеззараживание.
Процесс отстаивания позволяет осветлять воду вследствие удаления из нее грубодисперсных веществ, оседающих под действием силы тяжести на дно отстойника. Отстаивание воды проводится в непрерывнодействующих отстойных бетонированных резервуарах. Для достижения полноты осветления и обесцвечивания декантируемую из отстойника воду подвергают коагуляции с последующим фильтрованием.
Коагуляция — высокоэффективный процесс разделения гетерогенных систем, в частности, выделение из воды мельчайших глинистых частиц и белковых веществ. Осуществляют коагуляцию введением в очищаемую воду небольших количеств электролитов Al2(S04)3> FеS04 и др. соединений, называемых коагулянтами. Физико-химическая сущность этого процесса в упрощенном виде состоит в том, что коагулянт в воде превращается в агрегат несущих заряд частиц, которые взаимодействуя с противоположно заряженными частицами примесей, обуславливают выпадение нерастворимого коллоидного осадка. Так, А12(Б04)3 в результате гидролиза и взаимодействия с солями кальция и магния, растворенными в воде, образует хлопьевидные положительно заряженные частицы А1(0Н)3
Взаимодействие положительно заряженных частиц гидроокиси алюминия и несущих отрицательный заряд примесей приводит к быстрой коагуляции. Одновременно идет процесс адсорбции на поверхности осадка органических красящих веществ, в результате чего вода обесцвечивается. Обеззараживание воды обеспечивается ее хлорированием или озонированием. Дегазация — удаление из воды растворенных газов достигается химическим способом, при котором газы поглощаются химическими реагентами, например, в случае диоксида углерода:
СО2 + Са (ОН)2 = СаСО3 +Н2О, или физическими способами — термической деаэрацией на воздухе или в вакууме. Одной из основных и обязательных операций водоподготовки технологической воды является ее умягчение.
Схема промышленной водоподготовки Умягчением называется обработка воды для понижения ее жесткости, т. е. уменьшения концентрации ионов кальция и магния различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в их карбонаты, выпадающие в осадок:
Этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и известково-содовый, заключающийся в обработке тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
Во втором случае протекают две реакции. Бикарбонаты кальция и магния реагируют с гидроксидом кальция, чем устраняется временная жесткость: Са (НС03)2 + Са (0Н)2 = 2 СаС03 +2 Н20, а сульфаты, нитраты и хлориды — с карбонатом натрия, чем устраняется постоянная жесткость:
Обессоливание применяется в тех производствах, где к воде предъявляются особо жесткие требования по чистоте, например, при получении полупроводниковых материалов, химически чистых реактивов, фармацевтических препаратов. Обессоливание воды достигается методом ионного обмена, дистилляцией, электродиализом.
Метод ионного обмена основан на свойстве некоторых твердых тел (ионитов) поглощать из раствора ионы в обмен на эквивалентное количество других ионов того же знака. Иониты подразделяются на катиониты и аниониты. Катиониты содержат подвижные катионы натрия или водорода, а аниониты подвижные ионы гидроксила. В качестве катионитов применяют сульфоугли, алюмосиликаты, искусственные смолы, в качестве анионитов искусственные смолы.
Поскольку процесс ионного обмена обратим, установление равновесия в системе означает прекращение процесса обессоливания. Поглощающая способность ионита характеризуется его обменной емкостью, равной количеству ионов кальция и магния, которое может поглотить единица объема или массы ионита, выраженное грамм-эквивалентах: гэкв/м 3 и гэкв/кг. От величины обменной емкости при данном объеме ионита зависит время рабочего цикла ионитовых фильтров. При насыщении ионита он может быть регенерирован промывкой растворами для Н катионитов кислоты, Na катионитов хлорида натрия и для анионитов раствором щелочи. В приведенных выше примерах работы анионитов при этом протекают реакции:
Полное обессоливание воды обеспечивается ее дистилляцией (термическое обессоливание) обычно после того, как вода предварительно очистится с помощью ионитовых фильтров.
Схема обессоливания воды методом ионного обмена Вода последовательно проходит через катионитный и анионитный фильтры и поступает, распыляясь в дегазатор, где из нее удаляются растворенные диоксид углерода, кислород и другие газы. Для регенерации катионита в фильтр периодически подается кислота или раствор хлорида натрия, для регенерации анионита — раствор щелочи.
Электродиализом называется процесс диализа под воздействием электрического поля. При этом выделение солей из диализумого раствора происходит в результате перемещения ионов через пористые мембраны, содержащие катионит у катода и анионит у анода, с последующим их разрядом на электродах.
Водоподготовка в химическом производстве представляет весьма трудоемкий процесс и требует больших капитальных и эксплуатационных затрат. На современных химических предприятиях доля капитальных затрат на водоподготовку составляет 10−15% общего объема расходов на производство химической продукции.
Современные схемы промышленной водоподготовки включают все основные операции: осветление в грубых и коагуляционных отстойниках, фильтрование через зернистый материал, умягчение методом ионного обмена, дегазацию.
Огромные объемы воды расходуются промышленностью, сельским хозяйством, а в последнее время увеличилась потребность человека в воде на коммунально-бытовые нужды.
Одним из основных потребителей воды является промышленность, которая использует в настоящее время более 53 % общего объема потребления.
Файлы: 1 файл
Вода в промышленности.doc
Международный гуманитарно-экономический институт
Реферат на тему:
Артюшевский Алексей Александрович
Огромные объемы воды расходуются промышленностью, сельским хозяйством, а в последнее время увеличилась потребность человека в воде на коммунально-бытовые нужды.
Одним из основных потребителей воды является промышленность, которая использует в настоящее время более 53 % общего объема потребления.
В промышленности вода используется:
· Для охлаждения и нагревания жидкостей, газов и газовых смесей;
· Для приготовления и очистки растворов;
· Для транспортировки материалов и сырья по трубам;
· Для теплоэнергетических целей, в качестве пара для преобразования тепла или давления;
· Для удаления отходов и т. д.
В условиях ограниченности водных ресурсов в республике важное значение приобретает вопрос сокращения расходования воды на промышленные нужды. Это, прежде всего, широкое внедрение в производство оборотных и повторных систем использования воды. Такие системы наряду с экономным использованием чистой воды из источников будут способствовать уменьшению их загрязнения, дадут возможность дополнительно использовать вещества, которые находятся в загрязненных сточных водах, для нужд народного хозяйства, получая при этом дополнительный экономический эффект. Например, тепловые электростанции, используя оборотные системы, подают тепло в сельскохозяйственные теплицы на протяжении всего года. Второй источник экономии воды в промышленности — переход на более прогрессивные технологии производства, применение газовоздушных систем охлаждения. И, наконец, внедрение безводных систем производства, которое касается в первую очередь химической промышленности, где уже много технологических линий работает без использования воды.
Применение в практике указанных источников экономии позволит уже в ближайшее время сократить расходование воды на 15—20 % .
Если в производстве необходима чистая вода, ее берут из водопроводной системы. В тех случаях, когда вода может быть не особенно чистой, фабрики и заводы пользуются речную воду. Такие возможности используются на большинстве бумажных комбинатов. Потребление воды промышленностью в настоящее время достигло огромных размеров. По оценкам специалистов, безвозвратное водопотребление составляло около 150 куб. км в год, то есть 1% устойчивого стока пресных вод. По расчетам, потребность в воде на Земле до 2015 года будет возрастать в среднем на 3,1% в год. В настоящее время люди ежегодно расходуют 3000 км пресной воды.
На долю сельского хозяйства приходиться более 2/3 мирового потребления воды, примерно 17% посевных площадей во всем мире являются орошаемыми. Сейчас в мире под посевные площади занято около 15млн. квад. км.
В настоящее время положение усугубляется тем, что после приватизации основного числа предприятий, в том числе и экологически грязных предприятий, новым хозяевам не хватает денег для постройки или модернизации очистных сооружений.
Изучение качества воды природного источника позволяет установить характер необходимых операций по ее обработке. В некоторых случаях на очистные сооружения возлагается задача устранения какого-либо определенного недостатка природной воды или целого комплекса недостатков, а иногда — задача искусственного придания воде новых свойств, требуемых потребителем.
Все разнообразные задачи, возлагаемые на очистные сооружения, могут быть сведены к следующим основным группам:
1) удаление из воды содержащихся в ней взвешенных веществ (нестворимых примесей), что обусловливает снижение ее мутности; этот процесс носит название осветления воды;
2) устранение веществ, обусловливающих цветность воды, — обесцвечивание воды;
3) уничтожение содержащихся в воде бактерий (в том числе болезнетворных) — обеззараживание воды;
4) удаление из воды катионов кальция и магния — умягчение воды; снижение общего солесодержания в воде — обессоливание воды; частичное обессоливание воды до остаточной концентрации солей не более 1000 мг/л носит название опреснения воды.
В некоторых случаях может производиться удаление отдельных видов солей (обескремнивание, обезжелезивание и т. п.).
Степень необходимой глубины осветления, обесцвечивания, обессоливания воды зависит от характера ее использования. На очистные сооружения могут быть возложены также отдельные специальные задачи — удаление растворенных в воде газов (дегазация), устранение запахов и привкусов природной воды и др.
ОБОРОТНАЯ ВОДА (а. circulating water; н. Rucklaufwasser, Umlaufwasser; ф. eau de circulation, eau de restitution, eau recyclee; и. agua circulante) — техническая вода, многократно используемая в технологических операциях обогащения полезных ископаемых, при пылеулавливании и охлаждении в теплообменных аппаратах на обогатительной, окомковательной и агломерационной фабриках, а также при гидромеханизации горных работ. Обогатительную воду получают из технологических стоков (всего предприятия или отдельных технологических операций) путём их осветления и химической очистки (кондиционирования). Степень осветления зависит от влияния содержания твёрдой взвеси в обогатительной воде на те операции и процессы, где она применяется. Химическая очистка осуществляется только в крайне необходимых случаях, например при флотации.
Оборотная вода, как правило, потребляется раздельно в технологических операциях и в системах охлаждения. Оборотную воду стремятся использовать в максимальном количестве, добиваясь минимального расхода свежей производственной воды, добавляемой для компенсации потерь с технологическими продуктами и на испарение.
Оборотная вода должна обеспечивать высокие технико-экономические показатели производственного процесса; обладать минимальным коррозийным действием на аппаратуру, трубопроводы и сооружения; быть безвредной для обслуживающего персонала. Специфические требования к оборотной воде весьма разнообразны и во многом зависят от её предназначения и технических особенностей применения. Например, при использовании в технологии обогащения эти требования зависят от вида обогащаемого сырья, его физических свойств, способа и схемы обогащения. При обогащении угля и железистых кварцитов по гравитационным и магнитным схемам специфическим требованием к оборотной воде является соблюдение установленной для определённого вида операции оптимальной концентрации в ней твёрдой взвеси. Верхний предел концентрации устанавливается на основе технологических требований. В некоторых операциях этот предел достигает значительной величины и вода, уже использованная в технологическом процессе, возвращается без какой-либо очистки. Например, на углеобогатительных фабриках воду, получаемую от обезвоживания крупных концентратов на грохотах, направляют в оборот для транспортирования угля в отсадочные машины; слив дешламаторов железорудных обогатительных фабрик с содержанием 0,3-0,5% твёрдого компонента используют в процессах измельчения и классификации. На углеобогатительных фабриках часть оборотной воды используется после неглубокого осветления и только незначительную часть обогатительной воды подвергают глубокому осветлению с применением флокулянтов.
Предельным значением концентрации твёрдого компонента в оборотной воде для гравитационных процессов является концентрация, при которой практически не повышается вязкость среды, не нарушается классификация по крупности и разделение по плотности обогащаемого материала. Кроме ограничений по содержанию взвеси, к оборотной воде предъявляются требования по солевому составу, который формируется за счёт солей, присутствующих в природных водах, растворения рудных и нерудных минералов, входящих в состав данной руды, введения реагентов, а также продуктов очистки вод. Общая минерализация увеличивается за счёт ионов Ca2+, Mg2+, Na+, SO42-. Содержание ионов тяжёлых металлов в основном зависит от величины pH: при pH>7 они выпадают в осадок в виде гидроксидов и карбонатов. Приведение солевого состава к требуемым концентрациям является необходимым, а иногда и решающим для получения высоких технологических показателей, в частности в процессах флотации и флокуляции. Для создания оптимальных условий флотации необходимо постоянно учитывать солевой состав применяемых вод. Перед подачей в технологический процесс оборотная вода в большинстве случаев должна пройти специфическую обработку — кондиционирование.
В системах охлаждения оборотная вода должна иметь определённую температуру для создания оптимальных условий охлаждения агрегатов, обладать стабильностью свойств, препятствующих выпадению солей карбонатной жёсткости и "зарастанию" труб. Использование оборотной воды на промышленных предприятиях даёт не только экономию свежей воды, но и снижает количество сбрасываемых вод, а при полном водообороте гарантирует охрану окружающей среды от загрязнения её сточными водами.
Читайте также:

